复发性脑梗死患者氯吡格雷抵抗相关因素分析及治疗对策
2021-07-09刘美香马丽丽史兆博耿海威
刘美香 马丽丽 史兆博 张 磊 耿海威
开封市中心医院神经内科 河南开封 475000
缺血性脑血管病复发率较高,反复发作的脑血管病致残率极高,预后较差,抑制血小板聚集是防治脑血管病复发的有效手段。临床常用的抗血小板药物为阿司匹林和氯吡格雷,多数患者疗效较好,但少数人即便规范治疗仍会复发。随着检查技术的提高,发现部分患者存在氯吡格雷抵抗,导致抗血小板治疗效果差,病情反复发作,难以控制。氯吡格雷抵抗指长期规律口服氯吡格雷治疗后仍然发生血栓等不良事件及血小板二磷酸腺苷(adenosine diphosphate,ADP)诱导的血小板抑制率<30%[1],本文回顾性分析178例复发性脑梗死患者的临床资料,探讨复发性脑梗死患者发生氯吡格雷抵抗的危险因素及应用替格瑞洛替代治疗的临床效果,为临床缺血性脑血管病实施个体化治疗提供理论依据。
1 资料与方法
1.1一般资料 选择2015年3月~2017年5月在开封市中心医院神经内科住院的急性复发性脑梗死患者178例,发病时间均在3d以内。纳入标准:①急性脑梗死诊断标准均符合中华医学会神经病学分会脑血管病学组制订的“中国急性缺血性脑卒中诊治指南(2014)”中关于脑梗死的诊断,并均经颅脑CT或MRI证实;②急性脑梗死发病≥2次以上;③TOAST病因分型为大动脉粥样硬化型;④本次发病前均规律口服氯吡格雷片75mg/d,且≥7d。排除标准:①病情危重有意识障碍或存在严重合并症而不能完成检查和神经功能评定者;②存在严重心肝肾疾病、严重营养不良或近期有活动性出血者;③有血液系统疾病及血小板计数<100×109/L者;④有肺部及鼻部疾病者;⑤正在应用华法林等抗凝药物者;⑥对替格瑞洛过敏或用药过程中出现严重不良反应而终止用药者。
1.2分组及治疗 所有患者若无阿司匹林及他汀类禁忌,均继续联合应用阿司匹林肠溶片100mg/d及他汀类药物治疗;有禁忌者则单给氯吡格雷75mg,1次/d。入院次日均检测血小板抑制率,以ADP诱导的血小板抑制率<30%为氯吡格雷抵抗,>30%为氯吡格雷敏感;氯吡格雷抵抗者经CYP2C19基因型检测为中等代谢或正常代谢者建议氯吡格雷加量为75mg,2次/d或更换为替格瑞洛;CYP2C19基因型检测为慢代谢者则更换为替格瑞洛。根据用药选择分为氯吡格雷治疗组27例及替格瑞洛治疗组49例,氯吡格雷治疗组继续口服氯吡格雷(波立维 赛诺菲公司),增加剂量为75mg,2次/d;替格瑞洛治疗组停用氯吡格雷改为替格瑞洛(倍林达 阿斯利康公司)90mg 2次/d。
1.3观察指标监测 所有研究对象均行颅脑CT和/或MRI及颈动脉超声检查以判定为大动脉粥样硬化型脑梗死。应用便携式多导睡眠监测仪对患者睡眠状态连续监测7h,以观察睡眠呼吸暂停低通气综合征(obstructive sleep apnea-hypopnea syndrome,OSAHS)的发生率,主要观察呼吸暂停及低通气指数(apnea hypopnea index,AHI)、最低血氧饱和度。OSAHS指每夜7h睡眠中AHI反复发作30次以上或 AHI≥5次/h。于入院时及药物治疗2周后行神经功能缺损评分(national institutes of health stroke scale,NIHSS)。氯吡格雷抵抗者药物治疗2周后复查ADP诱导的血小板抑制率。
1.4实验室指标检测 采用PL-12多参数血小板功能分析仪(江苏英诺华医疗技术有限公司)检测血小板功能,所有研究对象于入院次日空腹采集静脉血置于3.8%枸橼酸钠血小板功能检测专用抗凝管,2h内进行检测。应用试剂ADP及花生四烯酸,检测机器直接测出最大聚集率。计算公式:最大血小板聚集率(%)=(原始血小板数-聚集后最低血小板数)/原始血小板数×100;血小板抑制率(%)=1-最大血小板聚集率(%)。
同型半胱氨酸(homocysteine,HCY)、尿酸(uric acid,UA)、胆固醇(total cholesterol,TC)、甘油三酯(triglyceride,TG)、低密度脂蛋白胆固醇(low-density lipoproteins cholesterol,LDL-C)、高密度脂蛋白胆固醇(high-density lipoproteins cholesterol,HDL-C)、糖化血红蛋白(hemoglobin A1c,HbA1c)等生化检查均采用罗氏P800全自动生化分析仪及配套试剂进行检测,质控合格。
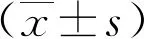
2 结果
2.1氯吡格雷抵抗相关危险因素分析 氯吡格雷抵抗组和敏感组性别、年龄、吸烟、饮酒、高血压病、HCY、UA、HDL-C、TC、TG比较,差异无统计学意义(P>0.05);氯吡格雷抵抗组糖尿病、OSAHS、HbA1c、LDL-C较敏感组增高,差异有统计学意义(P<0.05)。见表1。
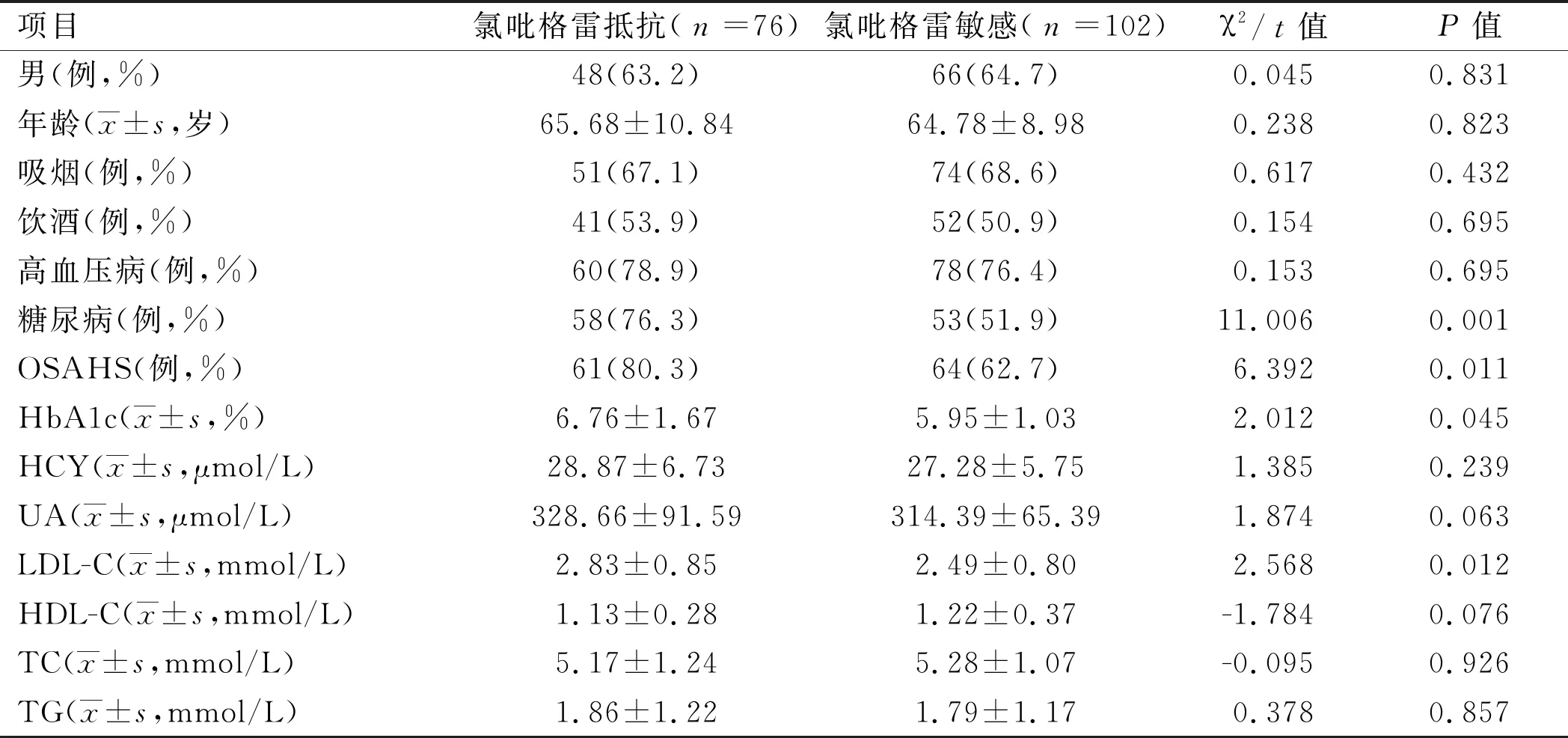
表1 178例急性复发性脑梗死患者氯吡格雷抵抗相关危险因素分析
2.2Logistic多元回归分析 以单因素分析中差异有统计学意义的糖尿病、OSAHS、HbA1c、LDL-C为自变量,以是否发生氯吡格雷抵抗为因变量,进行多元逐步Logistic回归分析(Forward LR 法)。结果显示:以α=0.05为界,HbA1c在Logistic分析过程中成为不显著因素而被剔除,最后有显著意义的因素:糖尿病、OSAHS、LDL-C进入回归方程,即糖尿病、OSAHS、LDL-C为氯吡格雷抵抗的独立危险因素(P<0.05)。见表2。
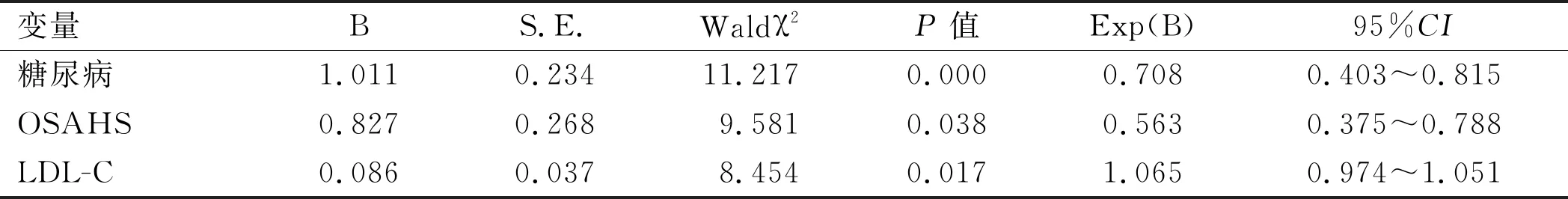
表2 氯吡格雷抵抗多因素Logistic回归分析
2.3氯吡格雷抵抗患者治疗前及治疗后2周血小板抑制率、NIHSS评分比较 治疗前氯吡格雷组和替格瑞洛组ADP诱导的血小板抑制率、NIHSS评分差异均无统计学意义。治疗后替格瑞洛组血小板抑制率高于治疗前及氯吡格雷组治疗后,差异有统计学意义(P<0.05);NIHSS评分小于治疗前及氯吡格雷组治疗后,差异有统计学意义(P<0.05)。见表3。
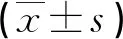
表3 氯吡格雷抵抗患者治疗前后ADP诱导血小板抑制率、NIHSS评分比较
3 讨论
脑梗死TOAST病因分型中重要的类型是大动脉粥样硬化型,由于大动脉硬化致脑血管狭窄、血栓形成。因此,抗血小板聚集治疗是目前被循证医学证实最有效的治疗和二级预防方法。阿司匹林是临床上广泛应用的血栓素抑制剂,是目前抗血小板治疗的基本药物。阿司匹林通过对环氧化酶-l的作用直接抑制血栓素A2合成,抑制血小板粘附聚集活性。氯吡格雷是噻吩吡啶类ADP受体P2Y12拮抗剂前体药物,需肝脏细胞色素P450酶代谢形成活性代谢物,与P2Y12受体不可逆结合,干扰ADP介导的血小板活化,抑制血小板聚集。2013抗血小板治疗中国专家共识指出对缺血性卒中再发的高危患者如无高出血风险,缺血性卒中或短暂性脑缺血发作后的第1个月内,阿司匹林75mg/d联合氯吡格雷75mg/d优于单用阿司匹林。本组178例患者均为高危大动脉粥样硬化型急性复发性脑梗死,首次发病后即给予阿司匹林联合氯吡格雷双重抗血小板聚集治疗,有阿司匹林用药禁忌的单给予氯吡格雷治疗,但效果不佳,仍有复发;除传统危险因素血压、血糖、血脂控制欠佳导致其复发外,经检测血小板抑制率结果显示有76例氯吡格雷抵抗,发生率为42.7%(76/178)。单因素分析显示氯吡格雷抵抗组糖尿病、OSAHS、HbA1c、LDL-C较敏感组增高,差异有统计学意义;进一步以是否发生氯吡格雷抵抗为因变量,以单因素分析中差异有统计学意义的糖尿病、OSAHS、HbA1c、LDL-C为自变量进行多元逐步Logistic回归分析,HbA1c在分析过程中成为不显著因素而被剔除,最后有显著意义的因素进入回归方程,即糖尿病、OSAHS、LDL-C为氯吡格雷抵抗的独立危险因素(P<0.05)。提示复发性脑梗死患者氯吡格雷抵抗的高发可能与糖尿病、OSAHS及高水平的LDL-C有关。
文献报道氯吡格雷抵抗受很多因素的影响,如胰岛素抵抗、P2Y12基因多态性、药物作用、ADP释放增多或者其他引起血小板激活途径上调的因素等,具体机制尚无统一认识。结合文献及本研究所见分析其导致氯吡格雷抵抗的因素可能有:①肝脏细胞色素P450同工酶的基因多态性[2],失功能基因CYP2C19显著降低血小板对氯吡格雷的反应,血小板聚集率仍较高。②药物的相互作用[3],有些药物通过细胞色素P450代谢,在治疗脑血管病联合用药中常用的他汀类药物如辛伐他汀和氟伐他汀影响氯吡格雷抗血小板聚集,治疗消化道溃疡的质子泵抑制剂如奥美拉唑、埃索美拉唑降低氯吡格雷的作用。③2型糖尿病患者体内的氧化应激反应导致活性氧家族显著增加,抗氧化物质水平降低;P2Y12受体表达增加、循环中ADP水平增高、酯酶活性增高导致血小板激活途径过度上调等[4]。糖尿病患者的血小板表面膜蛋白糖基化水平较高,竞争性抑制膜蛋白的乙酰化,减弱氯吡格雷抗血小板聚集的效果[5]。④OSAHS患者长期慢性缺氧可使血液黏稠度增加,血小板被激活、聚集、纤维蛋白沉积[6]。OSAHS可以影响胰岛素抵抗[7],OSAHS患者血清瘦素水平升高,易导致糖代谢异常; Westerbacka 等[8]发现存在有胰岛素抵抗的肥胖症患者氯吡格雷抗血小板的作用明显受限。国内外文献[9-10]报道有糖尿病、LDL-C、血糖浓度异常的患者CYP2C19变异率高,LDL-C水平升高也是氯吡格雷抵抗的危险因素。OSAHS影响脂质代谢异常[11],可能是缺氧使体内极低密度脂蛋白产生增加,抑制了组织中LDL-C的活性,增加了血浆中LDL-C的含量,高水平的LDL-C可刺激单核细胞与血小板的粘附, LDL-C的代谢也可能和P2Y12基因多态性有关。
替格瑞洛是非噻吩吡啶类药物,为新型的P2Y12受体拮抗剂,无需经过肝脏生物转化,不受肝脏P2Y12基因多态性的影响;药物本身及其代谢产物均具有活性,口服后迅速吸收,起效快,疗效稳定,对P2Y12受体的抑制作用是可逆的,出血风险低[12]。与氯吡格雷相比,替格瑞洛可提供更快和更完全的抗血小板作用,氯吡格雷抵抗者可考虑选择此药替代。本研究中氯吡格雷抵抗者应用替格瑞洛治疗2周后其ADP诱导的血小板抑制率高于治疗前及氯吡格雷组治疗后;NIHSS评分低于治疗前及氯吡格雷组治疗后。提示替格瑞洛治疗氯吡格雷抵抗可有效抑制ADP诱导的血小板聚集,改善神经功能缺损程度。替格瑞洛在心血管领域应用及相关研究较多,脑血管病方面应用较少,主要是因为脑血管病病因复杂,复发性脑梗死者多是血管基础差、合并出血或微出血,伴有高血压、糖尿病等疾病,联合用药多,临床应用此药时往往顾虑其出血风险;因为,尚需大样本、多中心对比研究其在缺血性卒中的应用安全性。
综上所述,对于高危的反复发作的脑血管病患者,在常规积极抗血小板治疗的情况下仍不能控制其发作,应考虑存在氯吡格雷抵抗,早期给予行相关检查,及时作出判断,做到个体化治疗,针对性应用有效的抗血小板聚集药物,控制病情,改善预后。
