雌激素通过磷脂酰肌醇3-激酶/蛋白激酶B 信号转导途径对钙诱导的大鼠血管平滑肌细胞钙化的影响△
2021-07-09吴新华万家溪陈章荣赵秋燕
吴新华,万家溪,刘 宏,陈章荣,杨 伟,赵秋燕
(1.大理大学第一附属医院心内科,云南大理 671000;2.云南省跨高原心血管疾病防治工程研究中心,云南大理 671000;3.大理大学跨高原心血管疾病防治研究所,云南大理 671000)
冠状动脉钙化(coronary artery calcium,CAC)是冠状动脉粥样硬化的标志[1],CAC 与性别有明显关系。研究表明,未绝经妇女的CAC 程度及发病率明显低于同龄男性[2],绝经后女性CAC 与同龄男性无明显差异[3]。老年女性常有收缩压增高,脉压差增大,研究显示脉压差增大与CAC 呈正相关[4]。说明雌激素在CAC 的发生、发展过程中发挥着重要的干预作用。本课题前期的动物实验采用维生素D3 诱导大鼠主动脉平滑肌钙化,并联合去势模型,同时给与雌激素50 μg/kg 进行替代治疗,发现雌激素可减少维生素D3 诱导的血管壁钙盐沉积。与钙化组相比,雌激素干预组成骨分化相关蛋白Runx2、骨钙蛋白(bone gla-protein,BGP)表达下降。以上结果提示雌激素可能是通过Runx2 来影响CAC 的形成,但雌激素如何引起Runx2 改变的分子生物学机制仍不清楚。研究表明,磷脂酰肌醇-3 激酶(phosphatidylinositol 3-ki⁃nase,PI3K)和蛋白激酶B(protein kinase B,Akt)信号转导通路在成骨细胞中的磷酸化和激活Runx2等多种骨分化相关蛋白中起关键作用[5],而雌激素又可通过PI3K/Akt 信号转导通路的激活来促进肿瘤细胞的增殖、迁移等过程[6],本课题前期研究发现雌激素可通过抑制Runx2 表达来减轻大鼠的血管钙化。因此,我们推测雌激素可能通过PI3K/Akt 信号转导通路降低Runx2 表达。血管平滑肌细胞(vascular smooth muscle cells,VSMCs)向成骨细胞转化过程在CAC中起重要作用,本实验采用大鼠胸大动脉平滑肌细胞株(A7r5)制作钙化模型,观察雌激素干预细胞钙化情况,明确雌激素影响VSMCs表型转化的主要信号调节通路。
1 材料和方法
1.1 主要材料
大鼠胸主动脉平滑肌细胞A7r5 来自中国科学院细胞库。β雌二醇和钙浓度测定试剂盒为美国sigma aldrich 公司产品,PI3K/Akt 信号转导通路拮抗剂LY294002 和碱性磷酸酶(alkaline phospha⁃tase,ALP)检测试剂盒为中国碧云天公司产品,CaCl2(CaCl2)为中国成都临江化工厂产品,抗-Runx2 抗体、抗-Akt1/2/3 抗体和抗-磷酸化(phos⁃phate,p)-Akt 抗体为英国Abcam 公司产品,二抗HRP 为中国Proteintech 公司产品,茜素红S 染色液为中国Solarbio 公司产品。
1.2 细胞培养方法
细胞培养用DMEM 高糖培养基(含有10%胎牛血清和1%青/链霉素),于37 ℃、5%二氧化碳培养箱中培养,每2 d 更换培养液,生长融合达80%左右时进行传代培养。
1.3 钙化模型CaCl2浓度、雌激素干预浓度和时间的确定
根据预实验结果选择5 mmol/L 的CaCl2、100 nmol/L 雌激素干预细胞9 d 为最佳干预时间。
1.4 细胞分组方法
将A7r5 细胞随机分为正常对照组、钙化组、雌激素干预组(钙化+雌激素)、雌激素溶媒对照组(钙化+Eth)、LY294002 干预组(钙化+LY294002)。钙化组加入5 mmol/L 的CaCl2溶液,雌激素干预组加入5 mmol/L的CaCl2溶液和100 nmol/L的雌激素,雌激素溶媒对照组加入5 mmol/L 的CaCl2溶液和10 nmmol/L 的乙醇,干预组加入5 mmol/L 的CaCl2溶液和10 μmol/L 的LY294002。
1.5 A7r5 细胞钙化模型建立方法
分别使用1、5、10 mmol/L 3 种不同浓度的CaCl2溶液与A7r5 细胞共同培养12 d 后行茜素红染色观察。
1.6 细胞茜素红染色方法
细胞钙化模型诱导分化结束后,弃培养基,95%乙醇固定10 min;磷酸盐缓冲液(PBS)冲洗后加入0.1%茜素红染色剂1 mL 置于37℃恒温箱中染色30 min;磷酸盐缓冲液冲洗后在倒置显微镜下观察并采集图像。
1.7 细胞钙浓度测定方法
细胞钙化模型诱导分化结束后,用去离子水冲洗,刮下细胞,收集细胞混悬液,完成细胞计数后在超声波振荡机中破坏细胞。按照钙浓度测定试剂盒说明,用酶标仪在575 nm 处测各组OD 值,根据标准品的浓度和OD 值计算出标准曲线的回归方程式,并计算出样品浓度。
1.8 碱性磷酸酶活性检测
细胞钙化模型诱导分化结束后,用去离子水冲洗,样品中加入IP 细胞裂解液(无抑制剂),在超声波裂解机中裂解10 min,随后离心取上清液;根据ALP 检测试剂盒说明,用酶标仪在415 nm处测定样品OD 值,根据标准品的浓度和OD 值计算出标准曲线的回归方程式,并计算出样品ALP 活性。
1.9 实时聚合酶链反应检测Runx2 mRNA 的表达水平
引物设计应用primer 5.0 设计,Oligo 7 验证,交由Invitrogen Custom Primers 公司合成,Runx2 引物设计序列:F(5′-CCTCGAATGGCAGGACGCTA-3′);R(5′-AGACTCATCCATTCTGCCGCTA-3′);β-Actin F(5′-TGTGCTGGACTCTGGAGATG-3′);R(5′-GAAGGAATAGCCACGCTCAG-3′)。具体步骤:总RNA 提取,总RNA 完整性、浓度和纯度测定,反转录[所得RNA 与Mix 混合离心后置于聚合酶链反应(polymerase chain reaction,PCR)仪中央区42 ℃,15 min;95 ℃,3 min,获得cDNA],qPCR实验(qPCR 反应体系配制+qPCR 反应程序设置)。
1.10 Western blot 法检测方法
具体步骤如下:总蛋白提取,测定总蛋白浓度(BCA 微管测定法),制胶,上样及电泳,转膜(半干转),应用1×TBST 洗膜3 次(摇床10 min、10 min、5 min),脱脂牛奶4℃封闭过夜,加入一抗(Runx2为1∶1 000;Akt 为1∶1 000;P-Akt 为1∶1 000),4℃孵育8 h,回收一抗,加入二抗(1∶5 000),孵育盒放在摇床上4℃孵育80 min,化学发光与曝光。
1.11 统计学分析
所有数据采用SPSS 21.0 统计学软件进行分析。正态分布的计量资料以()表示,多组间比较采用单因素方差分析,进一步两两比较采用Student-Newman-Keuls检验。以P<0.05 为差异有统计学意义。
2 结果
2.1 建立钙化模型的CaCl2溶液浓度确定结果
与正常对照组细胞比较,随CaCl2溶液浓度升高,实验组橘红色钙化结节逐渐增多。CaCl2溶液浓度为5 mmol/L 时的细胞钙化明显,且细胞成活率高;而浓度为10 mmol/L 时,虽然钙化明显,但细胞成活率低。故后续实验选用5 mmol/L CaCl2溶液进行钙化模型建立。钙化模型成功标志是可见实验组大量钙化结节,茜素红染色后钙化细胞呈红色,并分布于整个细胞,对照组没有附着红色染料,实验组细胞在钙化诱导条件下有钙盐沉积。
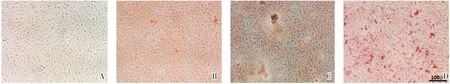
图1 不同钙化时间组细胞钙化结节光学显微镜下图片比较 [×40,茜素红染色;A 为正常对照组;B 为5 mmol/L CaCl2溶液钙化组(6 d);C 为5 mmol/L CaCl2溶液钙化组(9 d);D 为5 mmol/L CaCl2溶液钙化组(12 d)]
2.2 不同CaCl2溶液浓度及干预时间组细胞钙浓度及碱性磷酸酶活性比较
随着培养基中CaCl2溶液浓度的增高,细胞钙浓度及ALP 活性逐渐升高(图2a、图2b)。当培养基中CaCl2溶液浓度为1 mmol/L时,细胞的ALP活性与正常对照组比较,差异无统计学意义(P>0.05);当培养基中CaCl2溶液浓度达到10 mmol/L 时,钙浓度较5 mmol/L 时升高已不明显。使用5 mmol/L CaCl2溶液分别在6、9、12 d 测定细胞钙浓度及ALP 活性,发现钙化组较正常对照组细胞钙浓度及ALP 活性明显升高,差异有统计学意义(P<0.01)。细胞钙浓度及ALP 随着培养时间延长而增高(图2c、图2d)。当培养时间为6 d 时,细胞的ALP 活性与正常对照组比较,差异无统计学意义(P>0.05);当培养时间达到12 d 时,细胞钙浓度及ALP 活性较9 d 时升高已不明显(P>0.05)。
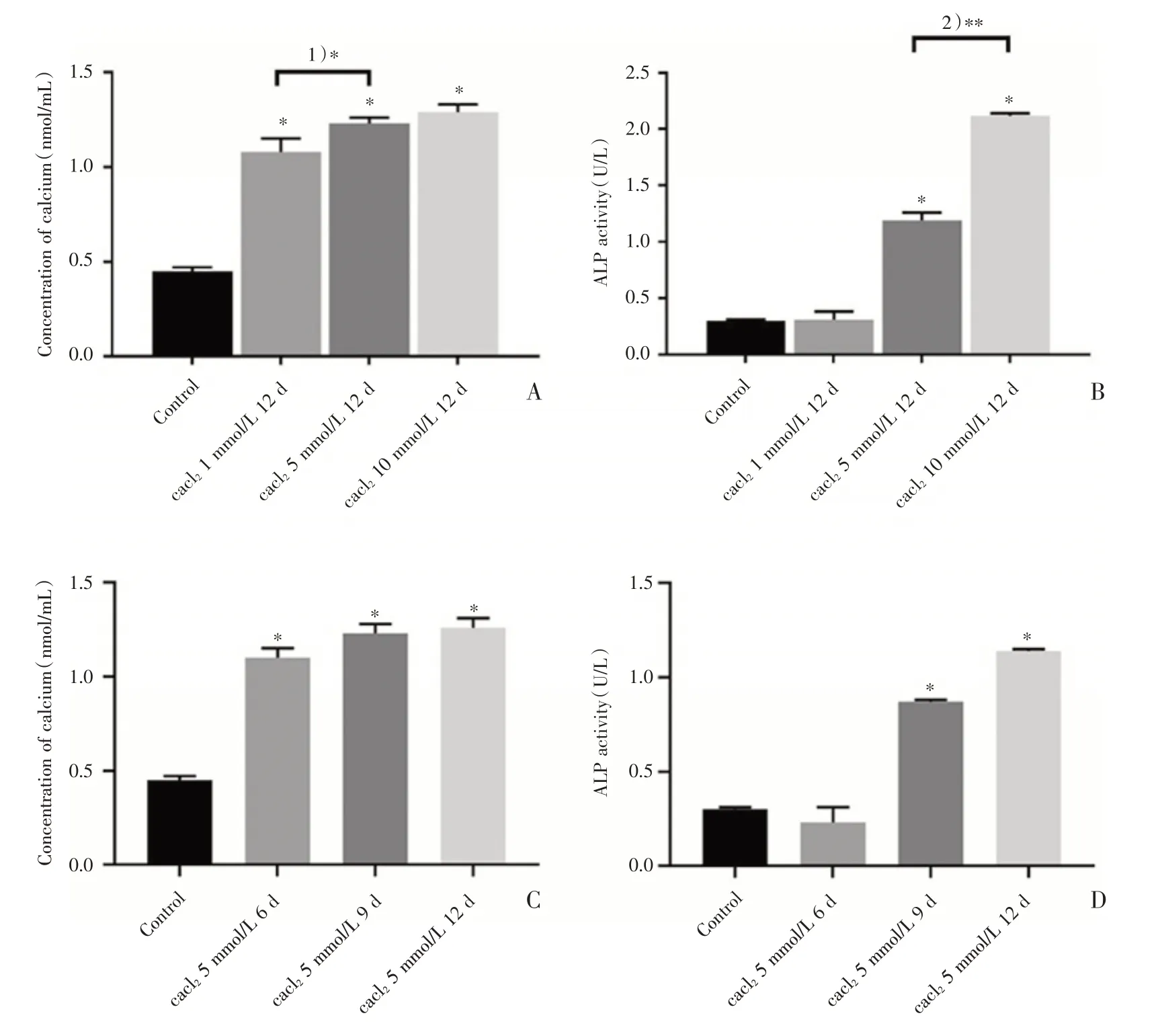
图2 不同CaCl2溶液浓度及干预时间组细胞钙浓度及ALP 活性比较柱状图
2.3 不同雌激素浓度组细胞钙浓度及碱性磷酸酶活性比较
分别使用10、100、1 000 nmol/L 浓度的雌激素对5 mmol/L CaCl2溶液建立的钙化模型进行干预,在干预的第9 天,与钙化对照组相比,雌激素干预组茜素红染色钙化结节减少,100 nmol/L 浓度时钙化减轻明显且细胞成活率高。不同浓度雌激素干预组细胞钙浓度及ALP活性均明显下降(P<0.01),其中钙化+雌激素(100 nmol/L)组的抑制效果最理想(图3 和图4)。

图3 不同雌激素浓度组A7r5 细胞钙化程度光学显微镜下图像比较(×100,茜素红染色)

图4 不同雌激素浓度组A7r5 细胞钙浓度及ALP 活性比较柱状图
2.4 各组细胞钙浓度及碱性磷酸酶活性比较
与对照组比较,钙化组细胞钙浓度、ALP 活性明显升高,差异有统计学意义(P<0.01)。与钙化组相比,雌激素干预组(100 nmol/L)细胞有抑制钙盐沉积的效果,差异有统计学意义(P<0.01)。LY294002 干预组细胞ALP 活性较钙化组降低,差异有统计学意义(P<0.05),但两组钙浓度比较差异无统计学意义(P>0.05)。雌激素溶媒对照组细胞钙浓度和ALP 活性与钙化组比较,差异无统计学意义(P>0.05)。各组细胞钙浓度及ALP 活性比较见图5 和图6。

图5 各组A7r5 细胞钙化程度光学显微镜下图像比较(茜素红染色)
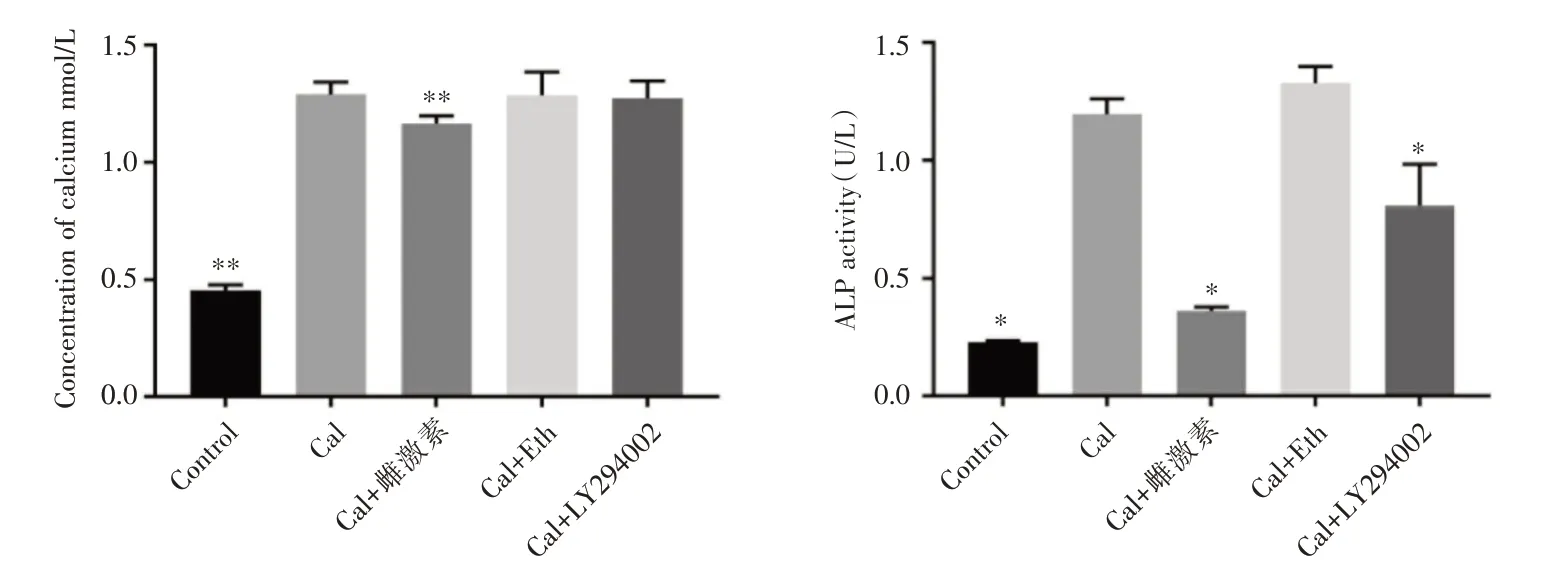
图6 各组A7r5 细胞钙浓度及ALP 活性比较柱状图
2.5 各组细胞Akt 蛋白表达水平和Runx2 表达水平比较
雌激素干预组、LY294002干预组与对照组细胞的p-Akt 蛋白表达比较,差异无统计学意义(P>0.05);钙化组细胞与对照组比较,p-Akt 蛋白表达显著增加,差异有统计学意义(P<0.05)。与钙化组比较,雌激素干预组和LY294002干预组p-Akt蛋白表达水平显著降低,差异有统计学意义(P<0.01)。与对照组对比,钙化组Runx2 mRNA 和蛋白表达水平显著增高,差异有统计学意义(P<0.05)。与钙化组相比,雌激素干预组和LY294002 干预组Runx2 mRNA 和蛋白表达水平显著降低,差异有统计学意义(P<0.05);雌激素溶媒对照组Runx2 mRNA 和蛋白表达水平与钙化组比较,差异无统计学意义(P>0.05)。各组细胞Akt 蛋白表达水平和Runx2 表达水平比较,见图7。

图7 各组细胞Akt 蛋白表达水平和Runx2 表达水平比较柱状图(a 为各组Runx2 mRNA 比较;b 为各组细胞T-Akt、p-Akt、Runx2 电泳凝胶图像;c 为各组细胞p-Akt 蛋白表达水平比较;d 为各组细胞Runx2 蛋白表达比较)
3 讨论
CaCl2溶液是最常用诱导细胞钙化的制剂之一,诱导细胞钙化时间为8~14 d[7-8]。本实验确定CaCl2溶液制作细胞钙化模型最佳浓度为5 mmol/l,诱导钙化最佳时间为9 d。
本实验对钙化细胞进行雌激素浓度干预梯度实验,发现钙离子浓度及ALP 活性显著下降,说明雌激素通过降低钙离子和ALP 活性来抑制血管钙化,且雌激素抑制效果随着浓度升高而增强。雌激素不仅是影响成骨细胞表型转化的重要激素,还是减轻CAC 的内源性保护物质。但随着雌激素浓度继续增加,相应的细胞钙离子浓度及ALP 活性未有相应的明显下降,考虑这与高浓度雌激素对细胞的毒性作用增强有关。本实验结果显示雌激素最佳干预浓度及时间与Nanao 等[9]使用雌激素(终浓度100 nmol/L)干预无机磷诱导的血管平滑肌钙化实验得到的结果一致。
本研究结果显示,当诱导细胞钙化后,Runx2基因及蛋白水平明显上升,说明Runx2 与血管钙化密切相关。Hyun 等[10]研究发现,过氧化氢促进VSMCs 从收缩型到成骨表型的表型转换过程需要Runx2 介导,从而影响其下游的ALP、OC、SM22a等骨、平滑肌细胞形成标志物,进而影响钙化形成。同时,使用腺病毒转染VSMCs 使Runx2 过度表达,发现钙化也同步增加。本研究结果与上述结果相似。当使用雌激素干预钙化的VSMCs 后,细胞的Runx2 mRNA 及Runx2 蛋白表达水平的表达降低,说明雌激素降低细胞钙化水平是通过降低Runx2 的表达实现。Osako 等[11]研究表明,在人类VSMCs,雌激素可以通过ERα 抑制RANKL 信号,降低Runx2 mRNA 水平,最终影响钙化形成。在成骨分化过程中,Runx2 受P13K/Ak t 信号通路调节[12]。在氧化应激诱导的VSMCs 钙化过程中,Runx2 是一个关键调节因子,受到PI3K/Akt 通路的调节[10],我们推测雌激素可能是通过PI3K/Akt 信号转导通路来影响Runx2 的表达从而发挥这种抑制作用。
为了进一步明确上述猜测,本研究使用PI3K/Akt 信号转导通路抑制剂(LY294002)干预,测定P-Akt、Runx2 表达情况和对细胞钙化的影响。本实验结果显示,当诱导细胞钙化后,钙化组的PAkt 蛋白水平较正常对照组明显上升,说明PI3K/Akt 信号转导通路的激活可以促进VSMCs 钙化。在使用雌激素干预后,发现雌激素降低了钙化细胞中的Runx2、P-Akt蛋白水平表达;加入LY294002后,Runx2、P-Akt蛋白水平明显下降,这说明雌激素与LY294002 有相同的作用,证明雌激素是通过抑制PI3K/Akt 信号转导通路下调Runx2 的表达,从而达到抑制VSMCs 钙化的目的。研究发现PI3K/Akt信号转导通路在钙化过程中起重要作用,Chang等[13]在大鼠血管平滑肌中使用钙磷诱导钙化后,发现钙化组信号转导通路调节蛋白P-Akt 活化,提示P13K/Akt 信号转导通路的激活可以促进钙磷诱导的VSMCs 向成骨表型转化。Liang 等[14]研究表明,Akt 可增强叉头蛋白(FOXO)的磷酸化,调节Runx2的泛素化,增强Runx2表达,从而导致VSMCs钙化。这都与本实验的结论一致。无论雌激素还是PI3K/Akt 抑制剂干预,总Akt 水平均无变化,而p-Akt 蛋白水平明显降低,Runx2 表达也相应降低,说明雌激素及LY294002 主要影响Akt 磷酸化。有研究表明,PI3K/Akt 通路参与Runx2 依赖的成骨分化、软骨分化,使用LY294002 后Akt 去磷酸化,成骨作用被抑制[10,12]。Akt 活化能增强叉头蛋白的磷酸化,调节Runx2 的泛素化,减少Runx2降解,从而导致VSMCs钙化[14]。
综上所述,本研究在体外VSMCs 钙化模型中发现,雌激素抑制VSMCs 钙化是通过PI3K/Akt 信号转导通路来降低Runx2 的表达进行调节。但雌激素对心血管系统的保护作用机制非常多,涉及多通路、多靶点,本研究也只探讨了其中一条通路,完整的作用机制仍需进一步深入研究。本研究探讨了雌激素在血管钙化中所发挥的保护作用及其分子生物学机制,为治疗心血管疾病提供新的思路与靶点。
