环丙沙星对血管平滑肌细胞表型转换的调控作用
2021-07-09黄尚军黄筱然陈国娜杨航真
黄尚军,黄筱然,陈国娜,杨航真,李 欣,4
[1.华南理工大学医学院,广州 510006;2.广东省人民医院(广东省医学科学院)全科医学科,广州 510100;3.华南理工大学生物科学与工程学院,广州 510006;4.广东省人民医院(广东省医学科学院)急诊科,广州 510100]
主动脉夹层(aortic dissection,AD)是各种原因引起的主动脉内膜中膜撕裂,可导致血液流入将主动脉分隔成真腔和假腔。AD 的病理学特征性改变是主动脉中膜血管平滑肌细胞(vascular smooth muscle cells,VSMCs)丢失和细胞外基质降解[1]。AD 的发生、发展与VSMCs 的状态和功能密切相关,AD 患者的主动脉中分泌型VSMCs 增多,收缩型VSMCs 减少[2-4]。大量临床研究发现包括环丙沙星(ciprofloxacin,CPFX)在内的氟喹诺酮类药物可增加AD 的发病风险[5-9]。CPFX 是一种人工合成的第三代氟喹诺酮类药物,通过抑制细菌DNA 拓扑异构酶IV 和DNA 回旋酶发挥抗菌作用,具有抗菌谱广、抗菌作用强的特点,临床应用广泛。一项关于CPFX 增加小鼠AD 易感性的研究发现,单用CPFX 仅能扩张主动脉内径,不能显著增加AD 发生率和破裂率,在高脂饮食和血管紧张素Ⅱ(angiotensin Ⅱ,Ang Ⅱ)构建的AD 小鼠模型中加入CPFX 后,AD 发生率和破裂率显著升高[10]。虽然目前有关于CPFX 增加AD 发病风险的研究,但其机制研究尚未完全阐明。因此,本研究旨在通过体外实验探讨CPFX 是否通过VSMCs 表型转换导致AD 发病风险增加。
1 材料和方法
1.1 实验材料
本研究使用的VSMCs 来源于器官捐献患者的主动脉组织,标本收集遵循的程序符合广东省人民医院(广东省医学科学院)医学伦理委员会所制订的伦理学标准并得到该委员会批准(No.GDREC2018060H),且患者家属签署有知情同意书,对本研究知情同意。倒置显微镜(Nikon,日本);荧光显微镜(Nikon,日本);平滑肌肌动蛋白α(αsmooth muscle actin,α-SMA)(Ab5694)、平滑肌蛋白22(smooth muscle 22,SM22)(Ab10135)、类肌钙蛋白(calponin)(Ab46794)、甘油醛-3-磷酸脱氢酶(glyc⁃eraldehyde-3-phosphate dehydrogenase,GAPDH)(Ab9485)、Ki-67(Ab15580)均购自美国Abcam公司;骨桥蛋白(osteopontin,OPN)(BS1264)购自美国bio⁃world公司;电泳仪购自美国Bio-RAD公司;4′,6-二脒基-2-苯基吲哚(4′,6-diamidino-2-phenylindole,DAPI)和Ang Ⅱ购自美国Sigma公司;CCK-8试剂盒购自日本同仁公司;CPFX购自中国麦克林公司;聚偏二氟乙烯(polyvinylidene fluoride,PVDF)膜购自中国爱尔兰Millipore 公司;Tris 缓冲液(tris buffered saline,TBS)购自中国博士德公司,吐温-20 购自中国索莱宝公司,电化学发光(electrochemilumines⁃cence,ECL)底物试剂盒购自中国Biosharp公司。
1.2 组织贴壁法分离培养血管平滑肌细胞方法
取手术切除的供体来源的新鲜主动脉血管,无菌磷酸盐缓冲液(phosphate buffered saline,PBS)清洗血管表面的血液后于超净工作台内钝性分离主动脉内膜、中膜、外膜。将主动脉中膜组织剪成2 mm×2 mm 的碎块,并将碎块均匀地平铺于培养瓶内,倒置于二氧化碳培养箱中2 h,待组织块自然贴壁后翻转培养瓶,加入1 mL 完全培养基,定期更换培养基并观察组织块周围细胞情况,待组织块附近的细胞生长到70%~80%时,进行传代培养或实验干预。
1.3 免疫荧光染色方法
取生长状况良好的VSMCs 种于6 孔板内,待细胞生长融合到70%~ 80%时,弃除培养基,PBS缓冲液浸洗,4%多聚甲醛固定15 min,用含0.1%Triton X-100 的PBS 缓冲液通透20 min,含1% 胎牛白蛋白+10%胎牛血清的PBS 缓冲液封闭30 min后加入一抗,4℃孵育过夜。PBS 缓冲液浸洗后,避光条件下加入荧光二抗。室温避光孵育1 h 后滴加含DAPI 的封片剂复染细胞核,盖玻片封片,荧光显微镜观察,随机选择视野拍照并储存,图片后期叠加采用Image J 1.52a 版本(NIH,USA)软件。
1.4 CCK-8 检测方法
取生长状态良好的VSMCs 接种于96 孔板中,待细胞贴壁后,无血清培养基培养24 h。分别给予不同的药物干预,达到干预时间后,弃除培养基,按照说明书加入含CCK-8 试剂的培养基,二氧化碳培养箱内孵育1 h,全波长酶标仪检测吸光度,并分析检测结果。
1.5 Western blot 检测方法
取干预后的VSMCs,总蛋白提取试剂盒提取总蛋白,BCA 试剂盒检测蛋白浓度,按每孔30 μg蛋白计算上样量,100℃变性10 min。配置十二烷基苯硫酸钠-聚丙烯酰胺电泳凝胶(SDS-PAGE),按照分组依次加样,恒压80 V 电泳30 min 后转为恒压110 V 电泳90 min。电泳结束后,将凝胶中的蛋白转印到PVDF 膜上,5%脱脂牛奶封闭1 h,按目的蛋白分子量裁膜,与对应的一抗4℃摇床孵育过夜。TBST 洗膜,与二抗4℃孵育2 h,TBST 洗膜,ECL 发光液成像,ImageJ 1.52a(NIH,USA)测量灰度值,并统计分析。
1.6 统计学分析
本研究所有实验数据的统计分析采用GraphPad Prism 8.0.2(GraphPad Software,CA)软件。单因素多组间实验数据的比较采用单因素方差分析(one-way ANOVA),两因素多组间实验数据的比较采用两因素析因设计资料的方差分析(two-way ANOVA)。以P<0.05 表示差异有统计学意义。
2 结果
2.1 原代培养的供体来源血管平滑肌细胞
主动脉中膜的主要细胞成分是VSMCs,通过组织贴壁培养法,VSMCs 能从主动脉中膜组织中迁移出来,并通过有丝分裂大量增殖。
图1 原代培养的VSMCs光学显微镜下图片(标尺=100 μm)
2.2 血管平滑肌细胞鉴定
免疫荧光染色检测VSMCs 标志物用来鉴定从主动脉中膜中迁移出来的细胞是否为VSMCs 并检测VSMCs 的纯度。VSMCs 的标志物有多种,本实验用来检测VSMCs 的标志物为SM22、α-SMA、cal⁃ponin。VSMCs 标志物阳性且有DAPI 标记细胞核的细胞为VSMCs,见图2。
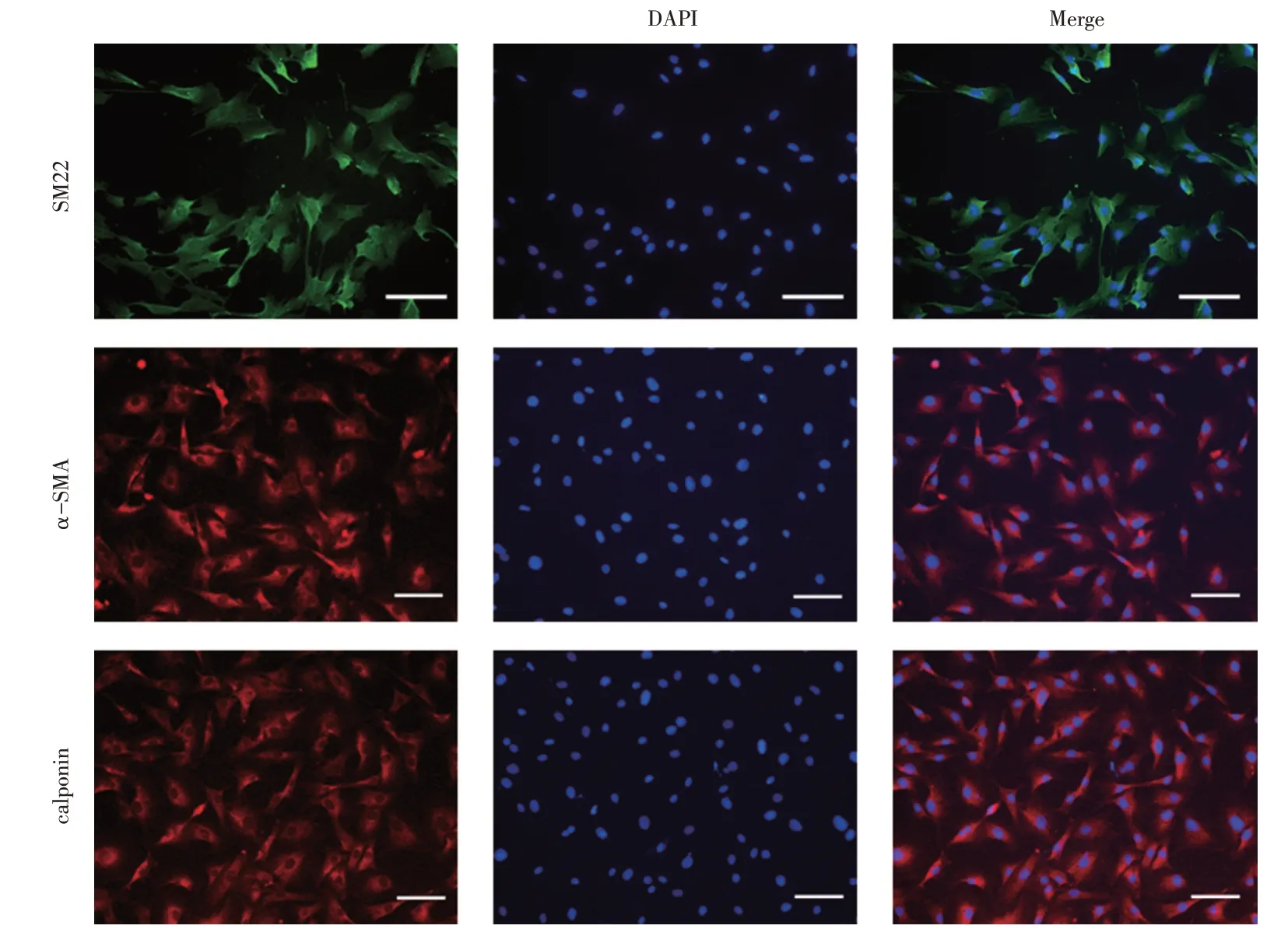
图2 VSMCs表型鉴定荧光显微镜下图片(第一行绿色荧光为SM22阳性;第二行红色荧光为α-SMA阳性;第三行红色荧光为calponin 阳性;蓝色荧光为DAPI,用来染细胞核;标尺=100 μm)
2.3 环丙沙星干预后血管平滑肌细胞生长曲线
给予VSMCs 不同浓度的CPFX,干预不同的时间后,加入CCK-8,测量光密度(optical density,OD)值,对OD 值进行两因素析因设计资料的方差分析,选择CPFX 干预的最佳浓度和时间。通过统计分析,CPFX 在160 μg/mL 的浓度条件下,干预72 h 差异最显著(P<0.01),见图3。
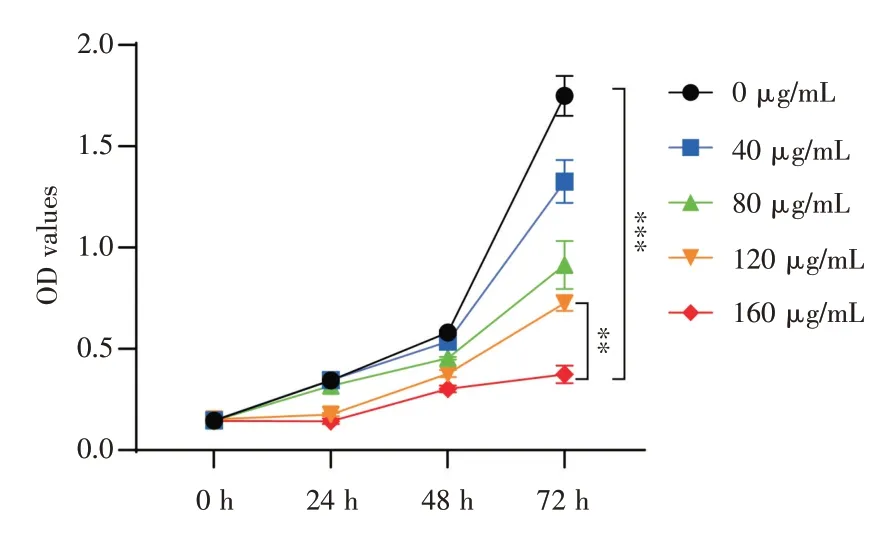
图3 不同浓度CPFX 干预VSMCs 不同时间后CCK-8检测结果(n≥3)
2.4 不同药物干预血管平滑肌细胞后CCK-8检测结果比较
CCK-8 可检测CPFX、AngⅡ、CPFX+AngⅡ对VSMCs 增殖的影响,干预72 h 后,通过单因素方差分析发现,与对照组相比,CPFX 组OD 值减小,差异有统计学意义(P<0.01);与对照组相比,CPFX+AngⅡ组OD 值明显降低,差异有统计学意义(P<0.001);与CPFX 组相比,CPFX+AngⅡ组OD 值减小,差异有统计学意义(P<0.01),见图4。

图4 不同药物干预VSMCs72 h 后CCK-8 检测结果比较(n=8)
2.5 不同药物干预血管平滑肌细胞后Ki-67 染色结果比较
Ki-67免疫荧光染色发现,与对照组相比,CPFX组VSMCs 的Ki-67 相对阳性率降低,差异有统计学意义(P<0.01);与对照组相比,CPFX+AngⅡ组VSMCs 的Ki-67 相对阳性率明显降低,差异有统计学意义(P<0.001);与CPFX组相比,CPFX+AngⅡ组VSMCs 的Ki-67 相对阳性率降低,差异有统计学意义(P<0.05),见图5。

图5 不同药物干预VSMCs 后Ki-67 染色结果比较(A 图为荧光显微镜下图像,红色荧光为Ki-67 染色阳性,蓝色荧光为DAPI,标尺=100 μm;B 图为与对照组相比的Ki-67 相对阳性率,n≥33)
2.6 不同药物干预血管平滑肌细胞后各表型转换相关蛋白表达水平比较
Western blot结果显示,与对照组相比,CPFX组VSMCs 收缩型标志物calponin、α-SMA、SM22 表达水平降低(P<0.01),分泌型标志物OPN 表达水平升高(P<0.05),差异有统计学意义;与对照组相比,CPFX+AngⅡ组calponin、α-SMA、SM22 表达水平降低(P<0.01),OPN 表达水平升高(P<0.001),差异有统计学意义;与CPFX 组相比,CP⁃FX+AngⅡ组calponin、α-SMA、SM22 表达水平降低(P<0.05),OPN表达水平升高(P<0.01),差异有统计学意义,见图6。
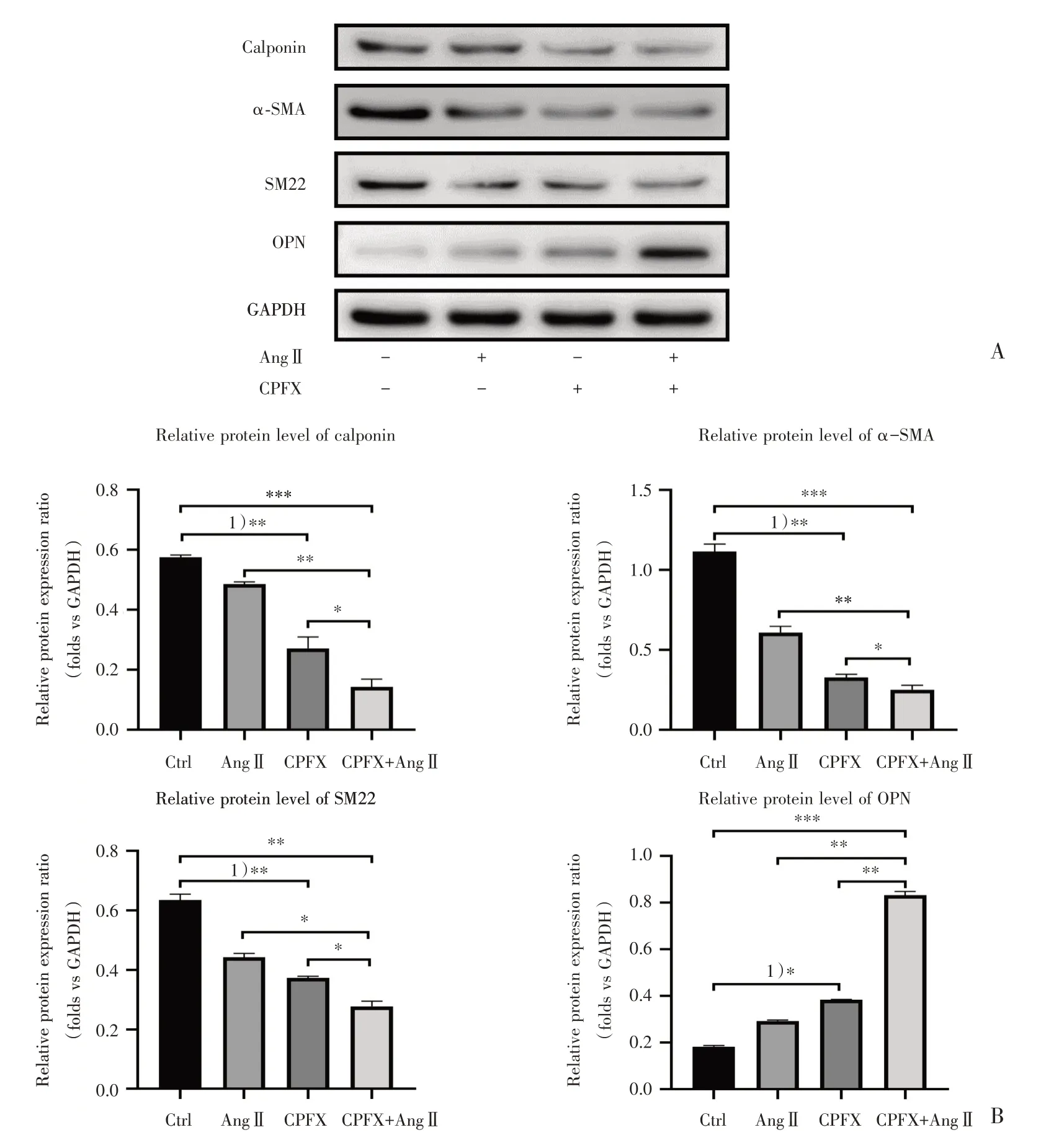
图6 不同药物干预VSMCs 后各表型转换相关蛋白表达水平比较(A 图为VSMCs 表型转换相关蛋白的Western blot 检测结果,分别检测了VSMCs 收缩型标志物calponin、α-SMA、SM22 和分泌型标志物OPN;B 图为以GAPDH 为参照的VSMCs各表型转换相关蛋白表达水平比较柱状图,n≥3)
3 讨论
AD 是一种严重急性血管病,病死率高,其病因和发病机制错综复杂,常见的AD 病因和诱因包括原发性高血压(高血压)[11]、遗传[12]、炎症反应[13]、衰老[14]、VSMCs 改变[4]等。近年来,流行病学研究发现使用氟喹诺酮类药物后2个月内主动脉瘤和AD 的发生率增加[5,15-16]。2019 年5 月3 日,美国食品药品监督管理局警示CPFX 慎用于主动脉瘤患者和高风险人群。虽然流行病学研究发现氟喹诺酮类药物增加AD 发病风险,但流行病学研究有一定的局限性,如研究中没有明确氟喹诺酮类药物的使用是唯一的危险因素,没有明确氟喹诺酮类药物种类、使用时间和使用剂量等,且对于氟喹诺酮类药物增加AD 发病风险的机制不明。因此,单纯通过流行病学研究不足以证实氟喹诺酮类药物有增加AD 发病风险的作用。CPFX 是临床常用的氟喹诺酮类药物,本研究通过组织贴壁法分离培养供体组织来源的VSMCs,并通过免疫荧光染色鉴定分离得到的细胞为VSMCs。通过CCK-8检测选择CPFX 干预条件为160 μg/mL 干预72 h。AngⅡ是研究AD 的常用药物,AngⅡ干预浓度根据文献选择100 nmol/L[17-18]。CCK-8 检测和Ki-67 免疫荧光染色发现CPFX 可抑制VSMCs 增殖,且CPFX+AngⅡ对VSMCs 增殖的抑制作用强于单用CPFX。在CPFX 增加小鼠AD 易感性的研究中同样发现CPFX 可抑制VSMCs 增殖,且有剂量依赖性,本研究结果与文献结果吻合,不同的是本研究所使用的CPFX 浓度与文献不同,且本研究还发现CPFX+AngⅡ对VSMCs 增殖的抑制作用强于单用CPFX[10]。
VSMCs 是主动脉中膜的主要细胞成分,在病理性刺激下,VSMCs 出现去分化改变,收缩型的VSMCs 转变为分泌型的VSMCs[19]。大量研究证实VSMCs 表型转换在AD 的发生、发展中起着重要的作用[4,20-21]。本研究通过Western blot 分别检测VSMCs 收缩型标志物α-SMA、SM22、calponin 表达水平和分泌型标志物OPN表达水平[22]。发现CPFX可引起VSMCs 收缩型标志物表达水平降低,分泌型标志物表达水平升高。本研究发现CPFX 可引起VSMCs 由收缩型向分泌型转换,且CPFX+AngⅡ引起VSMCs 表型转换的作用强于单用CPFX。本研究结果提示VSMCs 表型转换可能是CPFX 增加AD 发病风险的一种原因。
本研究虽明确了CPFX 可引起VSMCs 表型转换,且可能是CPFX增加AD发病风险的原因,但是,在AD的众多病因和诱因中,高血压是最主要的致病因素,在AD患者中,超过50%以上有高血压[23]。AD虽然是CPFX的严重药物不良反应,但发生率较低,并不是AD的主要致病因素,且在临床使用过程中,CPFX 的血药浓度远低于本研究中使用的浓度[24]。因此,虽然CPFX 可增加AD 发病风险,但并不影响CPFX的临床使用,只需注意CPFX慎用于动脉瘤和高风险人群。本研究也有一定的局限性,对于CPFX引起VSMCs表型转换的机制仍需进一步研究。
