肺癌新辅助免疫治疗1例
2021-07-08岳东升张真发赵晓亮王长利
岳东升 张真发 赵晓亮 王长利
作者单位:天津医科大学肿瘤医院肺部肿瘤科,天津市肺癌诊治中心,天津市“肿瘤防治”重点实验室,天津市恶性肿瘤临床医学研究中心(天津市300060)
患者男性,49 岁,主因“间断左胸背痛伴左上肢麻木肿胀2 个月”于2019年3月25日就诊于天津医科大学肿瘤医院。入院体格检查,双肺呼吸音清,心、腹未见明显异常。PET-CT 显示:左肺尖可见软组织肿物影,密度欠均,CT 值28~40 Hu,增强后呈不均匀强化,CT 值33~95 Hu,边缘毛糙,牵拉临近胸膜,PETCT 显像可见异常放射性浓聚,SUV 值15.2,大小约5.1 cm×4.1 cm×4.1 cm,周围可见多发斑片,条索及结节样影,考虑为周围性肺癌,临近胸膜受累,临床分期为T3N0M0,ⅡB 期(图1A、B)。实验室检查:血常规、肝肾功能正常,肿瘤标志物细胞角蛋白19 片段(Cyfra21-1)为6.42 μg/L(正常0~3.3 μg/L)。

图1 患者治疗前后病灶胸部CT 图像
患者于2019年4月4日行CT 引导下左肺上叶肿物穿刺,穿刺病理结果为低分化非小细胞肺癌(nonsmall cell lung cancer,NSCLC),结合免疫组织化学符合低分化鳞状细胞癌。免疫表型P40(+),CK5/6(−),CK7(+),TTF-1(−)。未见明显化疗禁忌证,行四周期新辅助化疗联合免疫治疗,具体用药方案为3 个周期方案:脂质体紫杉醇(270 mg,d1),卡铂(600 mg,d1),纳武利尤单抗(360 mg,d1)。患者化疗反应不明显,Ⅰ度消化道反应及骨髓抑制。
4 个周期治疗结束后肿瘤标志物Cyfra21-1 降为3.31 μg/L,于2019年6月28日复查胸部CT,提示左肺上叶肿物较前缩小(3.6 cm×2.5 cm),其内实性成分略增大,疗效评价部分缓解(partial response,PR)(图1C~F)。自第4 个周期新辅助治疗结束后患者逐渐出现咳嗽、胸闷、低热症状,胸部CT 提示双肺胸膜下多发实变浸润,考虑免疫性肺炎可能,分级为Ⅱ级(图2A),予以甲泼尼龙(160 mg/d)冲击3 天,而后逐渐减量至40 mg,共2 周,同时予头孢哌酮舒巴坦对症治疗,2 周后改为泼尼松(15 mg,po),患者症状明显好转,复查胸部CT 示左下肺斑片影较前吸收(图2B)。术前基线期评估患者评效仍为PR,尽管因为肺炎延期手术,但是并未见肿瘤进展,因此未影响治疗的总体进程。
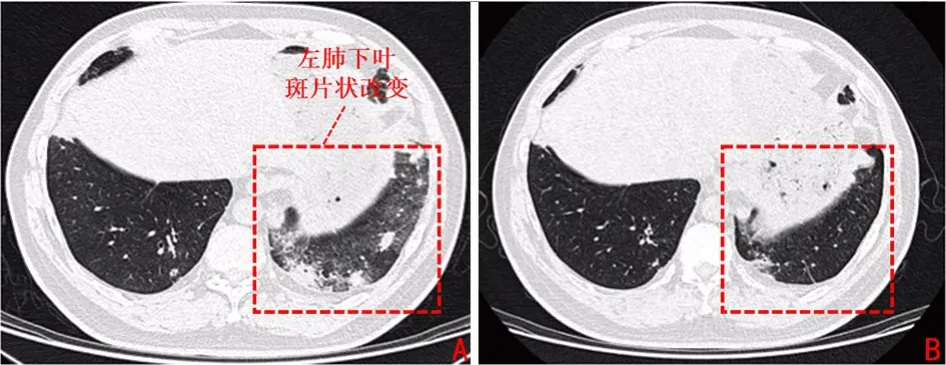
图2 患者免疫性肺炎治疗前后胸部CT 图像
患者经术前充分评估后于2019年10月17日行达芬奇机器人辅助下胸腔镜左上肺切除+区域淋巴结清扫术,术中未见明显胸膜受侵,术后病理提示左上肺低分化癌,结合免疫组织化学考虑大细胞癌伴鳞状细胞癌分化,并伴大量坏死,送检壁层胸膜(−),区域淋巴结未见癌转移,病理分期T2bN0M0,ⅡA 期,未达到病理学显著缓解(major pathologic response,MPR)。术后患者恢复良好,并行3 个周期术后辅助化疗,方案为(脂质体紫杉醇240 mg,d1,卡铂500 mg,d1)。目前,定期复查,状态良好,无复发及转移征象。
小结目前,对于局部进展期NSCLC,特别是ⅢA 期,新辅助化疗的临床地位一直存在争论[1]。但是随免疫治疗在晚期NSCLC 患者的无进展生存期(progression-free survival,PFS)和总生存期(overall survival,OS)方面的显著优势,亟需在早中期NSCLC新辅助治疗领域寻求突破[2-3]。
NSCLC 新辅助治疗的主要目的包括:降期(T 分期、N 分期)、提高R0 切除率、控制微转移、提高总体OS、降低全肺切除率、评估药物疗效。该患者临床分期为T3N0M0,由于患者同时伴发左上肢麻木肿胀,不能排除肿瘤压迫臂丛神经可能,术前穿刺病理明确,因此这类患者可以考虑行新辅助治疗。目前,传统的新辅助治疗主要采用化疗方案,但随着新的治疗手段的不断涌现,近年来也在积极探索尝试靶向治疗和免疫治疗。
新辅助免疫治疗的潜在机制为早期NSCLC 新辅助治疗杀伤肿瘤的同时,能够触发机体释放更多肿瘤抗原而激活T 细胞,同时活化的T 细胞通过血管和淋巴管到达微转移病灶,引发更大范围的抗肿瘤免疫反应。因此,对于早期NSCLC,免疫治疗作为系统性抗肿瘤治疗的“引物”,触发更大规模、更大程度的抗肿瘤效应。鉴于此,目前多项相关研究正在积极探索,治疗方案包括单药(CheckMate 159 研究,LCMC3 研究,ChiCTR-OIC-17 013 726 研究)、双免联合(NEOSTAR研究)和免疫联合化疗(NADIM 研究)。
关于单药研究,CheckMate 159 研究[1]首次打开了NSCLC 新辅助免疫治疗模式探索的大门。就主要研究终点可行性和安全性而言,所有患者接受纳武利尤单抗新辅助治疗后均未延迟手术或增加手术难度。1 例患者于术后安全性研究期间死亡,与研究药物无关(创伤性跌倒所致)。在9 例(43%)患者中观察到MPR。LCMC3 研究是一项评估阿替利珠单抗用于ⅠB~ⅢA 期或经筛选的ⅢB 期、可切除且未接受过治疗的NSCLC 患者新辅助治疗的Ⅱ期研究,在主要疗效评估的77 例患者中,MPR 率为19%(15/77),病理完全缓解率(pathologic complete response,pCR)为5%(4/77),49%(38/77)的患者病理学缓解率≥50%。信迪利单抗单药新辅助治疗的研究纳入可手术切除的ⅠA~ⅢB 期NSCLC 患者,评估37 例手术患者,15例(40.5%)达到MPR,6 例(16.2%)达到pCR[4-5]。
双免疫治疗联合在NSCLC 新辅助治疗领域也做出积极探索,NEOSTAR 研究是对比纳武利尤单抗单药与纳武利尤单抗联合伊匹木单抗双免疫新辅助治疗在可切除NSCLC 患者中的疗效的随机对照Ⅱ期研究,2019年美国肿瘤学会(ASCO)大会上报道主要研究终点MPR,显示总体MPR 为25%(单药组vs.联合组:17%vs.33%),其中18%(8 例)患者达到pCR(单药组vs.联合组:9%vs.29%)[4-5]。NEOSTAR 研究显示免疫单药与双免疫新辅助治疗的疗效差异不明显,手术的复杂性与治疗的反应关系有限,患者肺功能未受免疫新辅助治疗的影响,整体切除率与新辅助化疗作用均衡。另外,研究中5 例未能行手术切除的患者和1 例围手术期死亡患者提示,对于可行手术治疗的NSCLC 患者,进行免疫单药或联合新辅助治疗时还需谨慎选择获益人群。
免疫联合化疗是对传统新辅助化疗的一种优化治疗模式,NADIM 研究是一项单臂、开放标签、多中心Ⅱ期研究,纳入可切除的ⅢA(N2)期NSCLC 患者,接受化疗+纳武利尤单抗新辅助治疗,术后接受1年辅助治疗。主要研究终点为24 个月PFS。这是首个在ⅢA 期NSCLC 患者中探索免疫联合化疗疗效的多中心临床研究,继2018年世界肺癌大会(WCLC)、2019年ASCO 之后,2019年WCLC 再次更新临床缓解率和病理缓解率,其中ORR 高达73.9%,MPR 率高达83%,pCR 率达到59%。并且该方案的使用并未增加手术并发症及术后死亡率。这项研究的结果对目前新辅助免疫治疗的指导意义显著,该项研究的高临床缓解率,尤其是高MPR 率,优化了新辅助免疫治疗的选择。该研究另外一个重要提示为ⅢA 期尤其是N2患者是否才是新辅助免疫治疗的精准人群。但仅一项Ⅱ期研究的结果尚且不足,期待多中心、对照Ⅲ期临床研究进一步验证。
鉴于上述关于新辅助免疫治疗的研究探索,免疫联合化疗目前获得了较高的MPR。同时,正在开展的多项大样本的Ⅲ期临床研究中,都将可手术的Ⅱ~ⅢB 期患者作为入组人群,而不仅仅是NADIM研究中的ⅢA 期患者。参考开展的多项Ⅲ期新辅助免疫的临床研究,为该例患者选择了免疫联合化疗的治疗模式。
对于该患者的术后辅助治疗,选择了传统的术后辅助化疗。目前,正在开展的新辅助免疫治疗的临床研究在辅助治疗阶段均应用了免疫治疗,但考虑到该患者术前出现了严重的免疫相关性肺炎,为了避免术后再次发生免疫不良事件,因此未选择辅助免疫治疗。
该患者在术前新辅助免疫联合化疗治疗4 周期后出现咳嗽、胸闷、低热症状,结合胸CT 检查,提示双肺胸膜下多发实变浸润,考虑免疫性肺炎可能。免疫相关性肺炎是免疫治疗NSCLC 中较为常见的不良反应之一[6],中位发生时间在接受免疫治疗后3 个月,发生率约为4%,临床表现无特殊性,多为呼吸困难、咳嗽、胸痛,部分伴有发热,在治疗上,免疫相关性肺炎一般考虑激素冲击疗法,应用4~6 周,逐渐减量,如症状48 h 不缓解可加用英夫利昔单抗、环磷酰胺,或考虑丙种球蛋白。大部分免疫相关性肺炎患者预后良好。该患者在给予及时的激素冲击治疗后逐渐好转,并在延期手术的情况下完成手术切除。
新辅助免疫治疗后出现免疫相关不良事件对于手术的影响尚存争议,也是目前新辅助免疫治疗的热点,患者在能够获得治疗的基础上,尽可能减少或降低相关不良事件的发生。对于可行手术治疗的患者,术前新辅助免疫治疗不会降低手术切除率,而对于潜在可切除的患者,则希望提高手术切除率,同时并不提高手术难度。前期多项研究表明,单药免疫或免疫联合化疗的手术切除率均在90%左右,而且仅双免联合的切除率不足80%,因此考虑到安全性、切除率及手术延迟等方面的影响,免疫联合化疗为现在主要的治疗模式。
目前,免疫联合化疗新辅助Ⅲ期的临床试验仍未结束[7-8]。期待使用合理的免疫检查点抑制剂,筛选出精准的获益人群,优化治疗策略,同时能够最大限度地降低免疫相关不良事件的发生,并寻找确切的疗效评价指标和最佳的疗效预测分子,使新辅助免疫治疗不良反应降低,疗效最大化。
