配戴角膜塑形镜对泪液渗透压及炎症因子的影响
2021-07-08唐文婷李佳倩周里深李凡杰
唐文婷,李佳倩,周里深,李凡杰,喻 谦
0引言
角膜塑形镜是一种能有效控制青少年近视进展的非手术治疗手段[1],其安全性一直备受关注,尤其是角膜塑形镜相关的眼表损伤[2-3]。我们的前期研究证实,配戴角膜塑形镜不会影响泪液基础分泌,但会引起泪膜不稳定[4]。但其机制尚不明确,有研究认为可能与缺氧、机械损伤、高渗透压和炎症反应有关[2,5]。角膜塑形镜的机械损伤可能通过诱导泪液蒸发和电解质浓度变化使泪液渗透压(tear film osmolarity,TFO)增高,高渗会造成细胞脱水等形态学改变,同时激活一系列信号转导通路,诱发炎症反应和细胞凋亡,造成和加重干眼[6]。炎症因子激活后释放到泪液中,导致角膜上皮和基底神经丛损伤[7]。因此评估泪液炎症因子的水平对于了解眼表损害很重要。这其中白介素-1β(interleukin 1β,IL-1β)、白介素-6(interleukin 6,IL-6)和肿瘤坏死因子α(tumor necrosis factor α,TNFα)表达尤为重要[8-9]。本研究将配戴角膜塑形镜和框架眼镜的患者对比,研究角膜塑形镜对患者平均非侵入性泪膜破裂时间(average noninvasive Keratograph tear breakup time,NIKBUTav)、TFO、泪液中IL-1β、IL-6和TNFα的长期影响,以及这些变化在治疗停止后是否可逆。
1对象和方法
1.1对象采用前瞻性随机对照试验。选取2016-05/2019-02在我院眼科门诊收治的88例(均取右眼数据)青少年近视患者,年龄10~18(平均14.03±2.52)岁。入选标准:(1)近3mo内未配戴过角膜接触镜或进行过相关治疗;(2)无配戴角膜塑形镜的禁忌证;(3)人种为汉族,全身情况正常,无器质性眼疾及眼部手术外伤史;(4)双眼最佳矫正视力(LogMAR)≥0.04;(5)屈光度检查:球镜度-1.00~-5.00D,顺规散光≤-1.5D,逆规散光≤-0.75D;(6)BUT≥10s且10mm/5min≤Schirmer Ⅰ test≤30mm/5min;(7)依从性好,能完成按时治疗及随访。排除标准:(1)眼部或全身疾病不适宜配戴角膜塑形镜者;(2)既往曾患干燥综合征等系统性疾病或用药史(如激素、抗青光眼、阿托品类药物等);(3)近3mo内配戴过角膜接触镜;(4)卫生习惯不良,不能配合治疗及随访者;(5)相关药物过敏。向所有患者及家属讲解试验过程、可能出现的并发症及风险,并告知为两种治疗方案随机入组,强调角膜塑形镜组戴镜1a后需停戴角膜塑形镜4wk,签署知情同意书。本研究遵循《赫尔辛基宣言》,经成都医学院第一附属医院医学伦理委员会审批通过。
1.2方法
1.2.1样本量计算根据结局指标为连续变量的随机对照试验样本估算公式,假设把握度为80%(即设β=0.20),检验水准α=0.05。根据既往研究结果[6],预计角膜塑形镜组与框架眼镜组泪液渗透压相差在9mOsm/L以上有意义,标准差为15mOsm/L,两组试验人数相同,将参数用PASS11.0软件输入,得到n1=n2=35,考虑到20%的失访率,35/0.8=43.75,每组需44例,总样本量为88例,均纳入右眼进行研究。
1.2.2干预方法入选对象根据随机原则分为角膜塑形镜组和框架眼镜组。角膜塑形镜组配戴夜戴型角膜塑形镜,材料为Boston XO,试戴及复查均达到理想适配,每日夜间至少戴镜8h,使用统一的护理液清洗及浸泡镜片,在戴镜前用生理盐水冲洗掉残留的溶液,摘戴镜前使用玻璃酸钠滴眼液润滑。随访期间若有镜片破损或划痕较重则及时更换。框架眼镜组配戴高分子树脂框架眼镜,单焦点非球面镜片。向所有患者强调试验过程中不能自行使用眼药水,以及按时戴镜、复查的重要性,建立微信群按时提醒并及时解答问题,保证戴镜的安全性。
1.2.3观察指标随访观察戴镜后1、3、6mo,1a及停戴4wk的NIKBUTav、TFO、泪液IL-1β、IL-6和TNFα表达。检查时间统一为8∶00~10∶00am,且在摘镜后2h内进行。所有的检查在25℃恒温,30%湿度的试验室内,由同一名经过严格培训及考核的医师按相同顺序检查,检查时对其设盲。
1.2.3.1 NIKBUTav检查暗室环境下,使用Keratograph 5M眼表综合分析仪在患者第2次瞬目后(告知患者勿眨眼,坚持数秒),设备自动计算并记录。每眼连续测量3次取平均值。
1.2.3.2 TFO检查用TearLab Osmolarity系统测量,每眼连续测量3次取平均值。在每次测量之前都使用单剂量生理盐水校准。测量时嘱患者头向后外侧倾斜,眼睛向上注视,用测试芯片在下睑中外1/3结膜囊处收集50nL泪液,注意避免接触眼表。当测试笔指示灯熄灭即提示泪液收集成功,将测试笔迅速安置于系统机座上,仪器可直接显示TFO数值。
1.2.3.3泪液炎症因子水平检测嘱患者数次瞬目后,用50μL校准毛细玻璃管,同上采集泪液样本。每例患者在5min内收集15μL的泪液。本研究仅使用流速为2~10μL/min的样本,以避免刺激性泪液分泌所引起的稀释效应。立即转移至微量离心管后低温离心,取上清液于-80℃超低温冰箱保存备用。使用ELISA试剂盒检测泪液IL-1β、IL-6和TNFα的浓度。先用每个ELISA试剂盒附带的样品校准剂校准,再按照试剂盒说明完成检测。

2结果
2.1纳入研究患者一般情况比较试验过程中,角膜塑形镜组有5例(11%)、框架眼镜组有4例(9%)退出试验。退出原因为角膜塑形镜组1例度数增加,不再适配,1例学业重无法保证8h睡眠,2例不按时复查、失访,1例复查时无法获得IL-1β数据。框架眼镜组2例不按时复查、失访,2例度数增加,要求转戴角膜塑形镜。完成随访的角膜塑形镜组及框架眼镜组患者基本情况比较差异无统计学意义(P>0.05),具有可比性,见表1。
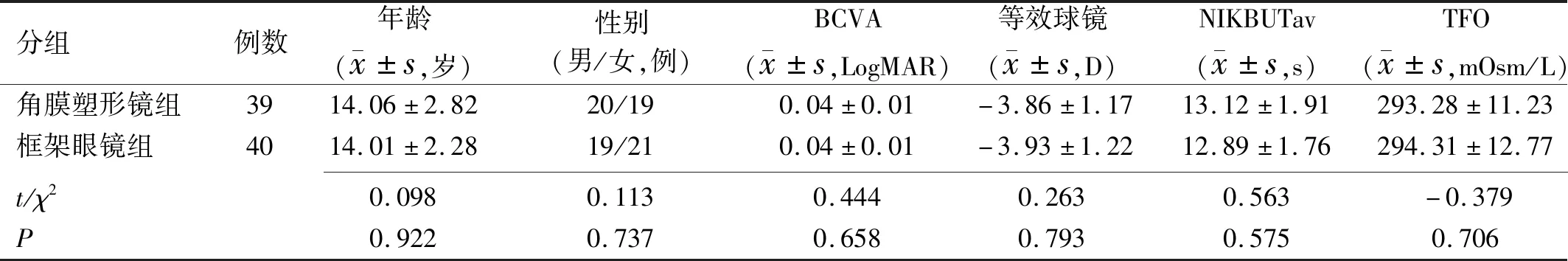
表1 纳入研究患者一般情况比较
2.2角膜塑形镜组戴镜前后各项指标比较角膜塑形镜组NIKBUTav及泪液TNFα戴镜后6mo,1a、停戴后4wk与戴镜前相比差异均有统计学意义(P<0.001)。TFO戴镜后1、3、6mo,戴镜1a与戴镜前相比差异均有统计学意义(P<0.001),且都在正常范围内(以316mOsm/L为标准[10])。泪液IL-1β及泪液IL-6戴镜3、6mo,1a与戴镜前相比差异均有统计学意义(P<0.001),见表2。

表2 角膜塑形镜组戴镜前后各项指标比较
2.3两组患者治疗1a后各项指标比较治疗1a后,角膜塑形镜组NIKBUTav低于框架眼镜组,差异有统计学意义(t=-9.368,P<0.001),角膜塑形镜组TFO、IL-6、TNFα高于框架眼镜组,差异均具有统计学意义(P<0.01);而两组患者泪液中IL-1β差异无统计学意义(t=1.967,P=0.053),见表3。

表3 两组患者治疗1a后各项指标比较
2.4角膜塑形镜组戴镜后并发症情况随访1a,角膜塑形镜组发生0级角膜上皮损伤1例(3%),3d内好转,Ⅰ级角膜上皮损伤2例(5%),Ⅱ级角膜上皮损伤1例(3%),未中止戴镜,予以玻璃酸钠滴眼(每日3~4次),1wk内角膜上皮痊愈。无Ⅲ、Ⅳ级角膜上皮损伤发生。角膜塑形镜组患者主诉眼干不适6例(15%)。
3讨论
角膜塑形镜引起的压迫效应使角膜结构发生显著变化和泪液再分布,机械损伤可引起泪液渗透压变化和炎症因子上调,从而激活一系列的炎症反应,引起细胞凋亡、杯状细胞减少以及黏蛋白的改变等,造成泪膜不稳定和眼表损伤,从而又加剧泪液渗透压的升高,形成恶性循环。因此,泪液渗透压及炎症因子表达与角膜塑形后的眼表损伤及干眼等关系密切,但目前鲜少有详细的研究。以往有关炎症因子在隐形眼镜配戴者及干眼患者泪液中的报道显示,TNFα、IL-1β、IL-6、IL-8、白三烯B4(LTB4)、基质金属蛋白酶-9(MMP-9)等发生了改变[11-12]。TNFα和IL-1β参与角膜表面损伤后的细胞外基质重塑,催化上皮基底膜成分的裂解,IL-6刺激角膜上皮迁移,还能诱导基质金属蛋白酶的表达,且这三者检测方法相对简便有效[8-9]。故本研究使用ELISA方法来检测TNFα、IL-1β、IL-6进行研究。
泪液渗透压受多种因素影响,如温度湿度、空气流速、反射性流泪等,在其测量中,恒定的试验环境和仪器校正很重要,仪器测量的重复性亦非常重要。传统的电导法和冰点降低法间接推算泪液渗透压,过程繁琐,干扰因素多,误差大[13]。TearLab Osmolarity系统采用一次性泪液取样测试芯片,在1s内采集40~50nL泪液,对眼表刺激极微,实时测量直接读数,整个过程耗时约2min。当采用316mOsm/L为诊断阈值时,该系统的敏感度为73%,特异度为90%,阳性率为85%[10]。在本试验中每次测量之前都进行校准,后对仪器的重复性进行测量,显示重复测量偏差值在1mOsm/L左右。
本研究结果表明,配戴角膜塑形镜后NIKBUTav在6mo,1a时降低最为明显,停戴4wk后部分恢复,这与杨立等[14]、刘爽等[15]、Na等[16]的结果一致,但后三者均未研究停戴角膜塑形镜后NIKBUTav的变化趋势。Wang等[17]认为戴镜后各时间点与戴镜前相比BUT无差异,原因可能为两者检查方法不同(Keratograph 5M眼表综合分析仪vs传统检查方法),也可能为使用的角膜塑形镜类型不同。
目前角膜塑形镜对TFO及炎症因子表达影响的研究较少。本研究发现TFO于戴镜后1mo升高最为明显,其后保持稳定,但均在正常范围内,戴镜1a停戴4wk后TFO降低至戴镜前水平,说明其具有可逆性,这与Nieto-Bona等[18]的结果基本一致,但后者的研究时间点仅为戴镜后1、12mo。石迎辉等[19]认为在戴镜后3、6mo TFO持续升高,但后者试验对象配戴的是半硬性角膜接触镜,也并未写明试验室条件及是否使用统一的清洗液,两试验观察时间点不同(1、3、6mo,1avs3、6mo),TFO检测方法也不同(TearLab Osmolarity系统vsVAPRO 5520露点渗透压仪),且本试验TFO采用连续测量3次取平均值进行分析。
配戴角膜塑形镜后3mo泪液IL-1β升高最为明显,其后保持稳定,戴镜1a停戴4wk后泪液IL-1β恢复至戴镜前水平。Na等[16]认为IL-1β戴镜后各时间点与戴镜前相比无差异,但后者试验对象配戴的是硬性透气性角膜接触镜(rigid gas permeable contact lens, RGPCL),两试验IL-1β检测方法也有所差异(泪液标本ELISA试剂盒检测vs结膜脱落细胞行免疫标记荧光染色)。
配戴角膜塑形镜3mo后泪液IL-6持续升高,1a停戴4wk后恢复至戴镜前水平。这与Yang等[20]、González-Pérez等[21]的结果一致,但后两者均未观察停戴角膜塑形镜后IL-6的变化,González-Pérez等[21]只研究了1a时间点的对比,并未研究详细变化趋势。本研究与Na等[16]认为IL-6戴镜后各时间点与戴镜前相比无差异不同,但后者试验对象配戴RGPCL,两试验IL-6检测方法不同(泪液标本ELISA试剂盒检测vs结膜脱落细胞行免疫标记荧光染色)。
配戴角膜塑形镜6mo后泪液TNFα持续升高,1a停戴4wk后部分恢复。目前未检索到有关配戴角膜塑形镜对泪液TNFα的影响研究。
本研究发现角膜塑形镜组治疗1a后的NIKBUTav明显低于框架眼镜组,这与杨立等[14]、Gu等[22]的结果一致。TFO、泪液中IL-6和TNFα值明显高于框架眼镜组,而泪液中IL-1β角膜塑形镜组虽然高于框架眼镜组,但差异无统计学意义。TFO的结果与Nieto-Bona等[18]的结果一致,后者为54例研究对象的回顾性分析。泪液IL-6表达结果与González-Pérez等[23]的研究一致。泪液IL-1β和TNFα表达未检索到角膜塑形镜与框架眼镜的对比研究。
泪液高渗透性主要与泪液水样层和脂质层功能障碍有关,而泪膜不稳定还包括黏蛋白层功能障碍,本试验未做单独研究。本试验的另一个局限性是样本量尚不足够,未根据屈光度、年龄详细分组,也未对比不同材料及类型的角膜接触镜,在后续的研究中应进一步完善。
综上,配戴角膜塑形镜后NIKBUTav、TFO、IL-1β、IL-6及TNFα均有不同程度变化,停戴后具有可逆性,这些客观检查指标在角膜塑形镜的安全性评估、眼表损伤的机制及严重程度分级、临床随访追踪方面有重要作用,值得进一步研究。
