金微电极微分脉冲伏安法测定甲基汞
2021-07-08倪晓溪黄仲佳贾伟健
倪晓溪,黄仲佳,陈 星,贾伟健
1)安徽工程大学机械与汽车工程学院,安徽芜湖241004;2)合肥工业大学工业与装备技术研究院, 安徽合肥230009;3)皖西学院机械与车辆工程学院,安徽六安237014
汞广泛存在于水环境中,主要形式有元素汞、无机汞和有机汞,是全球性环境污染物之一[1].有机汞毒性最强,具有生物累积和放大效应的甲基汞(CH3Hg+)毒性最为致命[2].日常生活中,人们主要通过食用被污染的海产品接触CH3Hg+,接触后CH3Hg+迅速渗透入到皮肤内,直接攻击人体中枢神经系统和肾脏.为避免环境CH3Hg+对人体的伤害,对CH3Hg+的定量检测极其重要[3].
目前,检测CH3Hg+的方法主要有原子光谱法[4]、电感耦合等离子质谱法[5-6]、气相色谱法[7]和电化学传感器法[8-9]等.在分析微量目标物方面,光谱法、质谱法和色谱法具有较高的灵敏度,也可对目标物的形态进行合理分析,但是由于这些非电化学法存在目标物预处理复杂、分析周期长、操作程序复杂、仪器设备昂贵和运行维修成本高等局限,难以满足对污染物形态进行现场检测的迫切需求[6].电化学检测法凭借其操作简单、快速、可靠,以及无需对目标物进行繁琐预处理操作等优势,有望实现对 CH3Hg+形态的现场快速分析[10-13].
与传统固体电极相比,微电极具有较小电极面积、目标物取样少、检测限低、响应速率快、双层电容以及充电电流小等独特电化学特性,在痕量分析中受到广泛关注[14].DU等[15]合成制备石墨烯微电极用于动物神经活动分析研究.GIBBON-WALSH等[16]以金丝微电极对海水以及未污染的地下水中砷的痕量进行检测,构建的负载锰金丝微电极可有效用于As5+超痕量检测.RIBEIRO等[17]探究CH3Hg+在碳纤维电极上的电化学行为,运用循环伏安及快速线性扫描技术探究氯酸环境下的CH3Hg+,该检测技术可达到微摩尔级别.
目前,有关电化学检测CH3Hg+的报道主要采用纳米材料改性传统电极展开,而金微电极直接痕量检测CH3Hg+的却鲜有报道.CHEN等[9]合成AuNPs/mpg-C3N4纳米复合电化学传感器用于甲基汞定量分析,获得较低检测限0.103 μg/L. ABOLLINO等[18]运用高导电性金纳米粒子修饰玻碳电极测定甲基汞.
以上检测CH3Hg+的方法,在实际水样检测中要达到相应的检测效果,主要通过负载(纳米)材料改性电极实现.但由于改性材料合成步骤复杂,检测时稳定性不够,实际检测中易出现电极表面材料脱落现象,导致检测限和检测灵敏度不佳.基于以上问题,本研究提出采用预处理活化后的金微电极直接微分脉冲伏安法测定水环境中的CH3Hg+,借助金与汞的特殊亲和作用[19],避免了修饰材料的不可控因素,更易实现对CH3Hg+的高稳定性、高选择性、低检测限的超痕量检测(检测浓度≤0.10 μg/L).
1 实 验
1.1 仪器和试剂
所有伏安检测均在电化学工作站(购自上海辰华公司,型号为CHI660D)上进行;实验所需器材: P-2A型金相试样抛光机、金微电极(直径25 μm,纯度99.99%,硬)、玻碳电极(直径3 mm)、铂丝对电极、Ag/AgCl参比电极的三电极系统和智能恒温控制搅拌器.所有测量均在室温下的10 mL电解质溶液中进行. 实验所需药品:不同粒径的氧化铝粉末、0.5 mol/L H2SO4溶液、0.1 mol/L 不同pH值(3.0~6.0)的醋酸缓冲液(由0.1 mol/L CH3COOH以及0.1 mol/L的 CH3COONa 按体积比例配置),均购自上海化学试剂公司. CH3Hg+标准储备溶液:由氯化甲基汞(methylmercury chloride, 购自中国阿拉丁公司)溶于超纯水中制备 CH3Hg+原液.实验所用药品均为分析纯,所制溶液均为超纯水配制.
1.2 电极预处理
分别采用粒径为1.00、0.30和0.05 μm氧化铝粉末依次将工作电极抛光至镜面,使电极表面平滑,再浸入乙醇水溶液(体积分数为50%)和去离子水中超声数分钟,去除电极表面附着的杂质.随后置于室温下风干备用.玻碳电极和金微电极测定 CH3Hg+之前均需活化处理,即将工作电极置于酸性溶液中,用循环伏安法扫描直至获得稳定的伏安曲线,以增加电极表面活点密度以及促进电子转移速率,从而增强电催化性能.具体操作如下:将三电极系统置于0.5 mol/L的H2SO4溶液中,-0.2 ~1.6 V 循环扫描 15圈,扫描速度设定为 100 mV/s,直到获得稳定的循环伏安曲线.随后将金微电极、玻碳电极用超纯水冲洗干净,在氮气氛下烘干备用.
1.3 电化学实验
采用微分脉冲伏安技术(differential pulse voltammetry, DPV)对CH3Hg+进行电化学分析.将标准三电极系统浸入含有CH3Hg+的电解质溶液中,以预处理活化的两根电极为工作电极.脉冲伏安法检测依据重金属阳离子的氧化还原反应,主要分为目标离子沉积、电化学检测和解吸3个阶段.具体操作为:① 给工作电极施加一个负电位,促使分散在电解液中的 CH3Hg+通过还原反应沉积在工作电极表面,为保证沉积的有效性,沉积阶段电解液一直处于搅拌状态,转速为500 r/min,沉积一段时间后,搅拌终止;② 静息平衡 15 s后记录下伏安图;③ 施加一个解吸电位使得第1阶段沉积的物质再次得到电子,氧化成最初的阳离子,即由氧化还原反应引起的电子定向移动,电化学工作站记录下峰值电流.最终得出响应曲线.
为便于分析金微电极对CH3Hg+的电分析性能,采用DPV研究不同电极在质量传输以及电子转移方面的差异,以及在相同浓度下,金微电极和玻碳电极对CH3Hg+的溶出伏安响应情况,优化实验条件后,选用金微电极作为DPV检测CH3Hg+的工作电极,并得出最佳检测灵敏度以及最低检测限.
2 结果与讨论
2.1 预处理金微电极的电化学行为
图1分别是预处理金微电极和玻碳电极在0.5 mol/L H2SO4溶液中的循环伏安曲线 (初始电位为-0.20 V).由图1(a)可知,金微电极于 0.90 V产生较大的特征还原峰,于 1.20 V产生氧化峰.响应峰分别对应于金微电极表面金属氧化物的还原以及金属氧化物的形成.由图1(b)可知,玻碳电极的 CV曲线是一对可逆的氧化还原反应,但峰形效果不好,相同条件下金微电极的 CV曲线更为尖锐.氧化还原曲线具有更高的峰值电流,这主要是因为金微电极具有优异的导电能力.

图1 不同电极在0.5 mol/L H2SO4溶液中的 循环伏安曲线Fig.1 Cyclic voltammetric curves of different electrodes in 0.5 mol/L H2SO4 solution
2.2 玻碳电极、金微电极对CH3Hg+的伏安分析
CH3Hg+的伏安测定通常是基于CH3Hg+自由基发生的可逆波,而可逆波的大小和形状及重现性会受到工作电极表面修饰的显著影响.在预沉积阶段,CH3Hg+在工作电极表面富集,短时间静息平衡后,再清洗电极除去工作电极表面的沉积物.CH3Hg+在工作电极表面的反应原理为
(1)
相同实验条件下,玻碳电极和金微电极对CH3Hg+的灵敏性检测如图2.由图2(a)可见,金微电极对不同质量浓度(0.1, 0.2, 0.3, 0.4, 0.5, 0.6, 0.7, 0.8 μg/L) CH3Hg+的DPV响应,并在每个浓度下均出现明确的响应峰.CH3Hg+在金微电极上于0.68 V位置处出现响应峰,并且随着CH3Hg+质量浓度的增大而增高,溶出峰电流逐渐正移,与CH3Hg+质量浓度呈较好的线性关系.其线性回归方程为I=0.283ρ-0.023, 在CH3Hg+质量浓度仅为0.1 μg/L的水环境下能出现响应峰.由此可知,金微电极可以于实现CH3Hg+的超痕量检测.
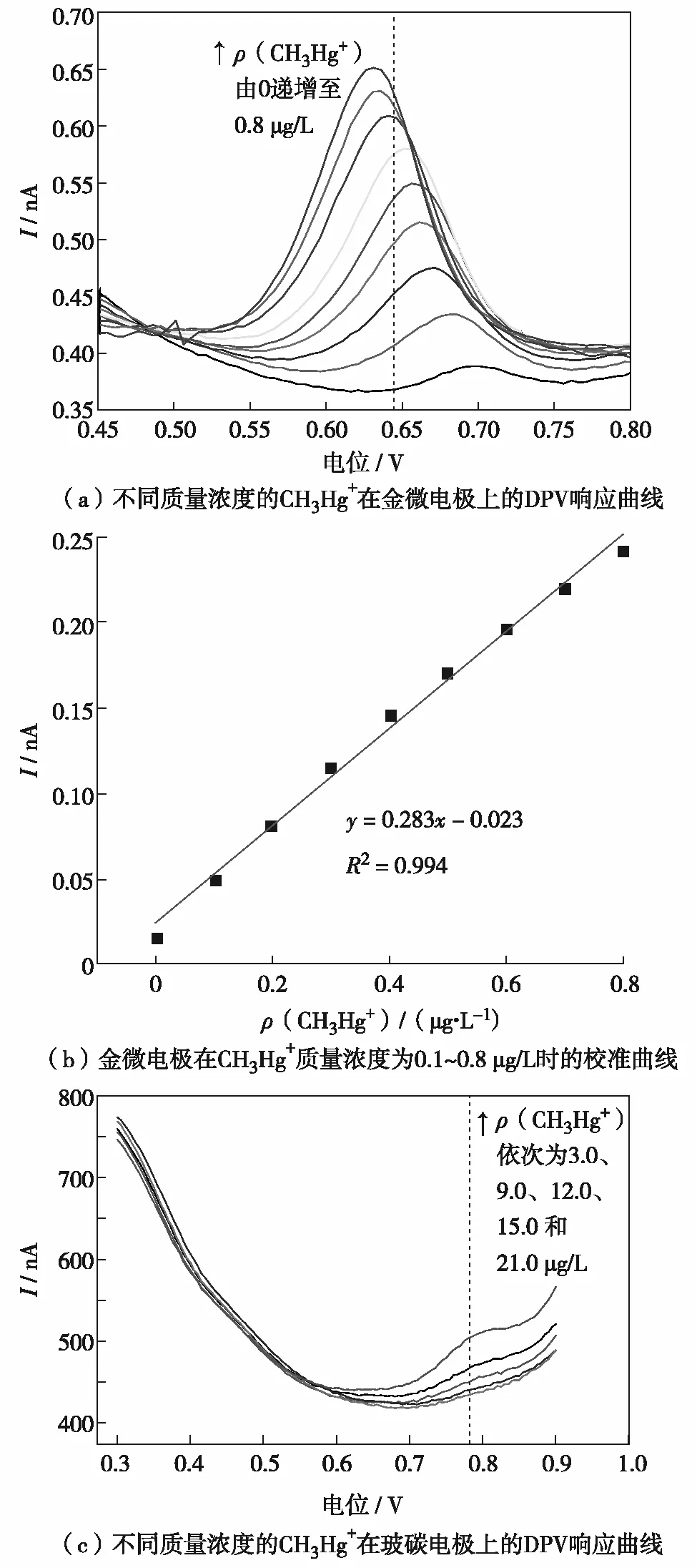
图2 不同电极上CH3Hg+的微分脉冲伏安响应Fig.2 Different pulse voltammetric response curves of CH3Hg+ on different electrodes
2.3 实验条件的优化
缓冲液的 pH值、沉积电位以及沉积时间会直接影响CH3Hg+在金微电极表面的沉积过程,进而影响CH3Hg+检测的灵敏度. 通过考察以上参数对0.50 μg/L CH3Hg+溶出峰电流的影响,最终获得最佳实验参数,如表1.
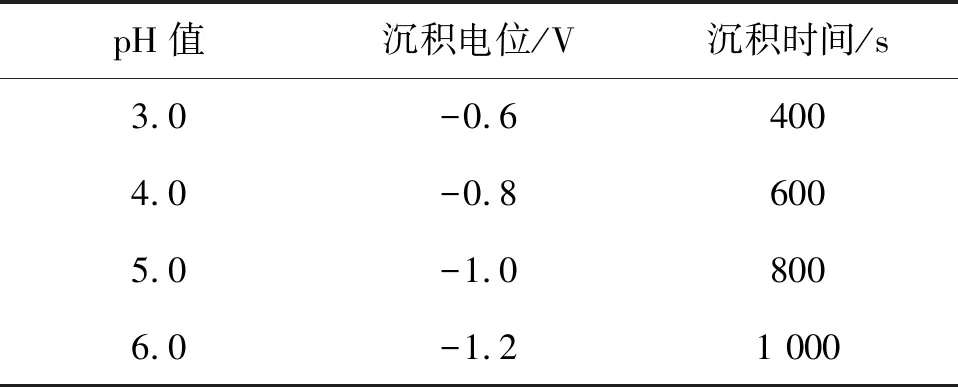
表1 CH3Hg+检测条件优化Table 1 Optimization of CH3Hg+ detection conditions
反应条件的优化实验步骤为:① 在沉积电位为-1.0 V、沉积时间为500 s、不同pH值(3.0、4.0、5.0和6.0)条件下,研究金微电极对CH3Hg+的响应情况.实验得出,在pH=5.0时,所对应的CH3Hg+溶出峰电流最高为0.306 nA,故选用该pH值进行后续实验.② 在缓冲液pH=5.0、沉积时间为500 s条件下,探究在沉积电位为-1.2~-0.6 V内金微电极对CH3Hg+的变化.结果发现,当沉积电位为-0.8 V时,CH3Hg+溶出峰电流最高为0.321 nA,因此,将-0.8 V作为最佳沉积电位继续后续实验.③ 在pH=5.0、沉积电位为-0.8 V时,探究沉积时间为400~1 200 s(400、600、800、1 000和1 200 s)内金微电极对CH3Hg+的相应情况.结果发现,适当延长沉积时间有利于CH3Hg+的有效沉积检测,在沉积时间为800 s时,CH3Hg+溶出峰电流值达到最高值约为0.472 nA.综上,最终选择以pH值为5.0 、沉积电位为-0.8 V、沉积时间为 800 s 为最佳实验条件.
2.4 CH3Hg+在金微电极上的溶出伏安响应
相对其他伏安技术,DPV检测有较高的灵敏度以及较好的分辨率.在优化后的试验参数下:pH值为 5.0 的 0.1 mol/L 醋酸缓冲液,在-1.0 V沉积电位下富集 800 s,不同质量浓度的 CH3Hg+在金微电极中的 DPV 氧化峰电流响应曲线和金微电极对不同质量浓度CH3Hg+的校准曲线,结果如图3.由图3(a)不难发现,在金微电极上CH3Hg+于 0.56 V处有一个显著的响应峰,并且随着 CH3Hg+质量浓度的增大而增高.由图3(b)可见,CH3Hg+的溶出峰电流与其浓度在 0.05~0.50 μg/L内有很好的线性关系,其线性回归方程为I=0.354ρ-0.008, 通过线性方程斜率计算得出灵敏度为 0.354 nA/(μg·L),相关系数为 0.998.按照 3倍信噪比算法,得出检测限为 0.012 μg/L,远低于世界卫生组织给出的关于饮用水中CH3Hg+质量浓度的指导值(1.0 μg/L).表2为不同电极对CH3Hg+检测灵敏度的比较,由表2可见,用于检测CH3Hg+的传感器相比以往检测方法[8-9, 20-22]更为敏感简捷,表明金微电极分析检测具有更广泛的应用前景.
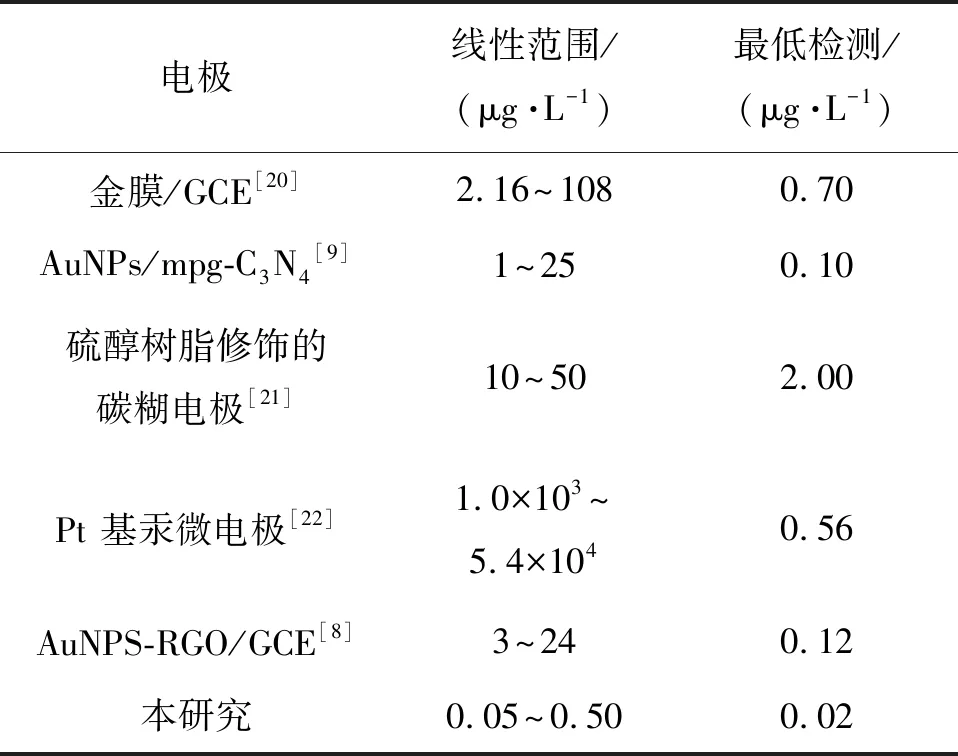
表2 不同电极对CH3Hg+ 灵敏度Table 2 The sensitivity of different electrodes to CH3Hg+
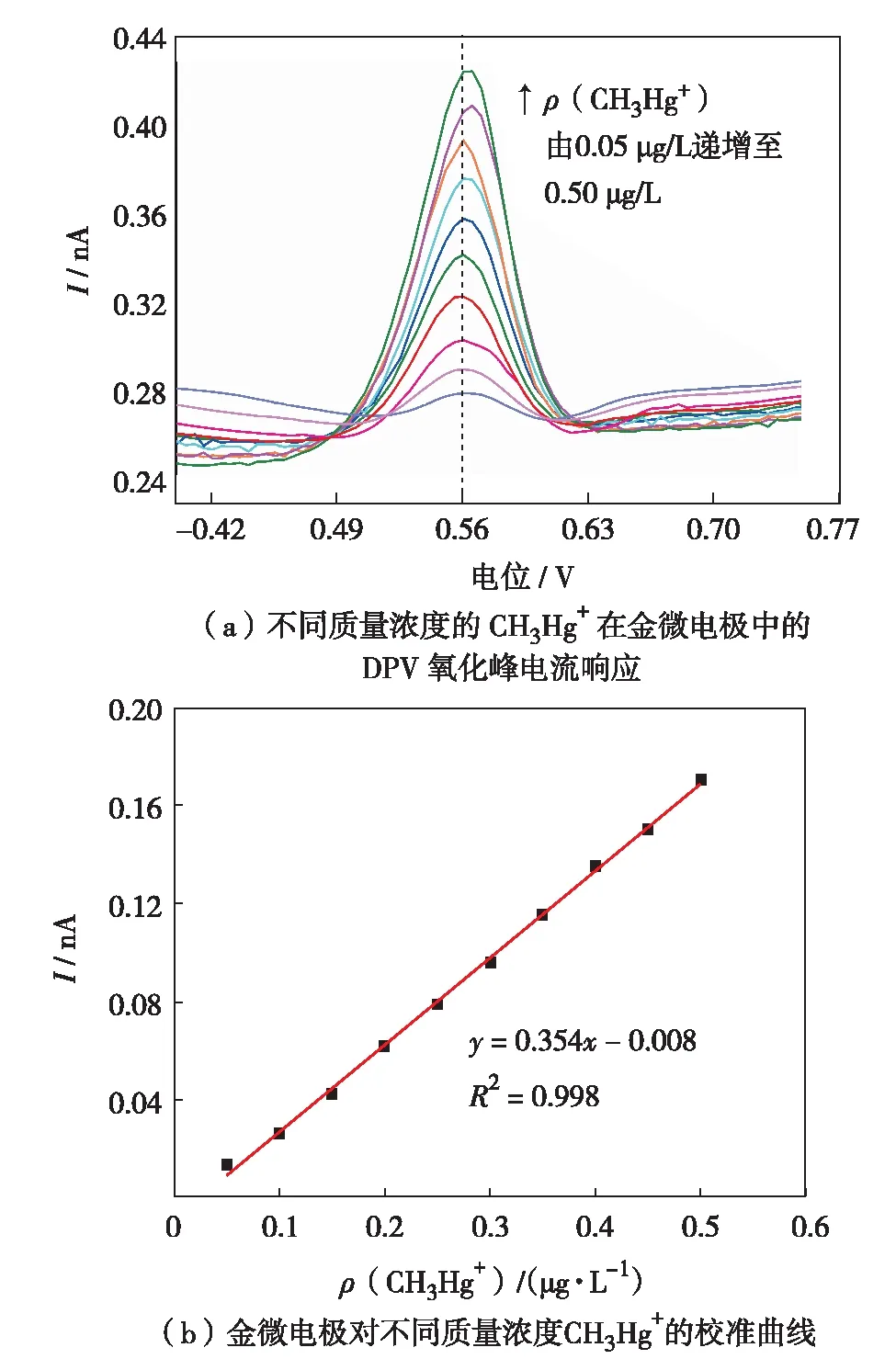
图3 CH3Hg+在金微电极上的溶出伏安响应Fig.3 The stripping voltammetric response of methylmercury on a gold microelectrode
2.5 干扰性研究
考虑到实际检测的水环境要比缓冲溶液成分更复杂,重金属离子相互干扰现象可能会对检测结果造成影响.为此,本实验研究了其他重金属离子对CH3Hg+检测的干扰行为,分别加入质量浓度均为 40 μg/L 的两种重金属离子(Cu2+和Hg2+),测量CH3Hg+质量浓度为1.0~8.0 μg/L时的响应电流变
化.不同质量浓度下CH3Hg+在醋酸缓冲液中的DPV响应如图4(a).由图4(a)可见,CH3Hg+、Cu2+和Hg2+的出峰位置相距较远, Cu2+和Hg2+的存在并不会对CH3Hg+的检测产生明显的影响. CH3Hg+的溶出峰位置在0.60 V左右,随着CH3Hg+质量浓度的增加,与溶出峰电流呈良好的线性关系,所构建传感器对 CH3Hg+仍保持显著的电化学信号增量,说明该传感器选择性和抗干扰性良好.
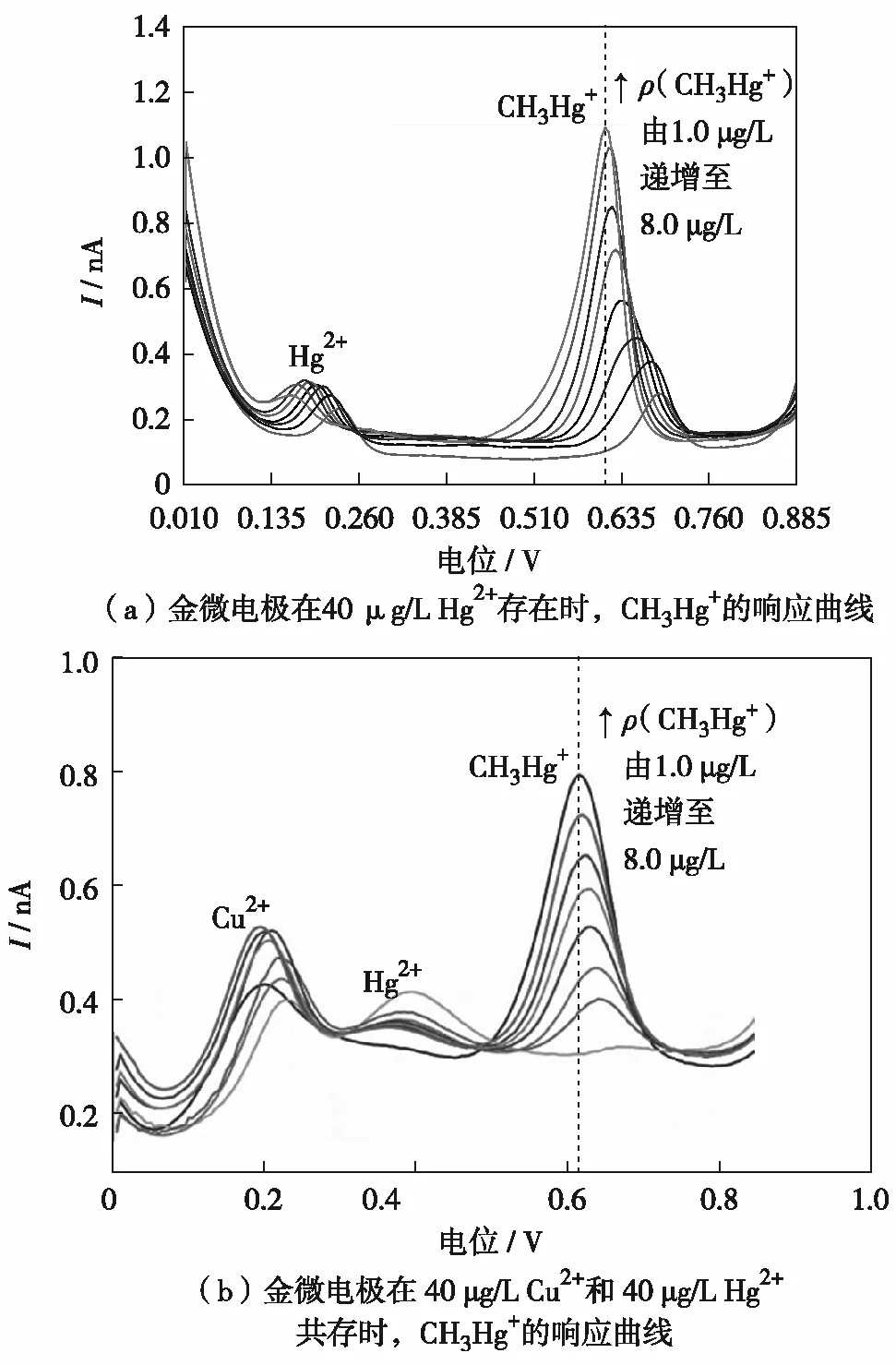
图4 金微电极在40 μg/L Cu2+和40 μg/L Hg2+共存,以及仅Hg2+存在时 CH3Hg+的电化学响应曲线Fig.4 The electrochemical response curve of gold microelectrode for CH3Hg+ in the presence of 40 μg/L Cu2+ and 40 μg/L Hg2+, and when only 40 μg/L Hg2+ exists
CH3Hg+检测的最大干扰离子为无机汞Hg2+, ABOLLINO等[18]采用金纳米粒子改性玻碳电极(AuNPS-GCE)研究Hg2+存在的环境下CH3Hg+的伏安行为,实际检测发现,构筑的电化学传感器未能实现对CH3Hg+的选择性分析,二者溶出峰存在重叠现象,添加 SnCl2络合缓冲液中的Hg2+,最终实现了对CH3Hg+的选择性检测. KOROLCZUK等[20]开发出一种全氟磺酸-聚四氟乙烯(nafion)修饰金膜电极研究Hg2+存在下CH3Hg+的灵敏分析,通过引入二乙烯三胺五乙酸与汞离子形成络合物从而减少对CH3Hg+检测的影响.本研究构筑的金微电极可直接实现对仅Hg2+存在下的CH3Hg+选择性分析.如图4(b),随着CH3Hg+的持续加入(ρ(CH3Hg+)为1.0~8.0 μg/L),金微电极上的CH3Hg+沉积量增多,溶出电流逐渐增大,峰值电流高于无 Hg2+情况下的电流值,呈现较好的线性关系,而Hg2+的溶出峰几乎无明显变化.这是因为金微电极独特的灵敏性以及金具有的超高导电性,致使其能很敏感地检测到CH3Hg+与无机汞离子的氧化性差异,在一定的酸性条件下,能将二者很好的区分出来.研究结果进一步说明用金微电极可以实现 CH3Hg+在与单一离子 Hg2+共存情况下的无干扰检测.
2.6 电极的重现性测试
在电化学分析中,传感器的循环重复性能在实际检测分析中至关重要,将金微电极置于室温下15 d后,对质量浓度为 5.0 μg/L的CH3Hg+溶液进行5次连续的平行测定,5次监测数据均显示CH3Hg+溶出峰电流无明显变化,其检测结果的相对偏差为4.23%,重现性良好.同时,为测定该传感器的稳定性,将金微电极保存在 0.1 mol/L ABS 缓冲液中,并置于4 ℃下 15 d后,然后每隔3 d进行DPV测试, 结果表明,该电极仍然保留 94.3%的初始响应值.因此,该金微电极传感器具有良好的稳定性,可长期使用.
2.7 实际样品分析
为评估该CH3Hg+检测方法的适用性和准确性,对取自合肥工业大学斛兵塘的水样以及自来水样进行检测.样品经过简单的过滤处理后,用0.1 mol/L 醋酸缓冲液(pH=5.0)以1∶9(体积比)进行稀释,利用传统的玻碳电极对水样进行检测时,未检测出CH3Hg+. 而用本研究中的金微电极对水样进行检测时发现,当CH3Hg+初始质量浓度为0.015 μg/L时,峰值电流为0.02 nA;当CH3Hg+添加质量浓度为0.20 μg/L时,峰值电流为0.34 nA.向水样中滴加 CH3Hg+并进行回收率实验,回收率如表3,这表明该方法可以适用于实际水样品的超痕量检测.
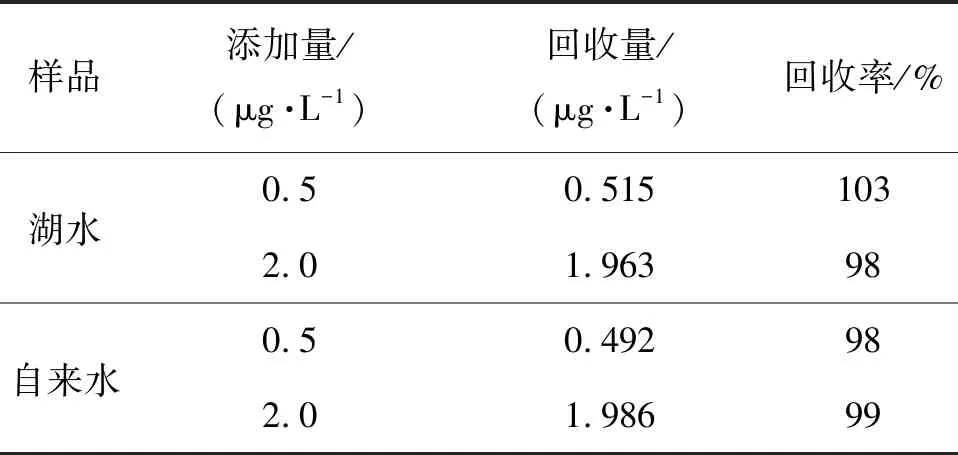
表3 不同水样中CH3Hg+离子检测Table 3 CH3Hg+ ion detection in different water samples
结 语
通过对比玻碳电极和金微电极在不加任何修饰剂的情况下对CH3Hg+的伏安响应分析,发现金微电极更为灵敏,最低检测质量浓度低至 0.10 μg/L.由于金微电极优异的导电性以及微型传感器的灵敏性,实现了对目标物CH3Hg+的超痕量检测,峰值电流与CH3Hg+质量浓度(0.05~0.50 μg/L)呈较好的线性关系,检测限为0.012 μg/L.金微电极具有良好的稳定性、重现性和抗干扰性.该检测机制具有组合方法简单、响应速度快、检测限低和取样少等优点,更加适用于水环境中重金属离子的痕量检测.研究数据表明,金微电极联合微分脉冲伏安技术是检测水环境中CH3Hg+的有效工具.
