双基因突变型X连锁Alport综合征女性患者临床与遗传学特征分析
2021-07-07胡宁宁戴选彤蒋更如林芙君
胡宁宁 戴选彤 蒋更如 林芙君 宁 燕
Alport综合征(Alport syndrome,AS)是一种临床上较为常见的遗传性肾小球疾病,以肾性血尿、进行性肾功能减退为主要临床表现,部分患者合并感音神经性耳聋(sensorineural hearing loss, SNHL)和眼部异常[1]。AS的病因为编码Ⅳ型胶原α3、α4、α5链的基因COL4A3、COL4A4、COL4A5发生突变导致肾小球基底膜(glomerular basement membrane,GBM)出现弥漫变薄、厚薄不均、致密层撕裂、分层或虫蚀样等改变,部分患者以局灶节段性肾小球硬化(focal segmental glomerulosclerosis, FSGS)为特征性病理学改变。以往认为,AS为罕见病(患病率约1/5 000~1/10 000),分为COL4A5基因突变所导致的X连锁显性遗传型AS(XLAS,约占80%~85%),以及COL4A3基因、COL4A4基因突变导致的常染色体隐性遗传型AS(ARAS,约占10%~15%)或常染色体显性遗传型AS(ADAS,约占5%)。随着二代测序(next generation sequencing, NGS)技术在临床应用的普及,COL4A3、COL4A4、COL4A5基因突变检出率显著增高,尤以COL4A3、COL4A4、COL4A5基因杂合突变为主。需关注的是,部分COL4A3、COL4A4、COL4A5基因杂合突变型患者并非均预后良好,约15%的患者在中老年期进展至终末期肾病(end stage renal disease, ESRD)。因此,越来越多的学者呼吁基于AS的发病机制,将所有携带COL4A3、COL4A4、COL4A5基因致病突变的患者统一诊断为AS[2-5],以强调对所有患者进行早期诊断,启动早期的肾脏保护治疗。按照该定义,AS患者在成人CKD和儿童CKD患者中分别约占3%[6]和1%~2%[7],是CKD的重要病因之一。
XLAS女性患者多数携带COL4A5基因杂合突变,此类患者存在较为显著的临床异质性,且无明显的基因型-临床表型关联[8]。仅约1/3的XLAS女性患者在病程中始终为孤立性肾性血尿,72.6%合并不同程度蛋白尿,15.5%在65岁前进展至ESRD,少部分患者甚至在40岁前即进展至ESRD[8]。XLAS女性患者GBM病变的差异较大,部分可表现为正常或有局灶或弥漫性变薄,常缺乏AS的GBM特征性病理学改变[9]。目前已知可导致XLAS女性患者临床表现差异的机制有:X染色体随机失活[10],携带COL4A3、COL4A4、COL4A5双基因或三基因突变,同时携带非COL4A类(如MYO1E、MYH9、LAMA5等)基因突变[11-13]或修饰基因NPHS2多态性位点(p.R229Q)[14]、合并IgA肾病等原发性肾小球疾病,以及环境因素等。
自2015年Mencarelli等[15]首次报道11例COL4A3、COL4A4、COL4A5双基因突变型AS患者以来,国内外相继有文献对此类较为特殊的AS患者进行报道。截至目前,共报道34例COL4A3、COL4A4、COL4A5双基因或三基因突变型AS患者[8, 15-23],其中XLAS女性患者仅10例,在所有XLAS女性患者中约占0.3%~1.0%[8,19]。本研究旨在通过回顾性分析3例经上海交通大学医学院附属新华医院单中心诊治的COL4A3、COL4A4、COL4A5双基因突变型XLAS女性患者,同时汇总分析既往已报道的10例COL4A3、COL4A4、COL4A5双基因或三基因突变型XLAS女性患者[8, 15-19]的临床表现、病理学表型和基因突变特点,进一步加深临床医师对该特殊类型XLAS女性患者疾病的认识。
1 对象与方法
1.1 研究对象 回顾性分析2019年1月—2020年12月于上海交通大学医学院附属新华医院就诊并经基因检测明确诊断的3例COL4A3、COL4A4、COL4A5双基因突变型XLAS女性患者及其家系内患病成员的临床资料、肾脏病理和基因检测结果。本研究对样本和病史的采集遵守联合国教育科学和文化组织制订的《人类基因组宣言》,并获医院伦理委员会批准(编号:XHEC-D-2020-005),患者及其家属均签署知情同意书。
用“Alport syndrome”“X-linked”“COL4A5” “COL4A3”“COL4A4”“female”“digenic”“thin basement membrane nephropathy”“focal segmental glomerulosclerosis”等关键词, 在PubMed、Embase、The Cochrane Library数据库中检索既往文献报道的COL4A3、COL4A4、COL4A5双基因或三基因突变型XLAS女性患者。
1.2 临床资料整理与分析 整理3例COL4A3、COL4A4、COL4A5双基因突变型XLAS女性患者的历次住院病史资料和门诊随访资料,包括性别、发病年龄、临床症状、肾脏疾病家族史、血尿和尿蛋白水平、肾功能指标、CKD和ESRD的进展速度、治疗情况,以及出现高频SNHL和眼部病变(前圆锥形晶状体、黄斑周围点状和斑点状视网膜病变等)的肾外表现情况。既往曾行肾脏穿刺活组织病理学检查(简称活检)的患者,对其病理资料进行重新阅片,阅片内容包括光学显微镜(简称光镜)、免疫荧光显微镜、电子显微镜(简称电镜)下拍摄的肾组织和皮肤基底膜形态及其Ⅳ型胶原α3、α5免疫荧光染色情况。详细询问患者的其他家系成员病史,并对可获取样本的家系成员进行尿常规和肾功能检查。采集先证者及其家系成员外周血样本保存于含乙二胺四乙酸(EDTA)的试管中。
对搜索文献并整理的10例COL4A3、COL4A4、COL4A5双基因或三基因突变型XLAS女性患者的临床表现和基因突变特点进行整理和归纳。
1.3 基因组DNA提取和鉴定 采用离心柱型血液基因组DNA提取试剂[TIANamp Blood DNA Kit,天根生化科技(北京)有限公司]提取研究对象外周静脉血中的基因组DNA,应用NANODROP 2000核酸检测仪对DNA原液进行定量和纯度分析。
1.4 全外显子组测序(whole exome sequencing,WES) 对3例COL4A3、COL4A4、COL4A5双基因突变型XLAS女性患者进行WES,全外显子捕获芯片采用Agilent SureSelect Human All Exon V5试剂盒(安捷伦科技有限公司),有效覆盖区域为50 Mb。
1.5 Sanger测序验证 对WES检出的与临床相符的致病或可能致病的COL4A3、COL4A4、COL4A5基因突变位点,分别设计引物,采用PCR进行扩增。验证该位点在家系患病成员和其他成员中是否与疾病表共分离。查询莱顿开放变异数据库(Leiden open variation database, LOVD;https://databases.lovd.nl/shared/variants/COL4A)和人类基因突变数据库(human gene mutation database,HGMD;http://www.hgmd.cf.ac.uk/ac/search.php),明确上述共分离突变位点是否被收录。如发现的COL4A3、COL4A4、COL4A5基因突变为未曾报道的新突变,进一步通过对120例性别、年龄匹配的汉族健康志愿人群进行Sanger测序明确其人群频率,并参照2015年美国医学遗传学与基因组学学会(ACMG)突变指南[24],应用Polyphen2、SIFT、MaxEntScan、NNSPLICE、Human Splicing Finder、SpliceSiteFinder、GeneSplicer预测软件[25]评估突变位点的致病性。
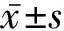
2 结 果
2.1COL4A3、COL4A4、COL4A5双基因突变型XLAS女性患者的基因突变特点与临床特征分析
2.1.1 基因突变特点 如表1和表2所示,本研究3例XLAS女性患者中,1例携带COL4A3和COL4A5双基因杂合突变,2例携带COL4A4和COL4A5双基因杂合突变。共发现6种COL4A3、COL4A4、COL4A5基因突变,均为错义突变(有3种为甘氨酸突变为其他氨基酸);其中,3种位于非胶原结构域(noncollagenous-1 domain, NC1),2种位于三螺旋胶原结构域(triple-helical collagenous domain),1种位于氨基端7s结构域。除COL4A5(c.3500G>A;p.Gly1167Asp)突变为已报道的致病突变外,其余5种均为新突变。
2.1.2 临床特征 如表1所示,3例XLAS女性患者均以镜下血尿或肉眼血尿发病,发病年龄为(7.33±2.08)岁;3例患者均有不同程度蛋白尿,24 h尿蛋白定量(0.45±0.21) g,出现蛋白尿的年龄为(9.33±1.15)岁。1例患者于40岁时进展为ESRD,其余2例患者目前肾功能处于正常范围。3例患者经听力与眼部检查均未发现高频SNHL、前圆锥形晶状体等AS特征性肾外表现。1例患者在9岁时曾行肾脏穿刺活检,光镜下见局灶节段性系膜增生;电镜下未见GBM明显异常,合并足突节段性融合,免疫荧光染色Ⅳ型胶原α3、α5未见异常。2例患者在出现微量蛋白尿时给予RAS抑制剂(renin-angiotensin system inhibitors,RASI)治疗,1例患者就诊时已进展至ESRD并接受肾脏替代治疗。

表1 3例携带COL4A3、COL4A4、COL4A5双基因突变的XLAS女性患者及其家系的临床特征和基因突变情况
在搜索文献得到的10例女性患者中(临床表现和基因突变特点见表2),4例为东亚人种,2例为高加索人种,4例种族不详。其中,6例患者同时携带COL4A3和COL4A5基因杂合突变,3例患者同时携带COL4A4和COL4A5基因杂合突变,1例患者同时携带COL4A3、COL4A4和COL4A5基因杂合突变。10例患者均发病较早且合并不同程度蛋白尿,其中2例患者分别于40、44岁进展至ESRD。3例患者合并肾外表现(2例合并SNHL,1例同时合并SNHL和眼部病变)。
对本研究中3例患者进行家系内调查后共发现9例家系内患病成员,其中7例经Sanger测序验证携带COL4A3、COL4A4、COL4A5单基因突变。相较其中仅携带COL4A5突变的XLAS女性患病成员,COL4A3、COL4A4、COL4A5双基因突变型XLAS女性患者具有发病早、合并蛋白尿和肾功能受损比例高的特点。见表2和图1。

A为家系1 B为家系2 C为家系3图1 3例COL4A3、COL4A4、COL4A5双基因突变型XLAS女性患者家系图

表2 本研究和既往已报道的13例COL4A3、COL4A4、COL4A5双基因或三基因突变型XLAS女性患者的临床特征与基因突变类型
3 讨 论
随着NGS在临床的普及,多基因遗传模式在遗传性肾脏病中陆续被报道[26-28],且不同基因突变对疾病严重程度存在协同作用。除AS外,其他遗传性肾脏疾病如先天性肾病综合征(NPHS1和NPHS2双基因突变)[26]、常染色体显性多囊肾病(PKD1和PKD2双基因突变)[27],以及Bartter综合征(CLCNKA和CLCNKB双基因突变)[28]等亦有双基因遗传模式被报道。2015年Mencarelli等[15]首次报道了11例COL4A3、COL4A4、COL4A5双基因突变型AS患者,并提出AS可能存在双基因遗传模式,且该特殊遗传模式有助于解释同一家系中不同患者临床症状严重程度的差异。同时该研究[15]指出,携带COL4A3、COL4A4、COL4A5双基因突变的患者临床表型严重程度可能介于ADAS与ARAS之间。2019年,Zhang等[19]报道了首例COL4A3、COL4A4、COL4A5三基因突变型XLAS女性患儿。之后陆续有文献对此类患者进行报道。
截至目前,共有10例COL4A3、COL4A4、COL4A5双基因或三基因突变型XLAS女性患者被报道,其中6例患者同时携带COL4A3和COL4A5基因杂合突变,3例患者同时携带COL4A4和COL4A5基因杂合突变,1例患者同时携带COL4A3、COL4A4和COL4A5基因杂合突变。与本研究新发现的3例COL4A3、COL4A4、COL4A5双基因突变型XLAS女性患者类似,这10例患者均发病较早且合并不同程度蛋白尿,其中2例患者分别于40、 44岁时进展至ESRD,3例患者合并肾外表现。由此可见,COL4A3、COL4A4、COL4A5多基因遗传是影响XLAS女性患者临床表型严重程度的重要因素。此外,XLAS女性患者如同时携带非COL4A类基因突变,如MYO1E基因(c.2627C>G;p.Thr876Arg)[11]、MYH9基因(c.4952T>C;p.Met1651Thr)[12]、LAMA5基因(c.3728C>T;p.Pro1243Leu)[13]突变或基因多态性位点,如NPHS2基因(c.686G>A;p.Arg229Gln;rs61747728)[14],亦可加重肾脏临床表型,并导致肾外表现如高频SNHL[12]。
虽然,目前尚无已应用于临床的AS精准靶向治疗方法,但多项回顾性研究[29-30]和前瞻性研究[31]均已证实RASI对AS具有确切的肾脏保护作用。RASI治疗可使携带非截短型COL4A5基因突变患者和截短型COL4A5基因突变患者进展至ESRD的时间分别延迟17、12年[32]。2013年版AS治疗指南推荐[33],AS患者应在出现微量白蛋白尿或显性蛋白尿时开始接受RASI治疗。2020年,一项名为“Early Prospective Therapy European Community Trial Alport(EARLY PRO-TECT Alport)”的Ⅲ期临床试验结果表明,AS患者在出现微量蛋白尿之前使用雷米普利治疗能有效延缓蛋白尿的进展和肾小球滤过功能的下降[31]。据此,Kashtan等[5]建议,XLAS男性患者和ARAS患者在确诊时就应开始接受治疗。本研究中的2例双基因突变型XLAS女性患者在出现微量蛋白尿时即给予RASI治疗。目前对于COL4A3、COL4A4和COL4A5基因杂合突变患者何时启动RASI治疗尚无大样本前瞻性研究[34-35],有待今后开展随机对照研究予以明确。
本研究为单中心回顾性研究,纳入的3例COL4A3、COL4A4、COL4A5双基因突变型XLAS女性患者数量占本中心45例XLAS女性患者的6.7%,高于先前文献报道的1%,这可能与本中心使用NGS技术进行基因检测有关。今后可利用NGS技术开展多中心前瞻性研究以更好地了解该类患者在XLAS女性患者中的比例。
结合本研究结果与相关文献报道,值得关注的是,AS已成为CKD的重要病因之一;同时,AS患者中除XLAS男性患者外,其他包括XLAS女性患者可存在临床表型与基因表型关联性欠佳,起病可隐匿,或以单纯血尿和蛋白尿发病,临床症状轻重不一,典型的肾外损伤表现可缺如,相当部分患者可出现肾功能减退等特点。这对我国CKD的防治管理工作提出了挑战。上海作为全国老龄化程度较高的城市,CKD对上海人口健康水平和生活质量的威胁较为严重。故笔者认为,应对CKD的高危人群(如XLAS女性患者),一方面应施行疾病检测端口的前移以充实疾病基因样本库,另一方面可采用问卷调查和线上讲座等形式加强基层医师对相关疾病的认知,并且通过有效的科普宣传模式提高社区居民的CKD自我防范意识,以促进疾病的早期预防。
综上所述,COL4A3、COL4A4、COL4A5双基因或三基因突变型XLAS女性患者发病早、合并蛋白尿和肾功能受损比例高,提示多基因遗传是影响XLAS女性患者临床异质性的重要因素。对临床表现重和肾功能损害进展快的XLAS女性患者需考虑存在多基因遗传可能,并可运用NGS技术检测予以明确。
