核桃分心木镇静催眠活性成分研究
2021-07-07洪茜茜耿树香张银志孙秀兰徐德平
洪茜茜,耿树香,张银志,孙秀兰,徐德平*
1江南大学食品学院,无锡 214122;2云南省林业科学院,昆明 650201
核桃分心木(Diaphragma Juglandis Fructus,DJF),又称核桃隔膜、核桃瓣膜。核桃分心木的传统药用用途包括治疗和预防糖尿病[1,2]、肾虚、腹泻和泌尿生殖系统疾病。体内外研究发现除了传统的补肾作用外,分心木还具有镇静催眠[3]、抗氧化[4,5]、抗炎[6]、抗肿瘤[7]等作用,可应用于保健食品、医药等相关领域的产品开发。
在全球范围内,大约10%~15%的成年人患有慢性失眠,而另外25%~35%的人则患有短暂性或偶发性睡眠障碍[8]。除了影响日常生活质量和工作效率外,这些障碍还会导致各种健康和社会经济问题[9]。在失眠的传统治疗方法中,药物治疗是最常用,如苯二氮卓类药物和非苯二氮卓类药物等处方药会发挥镇静催眠作用以改善患者的病情;但是,长期使用可能会导致习惯化和戒断症状[10,11]。面对这些限制,人们倾向于寻求有效安全且副作用更少的天然药物来治疗或减轻失眠症状。
目前针对分心木镇静催眠活性研究多集中于粗提物,未能定位到具体功能成分。Zhao[12]发现分心木水提物能缩短戊巴比妥钠诱导的小鼠入睡潜伏时间、延长睡眠持续时间、趋势性降低自主活动。本文利用小鼠旷场实验和戊巴比妥钠诱导的睡眠实验指导分离方向,通过柱层析和薄层色谱逐步分离出具有镇静催眠活性的单体化合物,核磁共振技术鉴定其结构。研究结果可为核桃分心木资源的开发利用提供理论依据,增加核桃资源附加值。
1 材料与试剂
1.1 材料及试剂
核桃分心木(云南省林业科学院)。
无水乙醇、浓硫酸、茴香醛、冰醋酸(分析纯,国药集团化学试剂有限公司);戊巴比妥钠(成都贝斯特试剂有限公司);艾司唑仑(常州四药制药有限公司)。
SPF级雄性ICR小鼠(维通利华实验动物技术有限公司)。
1.2 设备及仪器
AB-8型(天津南开大学化学工厂);ODS填料(Nacalai Tosoh Inc);MCI GEL填料(Mitsubishi Chemical Corporation)。核磁共振仪(Avance 500 MHz,Bruer公司);DS-2CD2TDY-14mm型网络摄像机(杭州海康威视数字技术股份有限公司); Ethovision 11.5行为学计算机软件分析系统(Intetro 旷场,诺达斯信息技术责任有限公司)。
2 方法
2.1 核桃分心木提取物制备及粗分离
称取核桃分心木10 kg,粉碎后过40目筛,置于100 L提取罐,按1∶10(kg∶L)料液质量体积比加入体积分数70%乙醇,60 ℃条件下搅拌提取4 h,过滤,取滤液,滤渣按上述方法再次醇提,收集滤液并与第一次滤液合并,减压浓缩至适宜体积,即为分心木乙醇提取物,-20 ℃下冷冻保存。分心木醇提后的滤渣中水提两次,收集滤液减压浓缩至膏状物,即为分心木水提物。
取适量分心木水提物,加入3倍体积的无水乙醇,并且不断搅拌使得浓缩液充分醇沉,静置过夜,水提醇沉相(A)经干燥得到固态颗粒于-20 ℃下冷冻保存,水提醇溶相减压浓缩至适宜体积和醇提物合并,即为分心木混合提取物。取适量分心木混合提取物上AB-8型大孔树脂柱(10 cm×150 cm),依次用水和30%、50%、70%的乙醇进行梯度洗脱,薄层色谱法(thin-layer chromatography,TLC)跟踪监测洗脱液中的成分,并根据TLC检测结果将具有相同成分的洗脱液合并,将洗脱液分成B(水洗脱)、C(30%和50%洗脱)和D(70%洗脱)3个部分。分别减压浓缩后,-20 ℃下冷冻保存。
2.2 核桃分心木粗组分镇静催眠功效的研究
将60只SPF级4周龄雄性ICR小鼠适应性饲养1周后,随机分为6组,每组10只。空白组和试验组以1.0 g/kg·bw剂量分别灌胃溶剂、A、B、C、D,阳性对照组以2 mg/kg·bw艾司唑仑灌胃。连续灌胃14天后,展开试验。试验在25 ℃左右安静环境下进行。
2.2.1 旷场实验
使用由4个活动空间组成的4个单元(每个单元50 cm×50 cm×38 cm)的旷场迷宫进行实验,每次检测4只鼠。实验前用酒精将旷场空间擦干净,样品组给药30 min后(阳性对照组给药15 min)开始实验。实验时轻轻抓住鼠尾,将鼠放在每个单元旷场迷宫的中间,让小鼠在迷宫内适应5 min,之后点击软件开始按钮激活软件,跟踪鼠移动路径,以10 min内运动平均速度、运动时间和中央区域停留时间为指标,使用EthoVision XT 11软件进行数据分析。每次试验结束,清理尿液和粪便,并使用5%~10%的乙醇喷洒在迷宫底面和内壁,用纸巾擦拭干净,消除小鼠遗留的气味后再测试下一组小鼠,避免气味和残留物对下一只小鼠的影响[13]。
2.2.2 直接观察睡眠实验
旷场实验结束次日晚进行直接睡眠观察。灌胃30 min后,监控摄像观察并记录灌胃后12 h内各组小鼠的睡眠时间[14]。
2.2.3 戊巴比妥钠诱导的睡眠实验
在正式实验前先进行预实验确定戊巴比妥钠腹腔注射剂量,以腹腔注射后全部小鼠入睡且睡眠持续时间适中的剂量为标准,并以此剂量(为50 mg/kg·bw)进行正式实验。小鼠末次灌胃30 min后通过腹腔注射戊巴比妥钠诱导睡眠,小鼠睡眠潜伏期记录为戊巴比妥钠注射后至翻正反射消失的时间,以翻正反射消失至再次出现的时间记录为小鼠睡眠时间[15],观察各组潜伏期是否缩短,睡眠时间是否延长。
2.3 大孔树脂洗脱活性组分的分离及镇静催眠功能的测定
将具有镇静催眠功能的B组分上样到MCI柱(5 cm×100 cm),依次用水,10%、30%和50%的乙醇进行梯度洗脱,流速15 mL/min,自动收集器每管20 mL收集洗脱液,用TCL法跟踪监测洗脱液中的成分,并根据Rf值和显色反应的结果合并相同组分,得到B-1(水洗脱)、B-2(10%和30%洗脱)、B-3(50%洗脱)三个组分。
2.4 MCI柱洗脱组分镇静催眠功效的研究
按2.2方法对MCI柱分离得到的B-1、B-2、B-3组分进行动物试验,分析各组分镇静催眠的作用。
2.5 具有镇静催眠活性的单一成分的分离与结构鉴定
将具有镇静催眠功能的B-1组分反复上样到ODS色谱柱,直至得到4个单体成分,用重水(D2O)或氘代二甲亚砜(DMSO-d6)溶解进行1H NMR和13C NMR等光谱数据分析,确定其结构。
2.6 单体化合物镇静催眠的功效
将单体化合物按“2.2”的方法进行动物试验,判定其镇静催眠的功效。
2.7 数据分析
数据表示为平均值±标准误差(SEM)。使用SPSS 20软件单向方差分析(ANOVA)对数据进行统计评估。P< 0.05被认为具有统计学显著性。
3 结果
3.1 大孔树脂粗组分镇静催眠活性分析
3.1.1 镇静活性分析
从表1旷场实验表明,与空白组相比,阳性对照组和B组均显著降低了小鼠的运动速度和运动时间(P<0.05),其中阳性对照组显著降低增加了小鼠在中央区域的停留时间(P<0.05)。而其他组分较之空白组没有统计学差异。

表1 核桃分心木粗组分对小鼠运动速度、运动时间以及中央区域停留时间的影响
3.1.2 催眠活性分析
如表2所示,从灌胃后12 h内睡眠总时长来看,各实验组较之空白组均有所增加,且仅B组和阳性对照组极显著(P< 0.01)。另外,戊巴比妥钠诱导的睡眠实验结果表明,B组和阳性对照组分别使睡眠潜伏期缩短了24.62%(P<0.05)和25.88%(P<0.05),同时令睡眠时长延长了61.49%(P<0.05)和254.19%(P< 0.01)。
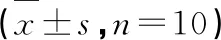
表2 核桃分心木粗组分对小鼠自然情况12 h睡眠时长、戊巴比妥钠诱导睡眠的潜伏期和睡眠时间的影响
由上述结果可知,B组为分心木中镇静催眠的活性部位,对其进行进一步的分离。

续表2(Continued Tab.2)
3.2 MCI洗脱各组分镇静催眠活性分析
3.2.1 镇静活性分析
由表3可知,与空白组相比,B-1组虽未显著降低小鼠的运动速度(降低了15.87%),但使得运动时间减少了17.17%(P<0.05),中央区域的停留时间增加了57.85%(P<0.05)。
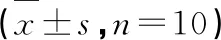
表3 MCI洗脱各组分对小鼠运动速度、运动时间以及中央区域停留时间的影响
3.2.2 催眠活性分析
如表4所示,从灌胃后12 h内睡眠总时长来看,B-1、B-2、阳性对照组的睡眠总时长分别增加了36.4%(P<0.05)、11.99%、49.77%(P<0.01),而B-3组睡眠时长有所降低。B-1组和阳性对照组分别使睡眠潜伏期缩短了21.87%(P<0.05)和27.21%(P<0.05),同时令睡眠时长延长了49.09%(P<0.05)和281.30%(P< 0.01)。
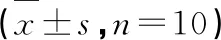
表4 MCI洗脱各组分对小鼠自然情况12 h睡眠时长、戊巴比妥钠诱导睡眠的潜伏期和睡眠时间的影响
综合上述结果,B-1组为镇静催眠的有效组分,对其进行进一步的分离纯化。
3.3 单体化合物的鉴定
具有镇静催眠活性的B-1组分经进一步的分离得到4个单体化合物。
化合物1白色无定形粉末,易溶于水;从1H NMR(500 MHz,D2O)谱可见,氢信号集中在3~4之间,且无端基氢信号,故推测为糖类化合物。13C NMR谱共显示6个碳信号,结合135DEPT可见,无端基碳信号,且δC62.9(C-1)、72.6(C-2)、74.1(C-3)、70.0(C-4)、71.1(C-5)、62.4(C-6)。经文献对比[16,17],分析该化合物为2-羟甲基-四氢吡喃-3,4,5-三醇,又称1,5-脱水-D-葡萄糖醇。
化合物2白色无定形粉末,易溶于水;从1H NMR(500 MHz,D2O)谱可见,共有5个氢信号,其中δH6.63(1H,s)、4.07(1H,s)、3.86(1H,s,J= 4.0 Hz)、2.79(1H,d,J=15.0 Hz)、2.63(1H,dd,J=8.0,7.5 Hz),其中δH4.07为连氧碳的氢信号,δH2.79和2.63为-CH2-的氢信号;13C NMR谱共显示4个碳信号,分别为δC181.2(-COOH)、135.5、70.2、42.5。135DEPT谱图可知,δC135.5为-CH-的碳信号,根据化学位移推断-CH-以双键与亚氨基相连,δC70.2为连氧碳信号,δC42.5为-CH2-的碳信号。经文献对比[18],分析该化合物为3-羟基-4-亚氨基丁酸。
化合物3淡黄色粉末,可溶于水、乙醇和甲醇;从1H NMR(500 MHz,DMSO-d6)谱可见,δH4.38(1H,d,J=4.5 Hz)为葡萄糖上的端基H信号,δH3.15(1H,t,J= 8.5 Hz),δH3.00(1H,t,J= 8.5 Hz)表明有2个-CH-,δH3.07~4.38为糖上的H信号,1.06(3H,m),1.01(3H,m)表明有2个甲基存在,δH4.17(1H,t,J= 4.0 Hz)表明存在-OH,且相邻碳上有氢;13C NMR谱共显示10个碳信号,δ100.79为葡萄糖端基碳信号,δC77.8、73.5、70.3、69.1、61.2为葡萄糖的其余碳信号,δC76.8、76.7为-CH-的碳信号,δC19.1、14.7为-CH3信号。通过端基碳信号和氢信号的偶合常数表明葡萄糖为α构型。经文献对比[19],分析该化合物为(1′-甲基-2′-羟基)丙烷-O-α-D-吡喃葡萄糖苷。
化合物4白色粉末,易溶于水、乙醇等,不溶于氯仿;从1H NMR(500 MHz,DMSO-d6)谱可知,δH6.84(1H,d,J= 8.5 Hz)和7.01(1H,d,J= 7.0 Hz)为连有羟基碳的邻位碳上的氢。δH5.45(1H,d,J= 5.0 Hz)和5.14(1H,d,J= 5.0 Hz)为两个葡萄糖端基H信号,葡萄糖6'位上的两个质子分别在δH3.50和3.54,δH3.18~3.44为糖上的其他质子信号。13C NMR谱显示共有22个碳信号,其中12个碳为糖中的碳,且δC101.5和103.5为端基碳信号。δC148.8、149.0、153.3为萘环上的连氧碳信号,δC126.9和128.0为两苯环连接处的碳信号,δC109.3~115.7为萘环上的-CH-信号。通过端基碳信号和氢信号的偶合常数表明两个葡萄糖均为β构型。经文献对比[20],分析该化合物为6-羟基萘基-1,2-(2-O-β-D-吡喃葡萄糖苷)。
3.4 单体化合物镇静催眠活性分析
3.4.1 镇静活性分析
单体化合物的镇静结果见表5。与空白组相比,化合物1、3、4未表现出显著性差异;化合物2则显著降低了小鼠的运动速度和运动时间(P<0.05),增加了小鼠在中央区域的停留时间(P<0.01)。
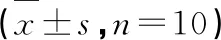
表5 单体化合物对小鼠运动速度、运动时间以及中央区域停留时间的影响
3.4.2 催眠活性分析
如表6所示,化合物1和2以及阳性对照组12 h内的睡眠总时长较之空白组均有所增加,且具有统计学差异(P<0.05)。戊巴比妥钠诱导的睡眠实验结果表明,化合物1未能缩短潜伏期,但可延长睡眠时间;化合物2使睡眠潜伏期缩短了24.62%(P<0.05),且使睡眠时长延长了61.49%(P<0.05)。化合物3相较于空白组无明显差异。化合物4虽使得小鼠睡眠潜伏期缩短,但对其睡眠时长几乎无影响。

表6 单体化合物对小鼠自然情况12 h睡眠时长、戊巴比妥钠诱导睡眠的潜伏期和睡眠时间的影响
综上所述,化合物1仅具有延长小鼠睡眠时间的功能,而化合物2则具有镇静催眠活性。
4 讨论与结论
目前已被明确研究的天然镇静催眠成分有糖类,类黄酮,木脂类和香豆素以及皂苷等[21],含有糖类、黄酮类、木脂素类、酚类、皂苷类的分心木可能在镇静催眠方面具有良好的疗效。本研究探讨了核桃分心木的镇静催眠作用及其功效成分。在评估镇静和催眠活性的药理学方法中,旷场实验和戊巴比妥钠诱导的睡眠实验是两种经典的行为方法。在旷场实验中测得的小鼠平均运动速度、时间等通常被认为是控制睡眠活动的重要指标[22]。本研究表明,化合物2能减少正常小鼠的平均运动速度以及时间,增加在中央区域停留的时间。此外,戊巴比妥钠(短期镇静剂和催眠药)诱发的睡眠试验中获得的潜伏期和睡眠持续时间也通常用作评估物质镇静催眠作用的指标[23]。化合物1未能缩短潜伏期,但可延长睡眠持续时间;化合物2可缩短睡眠潜伏期,延长睡眠持续时长。且两者均能增加自然条件下小鼠12 h内的睡眠时长。其中化合物2(3-羟基-4-亚氨基丁酸)具有显著镇静催眠的活性,可能是因为其结构与γ-氨基丁酸类似,因而具有类似的活性。
据报道,具有镇静催眠功能活性的中药有效成分发挥作用的机理有:(1)调节中枢神经递质。神经递质不仅在正常的睡眠清醒节律调节中起着重要作用,而且在紊乱的过程中也发挥着重要的作用。如五味子乙素B通过增加下丘脑5-HT和γ-氨基丁酸水平在对氯苯丙氨酸致失眠大鼠模型中发挥催眠作用[24]。(2)影响睡眠相关细胞因子,如胆囊收缩素、食欲素和其他内源性物质。曾雪爱等发现松郁安神方的镇静催眠作用机制可能与调节下丘脑内源性睡眠促进物质PGD2含量有关[25]。故化合物1和2可能是通过以上2种途径发挥镇静催眠作用,具体是哪种作用机制有待进一步研究。
核桃分心木提取物大孔树脂水洗脱组分具有镇静催眠的活性,该组分经MCI分离后,有效组分集中在MCI水洗脱物中,对其进一步分离得到4个单体化合物,分别为2-羟甲基-四氢吡喃-3,4,5-三醇(1)、3-羟基-4-亚氨基丁酸(2)、(1′-甲基-2′-羟基)丙烷-O-α-D-吡喃葡萄糖苷(3)、6-羟基萘基-1,2-(2-O-β-D-吡喃葡萄糖苷)(4)。本文通过动物实验初步判断2-羟甲基-四氢吡喃-3,4,5-三醇仅具有延长小鼠睡眠时间的功效,3-羟基-4-亚氨基丁酸则具有镇静催眠的功能活性。上述研究为分心木应用于治疗失眠提供了理论支持,为其后续的保健食品药品的开发、镇静催眠功效的临床应用奠定了基础。
