天名精萜类成分及其抗肿瘤活性研究
2021-07-07杨宝嘉曾政权郝小江李顺林
杨宝嘉,曾政权,宋 玉,郝小江,李顺林*
1中国科学院昆明植物研究所 植物化学与西部植物资源持续利用国家重点实验室,昆明 650201;2中国科学院大学,北京 100049;3陕西师范大学,西安 710062
菊科Compositae天名精属Carpesium植物在世界范围内约有21种,大部分均分布在亚洲和欧洲[1]。天名精(CarpesiumabrotanoidesL.)作为多年生草本的传统中药材,被中国、韩国、日本等东南亚国家长期用于治疗各种疾病[2]。《本草纲目》对天名精有记载,甘、寒、无毒;主治吐血,咽喉肿塞,痰涎壅滞,风毒瘰疬,疔疮肿毒,蛔虫、蛲虫[3]。国内外报道,该植物富含单萜、倍半萜、二萜和酚类等特征成分,且多具有有效的消炎、抗真菌、抗寄生虫、抗肿瘤和抗病毒等药理活性[4-6]。萜类化合物具有丰富的结构类型和多样的生物活性,比如倍半萜、单萜等化合物,它们为先导化合物的发现提供了重要的物质基础,对新药研发有着重要的应用价值[7]。
为进一步研究天名精植物的化学资源,继续寻找具有生物活性的化学成分。本研究对其石油醚提取物的化学成分及体外抗肿瘤活性进行探寻,可为传统中药材在抗肿瘤活性领域的开发与利用提供一定理论依据。
1 材料与方法
1.1 仪器与材料
Bruker AV 500 MHz、600 MHz或800 MHz核磁共振仪(TMS为内标);Agilent UPLC/Q-Tof 液质联用仪;岛津HPLC-20 AT;色谱柱为Capecell Pack MG II(4.6 mm×250 mm,5 μm),Shim-Pack GIS(10 mm×250 mm,5 μm);Multiskan FC-Thermo多功能酶标仪。
硅胶、GF 254薄层层析硅胶板(青岛海洋化工厂);反相填料Lichroprep RP-18 gel(40-63 μm)(德国默克公司);MCI填料MCI-gel-CHP-20 P(日本三菱公司);凝胶Sephadex LH-20(Pharmacia公司)。显色剂为10%硫酸乙醇和5%香草醛,均匀喷洒后加热至显色。
天名精于2019年10月购自安徽亳州市焦城区昌升中药材市场,经中国科学院昆明植物研究所雷立公研究员鉴定为CarpesiumabrotanoidesL.的全草,标本(No.H20191027)现保存于中国科学院昆明植物研究所植物化学与西部植物资源持续利用国家重点实验室。
1.2 细胞株
白血病(HL60)、肺癌(A549)、肝癌(SMMC7721)、乳腺癌(MCF7)以及结肠癌(SW480)均由中国科学院昆明植物研究所天然药物活性筛选中心提供。
1.3 实验方法
1.3.1 提取分离
干燥的天名精全草10 kg,粉碎后甲醇加热回流浸提三次,合并浸提液、减压蒸馏浓缩,得到甲醇浸膏。此浸膏经水混悬后,依次用石油醚、乙酸乙酯以及正丁醇萃取。将石油醚萃取物250.7 g以体积比1∶1拌硅胶(200~300目)进行柱层析,石油醚/丙酮(100∶1→1∶1)梯度洗脱,得到六组分(Fr.1~6)。
Fr.3组分14.7 g经MCI层析柱,甲醇-水(30%→100%)梯度洗脱,得到七部分(Fr.3.1~3.7)。Fr.3.3经二氯甲烷/甲醇(1∶1,V/V)Sephadex LH-20凝胶分离,再经半制备HPLC纯化(80%甲醇水,保留时间10.5 min),得到化合物1(6.1 mg)。Fr.3.4经硅胶柱分离,以石油醚/乙酸乙酯(25∶1→5∶1)梯度洗脱,再经半制备HPLC纯化(38%乙腈水,保留时间35 min),得到化合物5(3.2 mg)。Fr.3.6经反复硅胶柱层析、RP-C18和甲醇Sephadex LH-20凝胶纯化,得到化合物4(10.9 mg)、7(5.6 mg)。
Fr.5组分49.0 g经MCI层析柱,甲醇-水(10%→100%)梯度洗脱,得到五部分(Fr.5.1~5.5)。Fr.5.1经过石油醚/丙酮(30∶1→5∶1)梯度洗脱,再经半制备HPLC纯化(50%乙腈水,保留时间10、12 min),得到化合物3(4.2 mg)、6(4.3 mg)。Fr.5.2经反复硅胶柱层析和甲醇凝胶分离,再经半制备HPLC纯化(35%乙腈水,保留时间31 min),得到化合物8(4.1 mg)。Fr.5.3经过石油醚/丙酮(25∶1→5∶1)梯度洗脱,再经半制备HPLC纯化(50%甲醇水,保留时间65 min),得到化合物9(4.3 mg)。Fr 5.4 经甲醇凝胶分离和半制备HPLC纯化(49%乙腈水,保留时间11.5 min),得到化合物2(2.8 mg)。
1.3.2 细胞毒活性测试-MTS法
用含10%的胎牛血清培养液(DMEM或RMPI 1640)配成单个细胞悬液,以每孔3 000~15 000个细胞接种到96孔板,每孔体积100 μL,细胞需提前12~24 h接种培养。化合物用DMSO溶解,将单体化合物配制为40 μM浓度进行初筛,每孔终体积为200 μL,每个处理均设置3个复孔。37 ℃培养48 h后,贴壁细胞弃孔内培养液,每孔加MTS溶液20 μL和培养液100 μL;悬浮细胞弃100 μL培养上清液,每孔加20 μL的MTS溶液;设3个空白复孔(MTS溶液20 μL和培养液100 μL的混合液),继续孵育2~4 h,使反应充分进行后测定光吸收值(OD)。选择492 nm波长,多功能酶标仪读取各孔OD值。顺铂(DDP)和紫杉醇(taxol)为阳性化合物。每组实验独立重复三次,按如下公式计算数据,用Excel软件进行统计分析处理,结果以均值±标准差表示。
抑制率=[(空白组平均OD值-实验组OD
值)/空白组平均OD值]×100%
2 结果
2.1 结构鉴定
化合物1无色油状物;ESI-MS:m/z361 [M+Na]+,分子式C18H26O6;1H NMR(500 MHz,CDCl3)δ:6.89(1H,d,J= 8.0 Hz,H-5),6.70(1H,s,H-2),6.64(1H,dd,J= 8.0,1.8 Hz,H-6),4.45(4H,dd,J= 18.7,12.0 Hz,H-9,H-10),2.57(2H,m,H-2′,H-2′′),2.27(3H,s,7-CH3),1.12(12H,d,J= 7.0 Hz,3′,3′′,3′,3′′-CH3);13C NMR(125 MHz,CDCl3)δ:140.1(s,C-1),118.6(d,C-2),156.6(s,C-3),118.7(s,C-4),126.5(d,C-5),120.5(d,C-6),21.0(q,C-7),78.8(s,C-8),67.3(t,C-9,C-10),177.5(s,C-1′,1′′),33.9(d,C-2′,C-2′′),18.8(q,C-3′,3′,3′′,3′′)。以上数据与文献[8]报道一致,故鉴定为8-hydroxy-9,10-diisobutyryloxy-thymol。
就这样,在唐人街,他结识了很多热心朋友,他们会告诉李先生哪里有最适合老人休闲的地方,哪里有李先生会喜欢的特色小吃,哪里有最近的便利店等等。有了他们,李先生就像多了很多双眼睛。有什么不懂和需要,他在华人社区里聊上一圈,就全解决了。
化合物3无色油状物;ESI-MS:m/z189 [M+Na]+,分子式C10H14O2;1H NMR(600 MHz,CDCl3)δ:7.00(1H,d,J= 7.4 Hz,H-5),6.73(1H,d,J= 8.2 Hz,H-6),6.71(1H,s,H-2),3.94(1H,dd,J= 9.7,3.8 Hz,H-9a),3.72(1H,dd,J= 9.7,7.8 Hz,H-9b),3.21(1H,m,H-8),2.28(3H,s,7-CH3),1.31(3H,d,J= 7.3 Hz,10-CH3);13C NMR(150 MHz,CDCl3)δ:137.9(s,C-1),117.7(d,C-2),154.7(s,C-3),127.5(s,C-4),127.6(d,C-5),121.4(d,C-6),20.9(q,C-7),36.6(d,C-8),69.6(t,C-9),15.7(q,C-10)。以上数据与文献[10]报道一致,故鉴定为9-hydroxy-thymol。

化合物5无色油状物;ESI-MS:m/z237 [M-H]-,分子式C13H18O4;1H NMR(600 MHz,CDCl3)δ:6.84(1H,d,J= 7.8 Hz,H-5),6.73(1H,s,H-2),6.66(1H,d,J= 7.8 Hz,H-6),4.22(2H,d,J= 11.6 Hz,H-9a,H-10a),3.84(2H,d,J= 11.6 Hz,H-9b,H-10b),2.28(3H,s,7-CH3),1.56(3H,s,2′-CH3),1.51(3H,s,3′-CH3);13C NMR(150 MHz,CDCl3)δ:140.2(s,C-1),118.8(d,C-2),156.7(s,C-3),118.4(s,C-4),124.9(d,C-5),120.5(d,C-6),21.0(q,C-7),72.2(s,C-8),68.0(t,C-9,C-10),98.7(s,C-1′),17.7(q,2′),29.2(q,C-3′)。以上数据与文献[12]报道一致,故鉴定为8-hydroxy-9,10-dioxy-isopropylidene-thymol。
化合物6无色油状物;ESI-MS:m/z231 [M+Na]+,分子式C13H20O2;1H NMR(800 MHz,CDCl3)δ:6.54(1H,dd,J= 15.8,10.2 Hz,H-7),6.10(1H,d,J= 15.8 Hz,H-8),5.63(1H,d,J= 3.0,1.5 Hz,H-4),4.27(1H,s,H-3),2.50(1H,d,J= 10.2 Hz,H-6),2.26(3H,s,10-CH3),1.84(1H,dd,J= 13.5,6.0 Hz,H-2b),1.64(3H,s,13-CH3),1.41(1H,dd,J= 13.6,6.4 Hz,H-2a),1.03(3H,s,11-CH3),0.89(3H,s,12-CH3);13C NMR(200 MHz,CDCl3)δ:33.9(s,C-1),43.8(t,C-2),65.5(d,C-3),125.8(d,C-4),135.5(s,C-5),54.3(d,C-6),147.1(d,C-7),133.6(d,C-8),198.0(s,C-9),27.2(q,C-10),29.3(q,C-11),24.7(q,C-12),22.7(q,C-13)。以上数据与文献[13]报道一致,故鉴定为(3R,6R,7E)-3-hydroxy-4,7-megastigmadien-9-one。
化合物7无色油状物;ESI-MS:m/z247 [M+Na]+,分子式C13H20O3;1H NMR(500 MHz,CDCl3)δ:5.92(1H,s,H-2),5.87(1H,dd,J= 15.6,5.4 Hz,H-8),5.79(1H,d,J= 15.6 Hz,H-7),4.42(1H,m,H-9),2.45(1H,d,J= 17.0 Hz,H-6a),2.25(1H,d,J= 17.0 Hz,H-6b),1.90(3H,s,13-CH3),1.30(3H,d,J= 6.4 Hz,10-CH3),1.08(3H,s,12-CH3),1.00(3H,s,11-CH3);13C NMR(125 MHz,CDCl3)δ:198.0(s,C-1),126.9(d,C-2),162.55(s,C-3),79.1(s,C-4),41.2(s,C-5),49.7(s,C-6),135.7(d,C-7),129.0(d,C-8),68.0(d,C-9),23.8(q,C-10),22.9(q,C-11),24.1(q,C-12),18.9(q,C-13)。以上数据与文献[14]报道一致,故鉴定为blumenol A。
化合物9无色油状物;ESI-MS:m/z219 [M+Na]+,分子式C11H16O3;1H NMR(500 MHz,CDCl3)δ:5.69(1H,s,H-10),4.33(1H,qt,H-5),1.40~2.56(4H,m,H-4a,H-4b,H-6a,H-6b),1.78(3H,s,7-CH3),1.47(3H,s,2-CH3),1.27(3H,s,1-CH3);13C NMR(125 MHz,CDCl3)δ:26.40(q,C-1),27.0(q,C-2),35.9(s,C-3),45.6(t,C-4),66.9(d,C-5),47.14(t,C-6),30.7(q,C-7),86.6(s,C-8),172.1(s,C-9),113.0(d,C-10),182.4(s,C-11)。以上数据与文献[16]报道一致,故鉴定为loliolide。
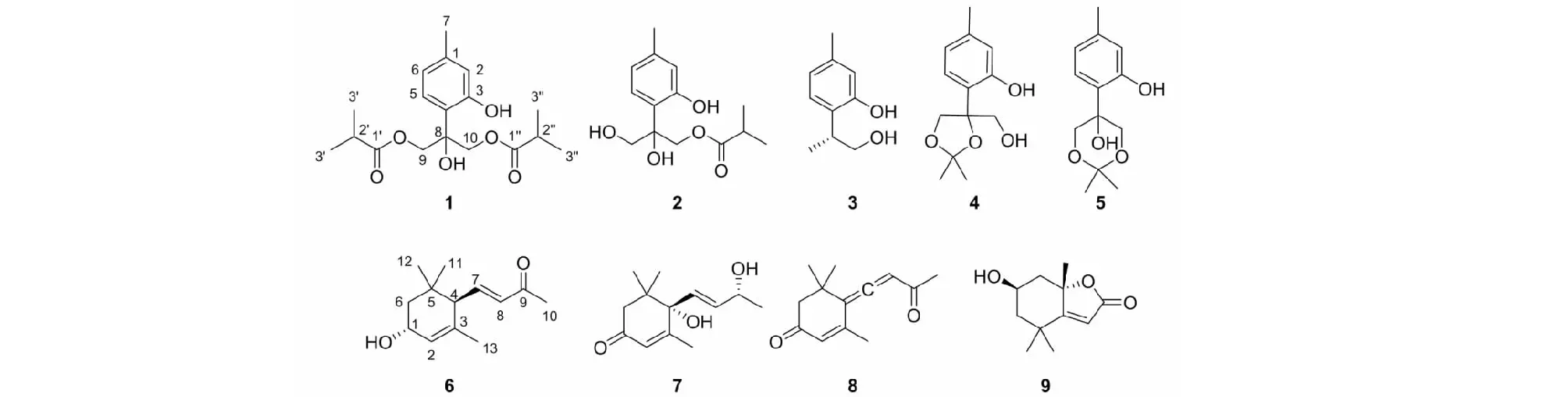
图1 化合物1~9的化学结构Fig.1 Chemical structures of compounds 1-9
2.2 抗肿瘤活性
经文献调研显示,天名精属植物中萜类化合物具有显著的生物活性,为此本文选取分离得到的单萜类、倍半萜类化合物分别对白血病(HL60)、肺癌(A549)、肝癌(SMMC7721)、乳腺癌(MCF7)和结肠癌(SW480)这常规五株癌细胞进行了体外细胞毒活性筛选。
研究结果显示,这些化合物在40 μM浓度下,对以上五株人肿瘤细胞具有弱的细胞毒活性。其中,化合物2、8对MCF7、SW480细胞的增殖具有一定抑制作用,化合物2抑制作用表现较明显,其对人肿瘤细胞株MCF7、SW480的抑制率分别为71.97%±2.73%和81.25%±1.21%(见表1)。

表1 40 μM化合物对常规五株细胞的细胞毒活性
3 结论
我国地域广阔,拥有丰富的菊科植物资源,为我们对菊科植物进行深入研究提供了丰富的物质资源。而天名精属植物由于其化学成分多样性与药用价值高等特点,一直是天然产物的研究热点。
目前,国内外学者对天名精石油醚部位的化学成分及药理作用研究相对较少。为进一步明确该植物化学资源,我们对其化学成分展开了系统研究,从该植物中首次分离得到9个化合物(包括5个薄荷烷型单萜、3个无内酯环倍半萜、1个降倍半萜内酯),化合物3~8为首次从该属植物分离得到。采用MTS法评价上述化合物的抗肿瘤活性,结果表明单萜类化合物和倍半萜类化合物均具有一定的细胞毒活性。其中,首次发现化合物4、8对白血病(HL60)、肺癌(A549)、肝癌(SMMC7721)、乳腺癌(MCF7)以及结肠癌(SW480)这五株人肿瘤细胞的增殖具有弱的抑制作用;同样化合物9也表现出弱的抑制作用,与前人研究结果基本一致[17-19]。此外,首次发现化合物2对MCF7、SW480两株癌细胞的增殖具有较明显的抑制作用,浓度为40 μM时其抑制率分别为72%和81%;根据初步的构效关系分析,薄荷烷型单萜类化合物9位的羟基可能是活性增效基团。本文首次揭示了天名精中抑制乳腺癌细胞和结肠癌细胞的活性成分,为天名精资源进一步的药物开发与利用奠定了基础。
