响应面法优化藜麦麸皮皂苷最佳提取工艺及其α-葡萄糖苷酶抑制活性
2021-07-07王洪伦
董 琦,谭 亮,胡 娜,2,王洪伦,2*
1中国科学院西北高原生物研究所 中国科学院藏药研究重点实验室;2青海省藏药研究重点实验室,西宁 810008;3中国科学院大学,北京 100049
藜麦(ChenopodiumquinoaWilld.)原产于南美洲安第斯山区,是印加土著居民的主要传统食物,具有5 000~7 000多年的食用和种植历史[1]。藜麦具有丰富的营养价值,其富含总酚与黄酮醇,具有抗氧化、免疫调节及抗癌活性[2,3]。20世纪60年代初,我国开始引进藜麦资源。近几年来,我国藜麦种植面积迅速扩大,2019年全国藜麦种植面积估计超过2万hm2,总产量可达到2~3万吨[4]。藜麦麸皮(即藜麦的外种皮)中含有大量三萜皂苷,但皂苷味苦。食用藜麦之前常通过水洗或者研磨去除[5],所以藜麦实际生产加工过程中会产生大量的藜麦麸皮,但目前对藜麦麸皮的利用仅是简单加工处理用作饲料[6],如果可以利用藜麦麸皮,就能提高藜麦的综合利用价值。三萜皂苷具有抗炎、抗肿瘤、抗动脉粥样硬化和抗糖尿病等活性[7,8],除此之外,已有文献报道藜麦麸皮中白蛋白具有抗氧化和ACE抑制活性[9],其50%乙醇提取物通过激活抗氧化酶系统和阻断TGF-β1途径对四氯化碳诱导的小鼠肝损伤和纤维化具有保护作用[10],同时有研究发现未加工藜麦中的多酚及皂苷提取物对α-葡萄糖苷酶均具有较高的抑制活性[11]。
目前有关藜麦麸皮总皂苷的超声提取工艺尚未见相关文献报道。本实验以藜麦麸皮为实验材料,对超声提取总皂苷的工艺进行优化。在单因素实验的基础上,选择液料比、乙醇浓度、超声时间和超声温度为自变量,以藜麦麸皮总皂苷的提取得率作为响应值,采用响应面法优化得到藜麦麸皮总皂苷的超声提取最佳工艺。本实验同时考察了最佳提取工艺条件下提取物对α-葡萄糖苷酶的抑制活性。同时建立酶反应动力学方程对其抑制动力学进行分析,探讨了藜麦麸皮提取物对α-葡萄糖苷酶的抑制机制,从而挖掘藜麦麸皮作为α-葡萄糖苷酶抑制剂的开发潜力,为藜麦麸皮的进一步开发利用提供理论基础和数据支撑。
1 材料与仪器
1.1 材料与试剂
藜麦麸皮,粉末状,是由白藜麦机械脱去的麸皮制得(由青海博基生物技术有限公司提供)。
α-葡萄糖苷酶(G5003,100UN,来源于酵母,美国Sigma公司);4-硝基苯-α-D-吡喃葡萄糖苷(pNPG,阿拉丁试剂(上海)有限公司);阿卡波糖及齐墩果酸对照品(上海源叶科技有限公司);其他试剂均为国产分析纯。
1.2 仪器与设备
KQ-100B型超声波清洗仪(昆山超声仪器有限公司);EPOCH2型酶标仪(BioTek公司);BE-9010型恒温振荡器(THOMMO SHAKER);Cary 300Bio型紫外-可见分光光度计(美国安捷伦公司)。
1.3 方法
1.3.1 总皂苷含量的测定
采用比色法测定总皂苷的含量[12],并在此基础上略做改动。准确移取0.20 mL样品溶液于10 mL具塞试管中,置于70 ℃水浴上挥去溶剂,分别依次加入新配制的5%香草醛-冰醋酸溶液0.2 mL,高氯酸0.8 mL,摇匀,置于60 ℃水浴加热15 min,取出后立即用冷水冷却数分钟,加入4 mL乙酸乙酯,摇匀,以不加标准品溶液和样品溶液的平行样为空白,在560 nm下测定吸光值,重复3次,以齐墩果酸为标准品,得回归方程为y= 11.892x+ 0.070 9,r= 0.999 6,结果显示质量在0.010 8~0.108 mg/mL范围内线性关系良好。根据标准曲线计算溶液中皂苷的浓度,然后根据公式计算出样品中总皂苷的提取得率,按式(1)计算:
(1)
其中,C:根据标准曲线计算溶液中总皂苷的质量浓度(mg/mL);d:稀释倍数;V:定容体积(mL);M:称取的样品质量(g)。
1.3.2 藜麦麸皮皂苷提取工艺优化
1.3.2.1 单因素实验
准确称取1.0 g藜麦麸皮粉末,选择液料比、乙醇浓度、超声时间和超声温度四个因素,以其中一项因素改变时,其他因素不变进行单因素实验。各单因素变量分别是:液料比(5、10、15、20、25 mL/g)、乙醇浓度(50%、60%、70%、80%、90%),超声时间(0.5、1.0、1.5、2.0、2.5 h)和超声温度(40、50、60、70、80 ℃),提取次数均为3次。
1.3.2.2 响应面优化
在单因素实验结果的基础上,选取液料比(A)、乙醇浓度(B)、超声时间(C)和超声温度(D)为考察因素,以总皂苷提取得率为响应值,采用响应面法进行Box-Behnken中心组合设计,用Design Expert 8.0进行实验数据分析,进而优化藜麦麸皮总皂苷的提取工艺。
1.3.3α-葡萄糖苷酶抑制活性测定
将藜麦麸皮总皂苷提取物配制成不同浓度的样品溶液。采用参考文献[13]方法并作适当调整,以基于pNPG的体外评价模型进行检测。实验分为空白组、空白对照组、样品空白组和样品组,各反应物在96孔板中加样20 μL,每组3个平行,分别加入80 μL 0.1 mmol/L 磷酸缓冲溶液(pH6.8),空白对照组和样品空白组加入50 μL 0.1 mmol/L 磷酸缓冲溶液(pH6.8),其他各组加入50 μLα-葡萄糖苷酶磷酸缓冲溶液(1 U/mL),在恒温振荡器中37 ℃保温30 min后取出,加入50 μL 0.5 mmol/L pNPG溶液,充分混匀,于37 ℃水浴反应20 min,结束后加入50 μL 0.1 mol/L的Na2CO3溶液中止反应。在405 nm处测定吸光值,根据式(2)计算出各样品对α-葡萄糖苷酶的抑制率。以阿卡波糖为阳性对照,绘制药物浓度与对酶的抑制率的关系曲线,求出相应的IC50值。

(2)
其中,AC:空白组吸光值;AB:空白对照组吸光值;AS:样品组吸光值;ASB:样品空白组吸光值。
1.3.4α-葡萄糖苷酶抑制的抑制动力学分析
按照“1.3.3”方法分别测定不同浓度藜麦麸皮总皂苷提取物与酶浓度分别为0.25、0.5、1.0、2.0、4.0 U/mL时反应的初速度,底物最终浓度为0.5 mmol/L,每个浓度做3个平行孔,以酶浓度[E](U/mL)为横坐标,反应初速度ν(ΔOD/min)为纵坐标作图,利用图的特征推断酶的结合方式。藜麦麸皮总皂苷提取物对α-葡萄糖苷酶的抑制类型由Linewaver-Burk方法确定[14]。配制不同浓度的藜麦麸皮总皂苷提取物,与浓度分别为0.125、0.25、0.5、1.0、2.5 mmol/L的底物溶液,混匀,加入1 U/mLα-葡萄糖苷酶溶液,测定α-葡萄糖苷酶抑制的反应速率V。按Lineweave-Burk方程,以底物浓度的倒数1/[S]为横坐标,1/V为纵坐标绘制抑制作用动力学曲线,确定抑制类型。
1.3.5 统计分析

2 结果与讨论
2.1 单因素实验
2.1.1 液料比对提取得率的影响
改变液料比,而其他参数不变,探讨液料比对藜麦麸皮总皂苷提取得率的影响。结果如图1A所示。从图中可以看出,在液料比为15 mL/g时总皂苷的提取得率达到最高。因此,选择液料比为5、15、25 mL/g为响应面设计的三个水平。
2.1.2 乙醇浓度对提取得率的影响
改变乙醇浓度,而其他参数不变,探讨乙醇浓度对藜麦麸皮总皂苷提取得率的影响。结果如图1B所示。从图中可以看出,在乙醇浓度为80%时总皂苷的提取得率达到最高,而后随着乙醇浓度的增加总皂苷提取得率有所降低。因此,选择乙醇浓度为60%、80%、100%为响应面设计的三个水平。
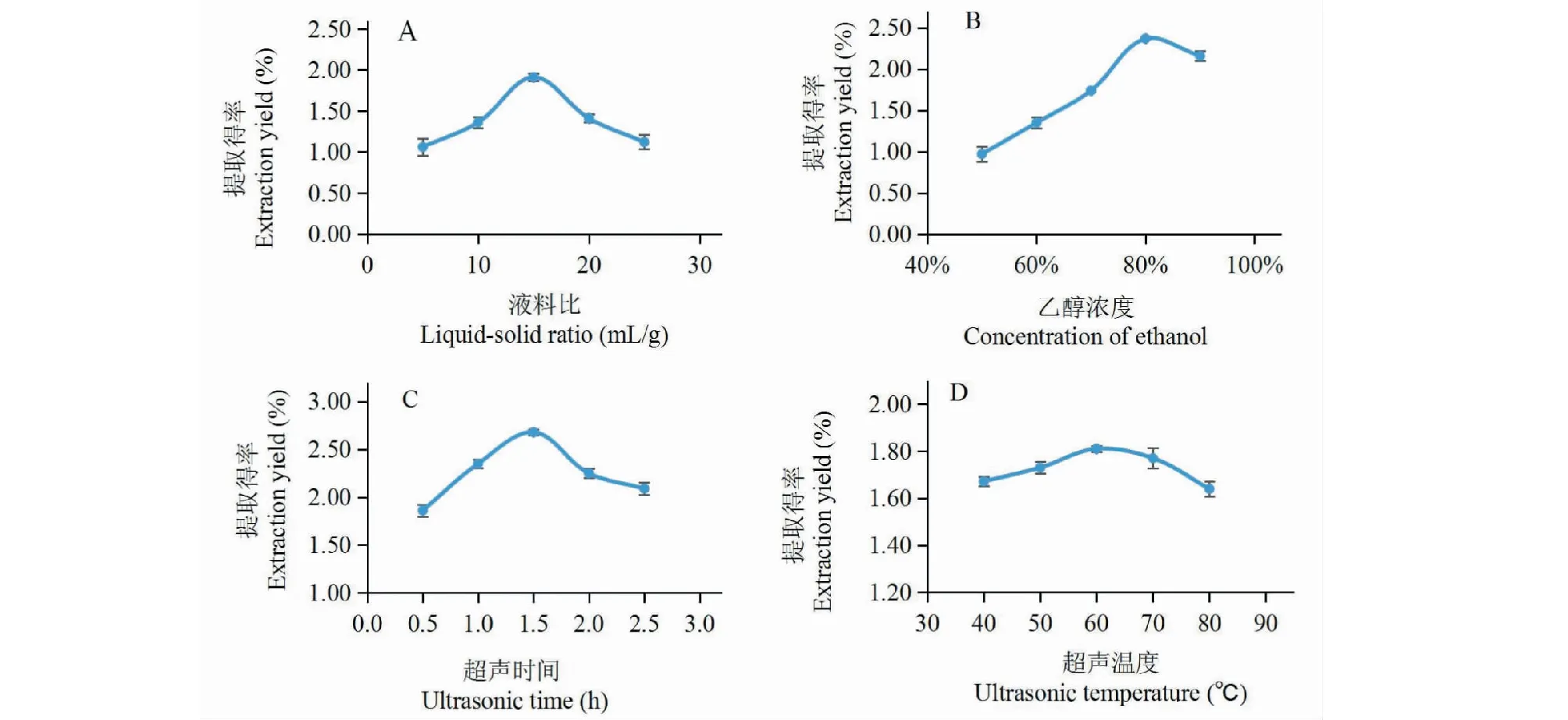
图1 液料比(A)、乙醇浓度(B)、超声时间(C)、超声温度(D)对藜麦麸皮皂苷提取得率的影响Fig.1 Effects of liquid-solid ratio (A),concentration of ethanol (B),ultrasonic time (C),ultrasonic temperature (D) on saponin extraction yield of quinoa bran
2.1.3 超声时间对提取得率的影响
改变超声时间,而其他参数不变,从而探讨超声时间对藜麦麸皮总皂苷提取得率的影响。结果如图1C所示。从图中可以看出,在超声时间为1.5 h时总皂苷的提取得率达到最高,而后随着超声时间的增加总皂苷提取得率有所降低。因此,超声时间为1.0、1.5、2.0 h为响应面设计的三个水平。
2.1.4 超声温度对提取得率的影响
改变超声温度,而其他参数不变,从而探讨超声温度对藜麦麸皮总皂苷提取得率的影响。结果如图1D所示。从图中可以看出,在超声温度为60 ℃时总皂苷的提取得率达到最高,而后随着超声温度的增加总皂苷提取得率逐渐降低。因此,超声温度为40、60、80 ℃为响应面设计的三个水平。
2.2 响应面实验结果与分析
根据单因素实验结果,响应面实验因素水平及编码如表1所示,以总皂苷提取得率为响应值(Y),响应面设计方案及结果如表2所示。

表1 响应面分析因素及水平表
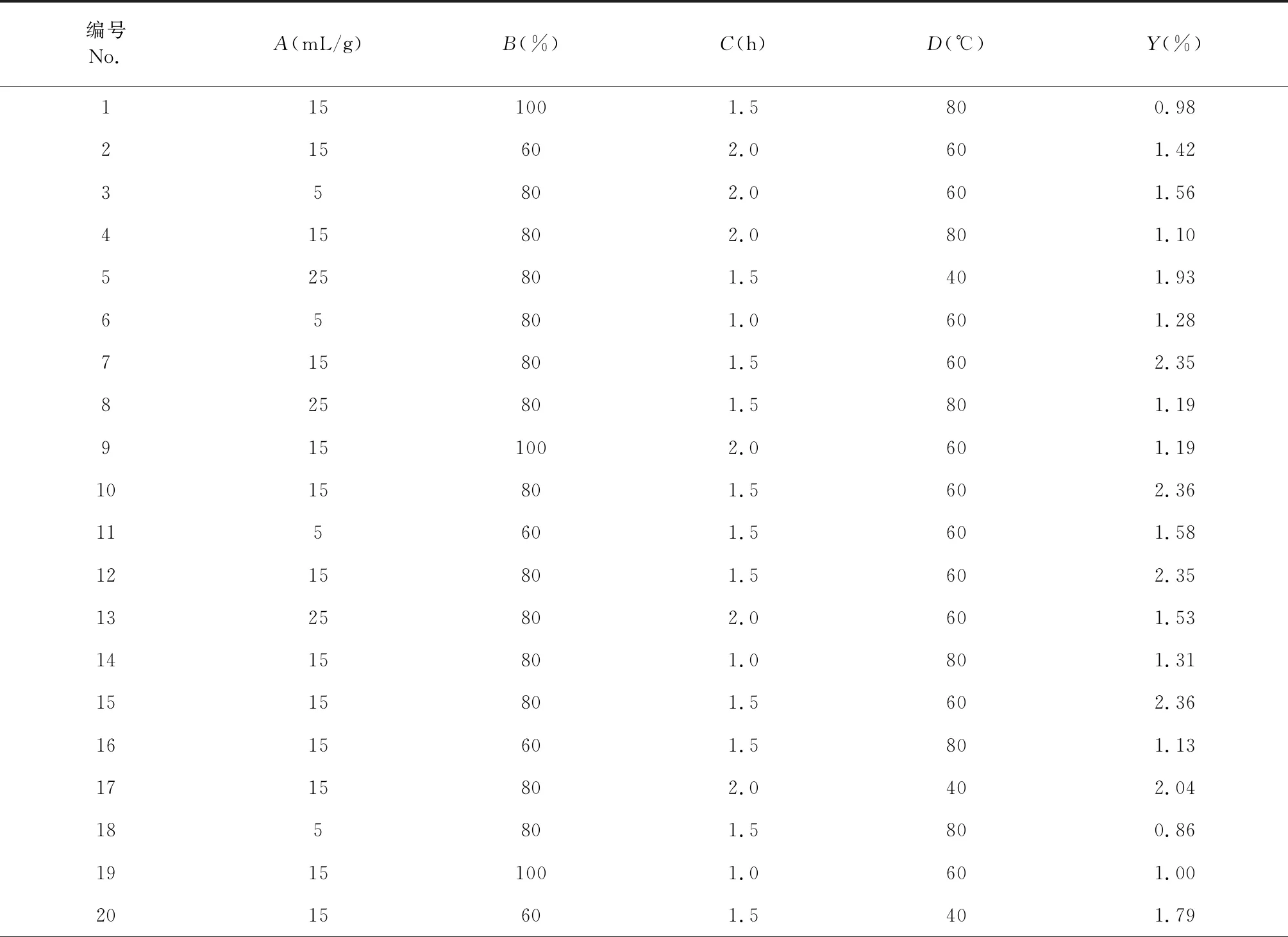
表2 Box-Behnken实验设计与结果
利用Design Expert 8.0.6 软件对表2实验数据进行回归分析,获得响应面方差分析及显著性结果如表3所示。

表3 响应面方差分析
因素交互作用对藜麦麸皮总皂苷提取得率的影响见图2。以藜麦麸皮总皂苷提取得率为响应值(Y),得到总皂苷提取量对各影响因素的二次多项式回归模型为:Y=2.20+0.071×A-0.14×B+0.094×C-0.38×D-0.060×AB+0.010×AC+ 0.072×AD-0.080×BC+0.027×BD-0.062×CD-0.33×A2-0.51×B2-0.44×C2-0.29×D2。
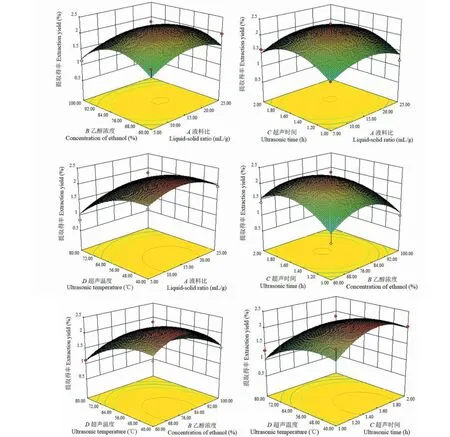
图2 因素交互作用对藜麦麸皮总皂苷提取得率的影响Fig.2 Factors interaction effects on total saponins extraction yield from quinoa bran
经统计学分析可知,该实验选用的模型极显著(P<0.01),表明模型选择合适;失拟项P>0.05,说明该模型拟合度好。根据表3显示,在此实验设计中,超声温度(D)对藜麦麸皮总皂苷提取得率的影响达到了极显著水平(P< 0.01)。从显著性检验P值的大小可以得到各因素对藜麦麸皮总皂苷提取得率影响的顺序为超声温度(D)> 乙醇浓度(B)> 超声时间(C)>液料比(A)。
通过回归模型求解方程,得到最佳的提取条件为:液料比15.52 mL/g,76.62%乙醇超声提取,超声时间1.59 h,超声温度46.46 ℃。结合到实际操作的局限性,对该条件进一步的完善,即液料比15 mL/g,75%乙醇超声提取,超声时间1.5 h,超声温度45 ℃。经过3次重复性实验验证,得到总皂苷提取得率为2.37% ± 0.022%,与预测值2.35%的相对误差为0.85%,说明实际结果与预测值比较差异性较小,表明此响应面法得到的回归模型具有较好的可靠性。
2.3 藜麦麸皮提取物对α-葡萄糖苷酶的抑制作用
采用优化后的提取工艺得到的藜麦麸皮总皂苷提取物,对α-葡萄糖苷酶抑制作用结果见图3。实验结果表明,总皂苷提取物的抑制作用明显强于阳性药阿卡波糖(P< 0.05),其IC50值分别为0.620 ± 0.057 mg/mL和0.851 ± 0.053 mg/mL。推测藜麦麸皮中皂苷类化合物可能是其发挥酶抑制作用的主要活性成分。已有研究表明藜麦麸皮中的黄酮和酚类物质具有抑制糖苷酶作用[15]。而藜麦麸皮中皂苷类物质对葡萄糖苷酶的抑制作用未见文献报道,有望从其中分离得到安全、有效的α-葡萄糖苷酶抑制剂。
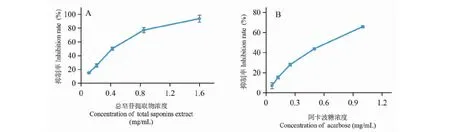
图3 总皂苷提取物(A)和阿卡波糖(B)对α-葡萄糖苷酶抑制作用Fig.3 Inhibitory effect of total saponins extract (A) and acarbose (B) on the activity of α-glucosidase
2.4 藜麦麸皮总皂苷提取物对α-葡萄糖苷酶的抑制机制分析
在不同提取物浓度的存在下,改变酶的浓度,通过剩余酶活力对不同浓度的酶作图得到一组直线(图4)。所有的直线有很好的线性关系,且都经过原点。另外,随着提取物浓度的增加,直线的斜率在减小,说明藜麦麸皮提取物浓度的存在,没有改变酶的数量,而是降低了酶的活性。因此,藜麦麸皮总皂苷提取物对α-葡糖糖苷酶的抑制作用是可逆的。

图4 藜麦麸皮总皂苷提取物酶浓度与反应初速率图Fig.4 Relationship between enzyme concentration and initial reaction velocity of total saponins extract from quinoa bran
2.5 藜麦麸皮总皂苷提取物对α-葡萄糖苷酶的抑制动力学研究
为了评估总皂苷提取物对α-葡萄糖苷酶的抑制机制,进行了酶动力学研究。按 Lineweaver-Burk双倒曲线作图法,分别作出藜麦麸皮总皂苷提取物和阿卡波糖酶抑制动力学曲线,确定抑制类型和抑制常数。如图5和6所示,结果显示总皂苷提取物浓度越大,直线斜率越大,而所有直线相交于第一象限,说明藜麦麸皮总皂苷提取物对α-葡萄糖苷酶的抑制作用属于混合竞争性抑制。而阿卡波糖所有直线与Y轴几乎相交于一点,说明阿卡波糖对α-葡萄糖苷酶属于竞争性抑制,这与文献报道一致[13]。
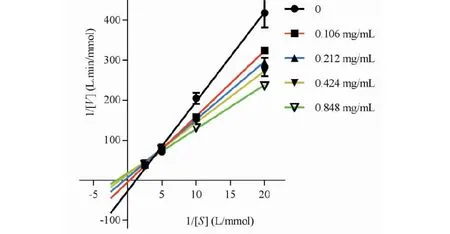
图5 藜麦麸皮总皂苷提取物的Lineweaver-Burk双倒曲线Fig.5 Lineweaver-Burk plot of total saponins extract from quinoa bran

图6 阿卡波糖Lineweaver-Burk双倒曲线Fig.6 Lineweaver-Burk plot of acarbose
3 结论
本文采用响应面法优化了藜麦麸皮超声提取皂苷的最佳工艺为液料比15 mL/g,75%乙醇超声提取,超声时间1.5 h,超声温度45 ℃,得到总皂苷提取得率为2.370% ± 0.022%。该工艺条件简单,操作控制容易,稳定性好,克服了常规方法提取时间长需要加热处理操作步骤繁琐等缺点。
α-葡萄糖苷酶抑制活性实验表明,藜麦麸皮总皂苷提取物抑制活性明显强于市售α-葡萄糖苷酶抑制剂阿卡波糖(P< 0.05) ,有望从其中分离得到安全、有效的α-葡萄糖苷酶抑制剂。抑制机制和酶动力学研究表明,藜麦麸皮总皂苷提取物是一种可逆的混合性抑制类型,这为明确藜麦麸皮提取物的降低餐后血糖作用机制提供了参考,为其高值化利用提供数据基础和技术支撑。此外,藜麦麸皮对α-葡萄糖苷酶抑制作用的活性物质基础以及体内活性等可以通过分离制备和相关的动物模型的建立来进一步研究。
