微RNA-130a靶向人类RUNT相关转录因子3对肺癌A549细胞增殖和转移的影响
2021-07-07徐汉桥方军张梁
徐汉桥,方军,张梁
肺癌是一个多基因共同调控的复杂事件,尽管围绕肺癌机制的研究取得了部分进展,但临床治疗肺癌的药物效果并不理想,因此寻找新的有效的治疗靶点一直是包括肺癌在内的肿瘤研究的热点。我们采用生物信息学软件预测发现,微RNA(miR)-130a与人类RUNT相关转录因子3(RUNX3)3’非翻译区(UTR)存在互补的核苷酸序列,猜测miR-130a可能通过靶向调控RUNX3介导非小细胞肺癌的发生发展。为了验证上述猜测,本研究于2018年2月至2019年5月以肺癌A549细胞为研究对象,通过观察miR-130a与RUNX3的靶向关系以及其对A549细胞增殖、侵袭、迁移和上皮间质转化的影响,旨在阐明miR-130a在肺癌发生中的作用,以期为以miR-130a为靶点的肺癌治疗提供新的参考依据。
1 材料与方法
1.1 材料
非小细胞肺癌细胞株A549(中科院上海细胞库),胰蛋白酶、3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴盐(MTT)试剂和青链霉双抗(美国Sigma公司)。兔抗人上皮型钙黏蛋白(E-cadherin)、神经型钙黏蛋白(N-cadherin)和波形蛋白(Vimentin)多克隆抗体(英国Abcam公司),辣根过氧化酶标记的二抗(北京中杉金桥生物公司),DMEM培养基、胎牛血清和Transwell小室(美国Hyclone公司),Matrigel基质胶(美国BD公司),miR-130a mimics、miR-130a inhibitor及其对照和RUNX3-siRNA及对照NC-siRNA(上海吉玛公司)。转染试剂脂质体2000、青链霉素(美国Invitrogen公司),鼠抗人RUNX3单克隆抗体和β-actin多克隆抗体(美国Santa Cruz公司),聚偏二氟乙烯膜(PVDF膜)(瑞典Amersham公司),脱脂奶粉(北京鼎国生物公司),Trizol试剂、逆转录试剂盒、逆转录PCR(RT-PCR)试剂盒和PCR扩增相关试剂(大连TaKaRa公司),BCA蛋白定量试剂盒、荧光素酶报告基因检测试剂盒和十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)凝胶配制试剂盒(上海碧云天公司),总蛋白提取试剂盒和ECL试剂盒(上海凯基生物公司)。二氧化碳细胞培养箱(美国Formascientific公司),荧光倒置显微镜(日本Nikon公司),荧光定量PCR仪(澳大利亚Corbett公司),凝胶成像系统(美国Bio-Rad公司)。1.2 方法
1.2.1 A549细胞培养、实验分组与转染
以DMEM培养基(含100 mL/L胎牛血清+100 kU/L青链霉双抗)于5%二氧化碳、95%相对湿度和37℃的细胞培养箱中常规培养A549细胞。将对数生长期的A549细胞以10个/孔的密度接种至6孔细胞板上,常规培养过夜。实验分为对照组(未处理)、anti-miR-NC组(转染miR-130 inhibitor阴性对照)、anti-miR-130a组(转染miR-130a inhibitor)、anti-miR-130a+siNC组(转染miR-130a inhibitor和NC-siRNA)和anti-miR-130a+siRUNX3(转染miR-130a inhibitor和RUNX3-siRNA)。待细胞汇合度高于75%时,根据实验分组并参照脂质体2000说明书步骤将miRNAs和siRNAs转染至相应的A549细胞中。转染48 h后,收集各组细胞分别用于miR-130a、RUNX3 mRNA和蛋白表达以及细胞增殖、侵袭、上皮间质转化的检测。1.2.2 实时荧光定量PCR检测A549细胞中miR-130a和RUNX3 mRNA的表达
以Trizol法提取A549细胞的总RNA,并将RNA逆转录合成互补DNA(cDNA)。以cDNA为模板,配制20μLPCR反应体系(2μL cDNA、各0.8μL正反向引物、10μLSYBRPreix EXTaqⅡ、0.4μLROXReference Dye和6μL双蒸水),设定PCR扩增条件为95℃预变性20 s、(95℃变性15 s、58℃退火30s、72℃延伸30s)循环38次,以U6和β-肌动蛋白(β-actin)作为内参基因,2法计算A549细胞中miR-130a和RUNX3mRNA的相对表达量。miR-130a引物(正向:5’-TTCACATTGTGCTACTGTCTGC-3’,反向:5’-GCTCTGACTTTATTGCACTACT-3’)、U6引物(正向:5’-CTCGCTTCGGCAGCACA-3’,反 向:5’-AACGCTTCACGAATTTGCGT-3’)、RUNX3引物(正向:5’-CAGTGGGCGAGGGAAGAGT-3’,反向:5’-CGGGAGGTAGGTATGGTAA-3’)和β-actin引物(正向:5’-GGCGGCAACACCATGTACCCT-3’,反向:5’-AGGGGCCGGACTCGTCATACT-3’)是由上海吉玛公司合成。1.2.3 蛋白质印迹法(Western Blot)检测A549细胞中RUNX3蛋白和上皮间质转化相关蛋白E-cadherin、N-cadherin和Vimentin蛋白的表达
参照总蛋白提取试剂盒抽提A549细胞的总蛋白,并采用BCA法检测总蛋白的浓度与纯度。将蛋白样品与上样缓冲液(2×)等体积混合煮沸5 min。参照SDSPAGE试剂盒配制SDS-PAGE凝胶,以每孔80μg行电泳分离。转至PVDF膜后,浸泡于含5%脱脂奶粉的封闭液中室温封闭2 h。加入一抗(RUNX3 1∶500、E-cadherin 1∶1 000、N-cadherin 1∶1 000和Vimentin 1∶1 000)于4℃下与目的蛋白特性性结合24 h。封闭液洗膜5分钟/次,共3次。再加入二抗(1∶2 000)室温下孵育1 h。参照ECL试剂盒显影曝光后,以β-actin为内参,凝胶成像系统扫描分析。实验重复3次。1.2.4 四甲基偶氮唑盐微量酶反应比色法(MTT法)检测A549细胞存活率
将转染后的各组A549细胞按照10个/孔的密度接种于96孔细胞板上。每个处理设5个平行孔,并设置一组不含细胞的培养基作为空白组。常规培养48 h后,给予20μLMTT试剂(5 g/L)作用细胞,4 h后以100μL二甲基亚砜溶解紫色结晶。选取检测波长为570 nm,酶标仪测定各组细胞吸光度OD值,并计算出各组细胞的存活率。计算公式:细胞存活率(%)=(实验组OD值-空白组OD值)/(对照组OD值-空白组OD值)×100%。实验重复3次。1.2.5 平板克隆形成实验检测A549细胞的克隆形成能力
取12孔细胞板,将转染后的各组A549细胞按照10个/孔的密度进行铺板,常规培养2周左右(每隔3 d换液)。当形成肉眼可见克隆时,取出培养板弃上清液。先以磷酸缓冲液洗涤细胞后,分别采用4%多聚甲醛和0.5%结晶紫对A549细胞进行固定与染色。染色结束后,洗涤风干,置于显微镜下统计有效克隆数(超过50个细胞的集落),并计算各组细胞的克隆形成率。计算公式:克隆形成率(%)=(有效克隆数/接种细胞数)×100%。实验重复3次。1.2.6 Transwell小室检测A549细胞的侵袭和迁移能力
采用无血清培养基调整转染后的各组A549细胞浓度,使其每毫升含有10个细胞。将以Matrigel胶包被或不包被的Transwell小室放于12孔细胞板中,下室中加入含血清的培养基500μL,上室中加入细胞液200μL。常规培养24 h后,取出小室。使用棉签小心除去上室内的细胞,并以4%多聚甲醛固定和0.5%结晶紫对下层细胞进行固定与染色。冲洗晾干后,置于倒置显微镜下观察(随机选取5个视野)侵袭细胞数或迁移细胞数。实验重复3次。1.2.7 荧光素酶实验检测miR-130a和RUNX3的靶向关系
采用生物信息学软件预测miR-130a与RUNX3 3’UTR存在互补的核苷酸序列,构建突变型(RUNX3-MUT)和野生型(RUNX3-WT)的RUNX3 3’UTR荧光素酶载体,参照脂质体2000行miR-NC(miR-130a mimics阴性对照)+RUNX3-WT、miR-130a(miR-130a mimics)+RUNX3-WT、miR-NC+RUNX3-MUT、miR-130a+RUNX3-MUT四组共转染。转染48 h后,参照荧光素酶活性检测试剂盒检测各组细胞的荧光素酶活性。实验重复3次。
2 结果
2.1 RUNX3是miR-130a的潜在靶基因
采用生物信息学软件TargetScan预测结果(表1)显示,miR-130a与RUNX3 3’UTR存在互补的结合位点。进一步采用荧光素酶实验检测显示,四组差异有统计学意义(F
=75.960,P
<0.001),与miR-NC+RUNX3-WT组(1.01±0.07)相比,miR-130a+RUNX3-WT组(0.42±0.04)细胞的荧光素酶活性显著下降(t
=12.675,P
<0.05),而miR-NC+RUNX3-MUT组(0.98±0.05)和miR-130a+RUNX3-MUT组(0.96±0.06)之间细胞的荧光素酶活性差异无统计学意义(t
=0.444,P=
0.680)。
表1 微RNA(miR)-130a与人类RUNT相关转录因子3(RUNX3)3’UTR的结合位点
2.2 转染miR-130a inhibitor和RUNX3-siRNA使A549细胞中miR-130a和RUNX3表达的表达降低
与对照组相比,转染miR-130a inhibitor可成功下调A549细胞中miR-130a的表达水平,而上调RUNX3 mRNA和蛋白的表达(P
<0.05);与anti-miR-130a组相比,转染RUNX3-siRNA可使A549细胞中RUNX3 mRNA和蛋白的表达水平明显降低(P
<0.05)。见图1和表2。
表2 各组细胞中微RNA(miR)-130a以及人类RUNT相关转录因子3(RUNX3)mRNA和蛋白相对表达量的比较/±s

图1 蛋白质印迹法检测人类RUNT相关转录因子3(RUNX3)蛋白表达的影响
2.3 下调miR-130a通过靶向RUNX3抑制A549细胞增殖
与对照组相比,下调miR-130a可抑制A549细胞增殖和克隆形成能力(P
<0.05);与anti-miR-130a相比,靶向干扰RUNX3的表达可逆转miR-130a对A549细胞增殖的抑制作用(P
<0.05)。见表3。
表3 各组非小细胞肺癌A549细胞存活率和克隆形成率的比较/±s
2.4 下调miR-130a通过靶向RUNX3抑制A549细胞侵袭和迁移
与对照组相比,下调miR-130a表达可抑制A549细胞的侵袭和迁移能力(P
<0.05);与anti-miR-130a相比,下调靶基因RUNX3的表达可逆转miR-130a的上述作用(P
<0.05)。见图2、表4。
表4 miR-451过表达对非小细胞肺癌A549细胞侵袭和迁移的影响/±s
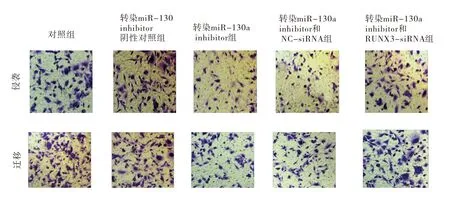
图2 Transwell小室检测各组细胞的侵袭和迁移(0.5%结晶紫染色×200)
2.5 下调miR-130a通过靶向RUNX3抑制A549细胞上皮间质转化
与对照组相比,下调miR-130a的表达可抑制N-cadherin和Vimentin蛋白的表达,而促进E-cadherin蛋白的表达(P
<0.05);与anti-miR-130a相比,干扰RUNX3的表达可逆转miR-130a对N-cadherin、E-cadherin和Vimentin蛋白的调控作用(P
<0.05)。见图3、表5。
图3 蛋白质印迹法检测非小细胞肺癌A549细胞中上皮型钙黏蛋白(E-cadherin)、神经型钙黏蛋白(N-cadherin)和波形蛋白(Vimentin)的表达

表5 各组非小细胞肺癌A549细胞中上皮型钙黏蛋白(E-cadherin)、神经型钙黏蛋白(N-cadherin)和波形蛋白(Vimentin)相对表达量的比较/±s
3 讨论
既往研究表明,微小RNA(miRNAs)可通过靶向相关靶基因调控细胞增殖、侵袭、迁移和凋亡等过程在肺癌发生及发展中扮演着癌基因和抑癌基因的角色。miR-130a是miR-130家族成员,被证实在白血病、鼻咽癌和结肠癌等肿瘤中异常表达,通过多种途径影响肿瘤细胞增殖、转移和耐药等,作为致癌或抑癌因子参与肿瘤的发生发展。Chen X等在三阴性乳腺癌组织中发现miR-130a表达下调,miR-130a过表达可通过靶向调控与癌症的侵袭和转移有关FOSL1的表达,抑制肿瘤细胞的迁移和侵袭。Wang等指出,miR-130a在胃癌组织中表达下降,且与病人总生存期缩短有关;上调其表达可靶向调控TBL1XR1体外抑制癌细胞迁移、侵袭和上皮间质转化,体内抑制成瘤和肺转移。除了在乳腺癌和胃癌中发挥着抑癌基因的作用外,miR-130a还在部分肿瘤中异常高表达,发挥着致癌基因的作用。例如:Chen J等在骨肉瘤研究中证实miR-130a表达上调,与骨肉瘤转移有关;并证实miR-130a可通过靶向调控PTEN在骨肉瘤细胞迁移、侵袭和上皮间质转化过程中发挥着重要的促进作用。许旭东等研究发现,miR-130a在口腔肿瘤组织中高表达,其过表达可通过抑制PJA1促进肿瘤细胞的增殖和迁移。
尽管张海涛等研究证实miR-130a在肺癌组织中高表达,与肿瘤大小、淋巴结转移和临床分期有关,可通过下调Smad4在肺癌细胞恶性增殖过程中发挥着促进作用,但其对细胞增殖和转移的分子机制并不完全清楚。RUNX3是RUNT家族成员,可通过调控生长信号途径如TGF-β等影响细胞增殖、凋亡、侵袭和迁移等过程,在结肠直肠癌、胃癌和喉癌等肿瘤的进展中发挥着重要作用。已有研究证实,RUNX3在非小细胞肺癌中低表达,而敲除其表达可显著挽救了miR-661表达不足对肺癌细胞增殖和侵袭的抑制作用。
本研究通过生物信息学软件预测到miR-130a与RUNX3 3’UTR区域存在互补的结合位点,猜测miR-130a可能通过靶向调控RUNX3的表达参与肺癌的发生发展。为了验证上述猜测本研究采用荧光素酶实验证实RUNX3是miR-130a的潜在靶基因。同时成功下调miR-130a表达后发现,肺癌A549细胞增殖、侵袭、迁移和上皮间质转化过程均明显受到抑制;同时转染RUNX3-siRNA干扰RUNX3表达后发现,RUNX3的表达下降逆转了miR-130a低表达对A549细胞增殖、侵袭、迁移和上皮间质转化的抑制作用。该结果首次证实了RUNX3是miR-130a的靶基因,miR-130a低表达可通过靶向调控RUNX3表达抑制A549细胞增殖、侵袭、迁移和上皮间质转化。提示,miR-130a靶向调控RUNX3表达介导的细胞增殖和转移是肺癌恶性发展的重要机制,该结果为肺癌的发生发展机制和治疗提供了新线索。
综上所述,RUNX3是miR-130a的潜在靶基因,下调miR-130a可通过靶向调控RUNX3表达抑制肺癌A549细胞增殖、侵袭、迁移和上皮间质转化。
