间充质干细胞外泌体对心力衰竭大鼠心肌细胞的影响及机制
2021-07-06班努库肯巴音斯勒玛木胡牙提乌拉斯汗刘兆平
班努·库肯 巴·巴音斯勒玛 木胡牙提·乌拉斯汗 刘兆平
(新疆医科大学 1第二附属医院心内科,新疆 乌鲁木齐 830063;2第五附属医院心内科;3第一附属医院心内科;4北京大学第一医院心内科)
心力衰竭(心衰)是指心脏的泵血功能不能随着机体需求的增加而增加,使得血液循环不能满足机体生理需求的病理过程〔1〕。心衰是所有心血管疾病的最终归宿〔2〕,也是心血管疾病患者死亡的主要原因,临床上治疗心衰的药物有许多种,但是对于心衰晚期仍然缺少有效的治疗药物,因此,寻找有效的创新药物或者治疗靶点对于心衰的治疗至关重要。外泌体是一类由活细胞分泌的粒径在30~150 nm的纳米级囊泡〔3〕,内含DNA、RNA、脂质、蛋白质等生物活性物质〔4〕,可作为细胞间信息传递的载体〔5〕。其中,间充质干细胞来源的外泌体已经被报道对多种疾病的发展均有治疗作用〔6,7〕,包括治疗心肌梗死等心血管疾病〔8,9〕,但是其对心衰的影响及机制未有明确的报道。本研究探究了间充质干细胞外泌体对心衰大鼠心肌细胞的影响及机制。
1 材料与方法
1.1材料 健康清洁级SD大鼠30只(新疆医科大学);CCK8试剂盒(沈阳万类生物技术有限公司);细胞凋亡检测试剂盒(南京凯基生物技术有限公司);含半胱氨酸的天冬氨酸蛋白水解酶(Caspase)-9、B细胞淋巴瘤(Bcl)-2、GAPDH抗体,山羊抗鼠二抗(武汉三鹰生物技术有限公司);电泳仪(南京大学仪器厂);微型垂直电泳槽(上海天能科技有限公司);凝胶成像仪(美国Bio-Rad公司)。牛血清白蛋白(BSA),聚偏二氟乙烯(PVDF)膜,增强化学发光剂(ECL),磷脂结合蛋白V-异硫氰酸荧光素(Annexin V-FITC)试剂盒(沈阳万类生物技术有限公司)。
1.2间充质干细胞的分离、培养与鉴定 将3周龄SD雌性大鼠颈椎脱臼处死,解剖取股骨和胫骨,并剪去两端,露出骨髓腔,使用含10%的胎牛血清的培养液,冲洗骨髓腔,反复2次,打散细胞悬液后,使用70 μm细胞筛过滤,去除细胞团块。用相对密度1.077的淋巴细胞分离液稀释,2 000 r/min,离心30 min,收集单核细胞界面层,然后1 000 r/min,离心10 min,弃上清后,使用原代细胞培养液重悬细胞,细胞悬液接种于100 mm2细胞培养皿中,在37℃,5%的CO2培养箱中培养48 h,除去未贴壁的细胞,每隔2 d换液或者传代。
采用流式细胞仪鉴定间充质干细胞,具体步骤为:消化并调整细胞密度为1×106/ml,取100 μl的细胞悬液于流式管中,分别加入待测抗体CD29、CD90、CD11B、CD45,并设置相应的同型抗体对照组,4℃避光孵育30 min,清洗2次后,除去上清,0.5 ml固定液重悬,进行流式细胞仪检测,间充质干细胞应表达CD29和 CD90,而不表达CD11B和CD45。
1.3间充质外泌体的提取 使用含10%的无外泌体胎牛血清的培养基培养间充质干细胞48 h,收集细胞培养上清,采用差速离心法提取间充质干细胞外泌体,具体步骤为:将所收集的细胞上清分装到10 ml的离心管中,首先3 000 r/min,4℃离心15 min,去除死细胞;然后6 000 r/min离心40 min,去除细胞碎片;10 000 r/min离心1 h,取上清;100 000 r/min离心1 h,收集沉淀即为外泌体,用400 μl磷酸盐缓冲液(PBS)重悬外泌体,并放在-80℃保存。
1.4间充质干细胞外泌体的鉴定 采用透射电镜观察外泌体的形态结构,具体步骤为:取100 μl外泌体加入50 μl的放射免疫沉淀(RIPA)蛋白裂解液,于冰上裂解30 min,12 000 r/min,离心15 min后,取上清,即为外泌体总蛋白。采用二喹啉甲酸(BCA)蛋白定量试剂盒进行蛋白定量,并稀释外泌体至蛋白浓度为0.5 mg/ml。将透射电镜所用的铜网平放到称量纸上,滴加20 μl上述外泌体溶液,于红外灯下烘烤10 min;烘干后再滴加2滴磷钨酸,继续烘烤10 min,吸走多余液体,于投射电镜下观察外泌体结构。
Western印迹检测外泌体表面生物标志物CD9、CD63、TSG101,具体步骤为:取外泌体蛋白裂解液进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE),经转膜,封闭后CD9、CD63、TSG101一抗孵育过夜,然后二抗孵育,洗膜后,曝光成像。
1.5心衰大鼠造模 30只SD大鼠适应性饲养1 w后,随机分为假手术组和心衰组,心衰组大鼠进行左冠状动脉前降支结扎术,方法如下:腹腔注射水合氯醛麻醉大鼠,备皮,局部消毒,先用10号缝线在开胸部位做一荷包,迅速开胸暴露心脏,模型组用0号线结扎左冠状动脉前降支,假手术组仅穿线不结扎。术后迅速收拢荷包关闭胸腔,手术部位涂敷0.2%呋喃西林软膏,并常规给予腹腔注射青霉素(200 000 U/kg)7 d。术后4 w模型组存活大鼠麻醉后于左胸上至锁骨下至肋骨下缘处备皮,对大鼠射血分数(EF)进行检测;通过RM-6000型八通道生理记录仪进行血流动力学检测,记录左心室收缩期末压(LVESP),左心室舒张期末压(LVEDP)及左室内压最大上升/下降速率(±dp/dtmax)。
1.6大鼠心肌细胞的分离与培养 取假手术和心衰组大鼠,麻醉后迅速解剖取心脏,用提前预冷的KH液清洗心脏,使用Langendroff 灌流装置,先后用KH 液、低钙液、酶液灌流,然后将心肌组织均匀的剪成碎片,震荡,过滤,用KH液(Ca)冲洗两次复钙,然后用含有10%胎牛血清的M199培养基培养。
1.7CCK8检测细胞增殖 取假手术组大鼠的心肌细胞和心衰组大鼠的心肌细胞于6孔板中培养,假手术组大鼠的心肌细胞作为对照组,心衰组大鼠心肌细胞分为两组:模型组和外泌体组,外泌体组心肌细胞用2 μg外泌体共孵育24 h,而模型组和对照组分别与等体积的PBS共孵育,共孵育后消化并稀释细胞至50 000个/ml,将上述细胞接种至96孔板,每孔100 μl,每组三个复孔,并将细胞培养2~4 h,使各组心肌细胞完全贴壁,然后每孔加入10 μl的CCK8溶液,继续37℃培养,分别于24 h、48 h、72 h用酶标仪检测各孔450 nm处的吸光度,OD值越大,细胞增殖能力越强。
1.8细胞凋亡实验 取对照组、模型组和外泌体组细胞5×105个于6孔板中,外泌体组每孔与2 μg间充质干细胞外泌体共孵育24 h,对照组和模型组用等体积的PBS共孵育24 h。孵育后,消化各组细胞,用2 ml 1×结合缓冲液重悬细胞,稀释并调整细胞密度1×106个/ml,分装细胞于离心管中,每管100 μl,每管细胞分别加入Annexin V-FITC抗体5 μl和碘化丙啶(PI)抗体5 μl,室温避光反应15 min,然后加入400 μl 1×结合缓冲液,流式进行检测。
1.9Western印迹检测Bcl-2、Caspase-9表达水平 取各组共孵育后的心肌细胞加入1 ml蛋白裂解液,冰上裂解30 min,然后12 000 r/min,离心15 min,取上清即为总蛋白,BCA蛋白定量后加入上样缓冲液,沸水浴5 min,然后进行SDS-PAGE凝胶电泳,转膜,用5%的BSA对其封闭2 h,然后以稀释后的GAPDH、Caspase-9、Bcl-2一抗4℃孵育过夜,洗膜后二抗室温孵育1.5 h,再用TBST洗膜后按照增强化学发光剂(ECL)试剂盒说明书配制发光液,并将PVDF膜浸入发光液中反应30 s,曝光并拍照,用photoshop软件曝光结果进行定量分析。
1.10统计学分析 采用SPSS19.0软件进行方差分析,LSD法。
2 结 果
2.1间充质干细胞鉴定结果 根据流式细胞仪检测结果(图1),所提取到的间充质干细胞CD29、CD90表达的阳性率分别为98%和97%,CD11B和CD45表达的阳性率分别为3.8%和2.0%,提示所提取的间充质干细胞符合实验要求,且均一性良好。

图1 流式细胞仪检测CD29、CD90、CD11B、CD45表达
2.2外泌体鉴定结果 如图2所示,透射电镜观察到采用差速离心法提取到的囊泡具有双层膜结构,“杯托”样,粒径30~150 nm,与外泌体结构一致;Western印迹结果显示,差速离心法提取到的外泌体表达生物标志物CD63、CD9、TSG101。
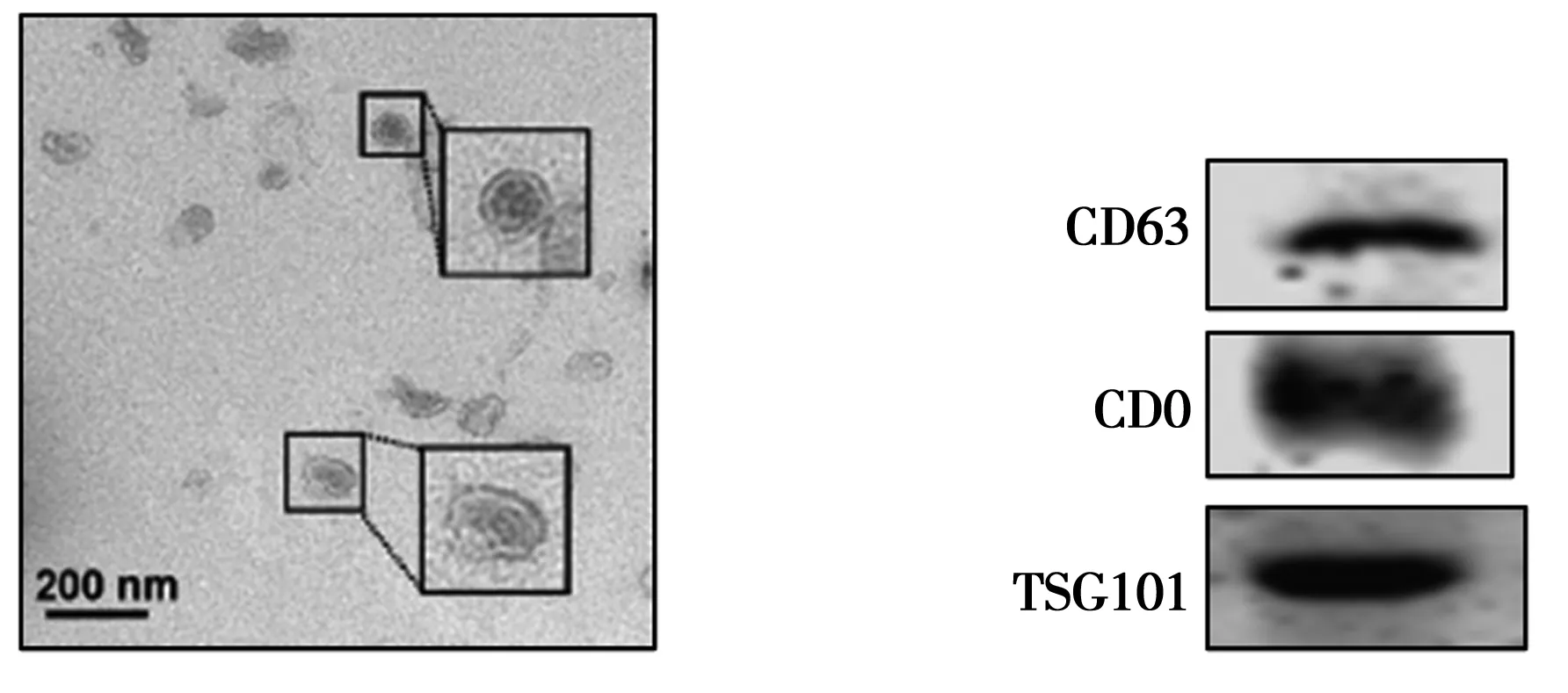
图2 外泌体鉴定结果
2.3各组大鼠血流动力学检测指标 与假手术组比较,心衰组LVESP显著降低(P<0.001),LVEDP显著升高(P<0.01),+dp/dtmax,-dp/dtmax、EF显著降低(P<0.01,P<0.001),见表1。

表1 各组造模后血流动力学检测指标比较
2.4间充质干细胞外泌体促进心衰大鼠心肌细胞增殖 模型组心肌细胞OD值显著低于对照组(P<0.05,P<0.001);外泌体组心衰大鼠心肌细胞OD值显著高于模型组(P<0.01,P<0.001)。见表2。

表2 各组心肌细胞OD值比较
2.5间充质干细胞外泌体抑制心衰大鼠心肌细胞凋亡 与对照组〔(11.33±1.53)%〕比较,模型组心肌细胞凋亡率〔(20.33±1.52)%〕显著增加(P<0.001);与模型组相比,外泌体组心肌细胞凋亡率〔(15.00±1.00)%〕显著降低(P<0.001)。见图3。

图3 流式细胞仪检测心肌细胞凋亡
2.6间充质干细胞外泌体上调Bcl-2的表达和下调Caspase-9的表达 模型组心肌细胞Bcl-2表达显著低于对照组,Caspase-9表达显著高于对照组(均P<0.001);与模型组相比,外泌体组Bcl-2表达显著增加,Caspase-9表达量显著降低(均P<0.001)。见图4,表3。

图4 Western印迹检测各组心肌细胞Bcl-2和Caspase-9的表达

表3 各组心肌细胞Bcl-2和Caspase-9表达水平比较
3 讨 论
心力衰竭是各种心血管疾病发展到中晚期的病理状态,是造成心血管患者死亡的主要原因〔10〕,流病学研究显示目前全球心衰患者的人数高达2 250万人,并仍以每年200万的速度递增〔11〕,且5年存活率与恶性肿瘤相似,且药物和手术的治疗方法并不能有效治疗心衰,所以探究新的心衰治疗方法至关重要。外泌体作为细胞间信息交流的载体,可向靶细胞传递生物信息物质,调控靶细胞的病理状态,研究表明,间充质干细胞外泌体能够携带间充质干细胞的信息物质,在间充质干细胞的旁分泌中起到重要的作用〔12〕,但间充质干细胞能否通过外泌体影响心衰的病理进程,尚无详细报道。
心衰的主要病理特征包括心肌肥厚、心肌坏死、心肌凋亡、心肌纤维化,其中心肌坏死和心肌凋亡导致心脏代偿能力丧失,最终导致心脏泵功能丧失〔13〕。本研究提示间充质干细胞或可通过抑制心肌细胞的凋亡来缓解心衰。
细胞凋亡是一种受机体调控的自杀机制,通常表现为核浓缩、起皱及DNA片段化等,Caspase家族属于半胱氨酸蛋白酶,与促凋亡信号紧密相连,一旦凋亡信号被激活,效应Caspase就会对细胞中靶蛋白的天冬氨酸残基进行切割,调控细胞的凋亡,Caspase-9是Caspase蛋白家族成员之一,主要起到中枢控制细胞凋亡的作用,通过促进细胞凋亡而影响生命进程〔14〕;本研究发现,间充质干细胞分泌的外泌体能够显著下调心衰大鼠心肌细胞中Caspase-9的表达。Bcl-2家族蛋白可以通过抑制线粒体膜的通透性来调控细胞凋亡,抗凋亡蛋白Bcl-2定位于线粒体外膜上,当其接受到凋亡信号时会抑制线粒体释放细胞色素C;细胞质的细胞色素C在dATP存在的条件下能与凋亡相关因子(Apaf)-1结合,使其形成多聚体,并促使Caspase-9与其结合形成凋亡小体,Caspase-9被激活,被激活的Caspase-9能激活其它的Caspase,从而诱导细胞凋亡〔15〕,所以Bcl-2可通过抑制线粒体释放细胞色素C来发挥其抑制凋亡的作用,Bcl-2能够抑制免疫细胞、肿瘤细胞、内皮细胞、心肌细胞的凋亡,本研究发现,间充质干细胞外泌体能够显著上调Bcl-2的表达而抑制心衰大鼠心肌细胞的凋亡。
