PELP1在二乙基亚硝胺诱导糖尿病小鼠肝癌形成中的表达及意义*
2021-07-06叶晓娟孙燕玲
叶晓娟,吴 喆,孙燕玲**
(1.武汉市江岸区妇幼保健院,湖北 武汉 430000;2.湖北科技学院糖尿病心脑血管病变湖北省重点实验室)
目前,己经明确的肝癌发生危险因素包括肝炎病毒感染、肝硬化、黄曲霉毒素暴露和非酒精性脂肪性肝炎等,但仍有15%~50%的肝癌患者无法用现有的危险因素去解释。有研究证明,随着病程的延长,糖尿病患者的肝癌发病率比非糖尿病人群显著增加[1]。流行病学调查显示,糖尿病可使包括肝癌在内的多种恶性肿瘤的发生风险增加[2]。谷氨酸-脯氨酸-亮氨酸富集蛋白1(proline-,glutamic acid-,and leucine-rich protein 1,PELP1)已被证实在多种激素依赖性肿瘤中异常表达[3],并参与多种非激素依赖性肿瘤的进展[4],但对其在肝癌发生中的作用尚未有明确阐述。本研究通过高脂饲料饲养建立糖尿病小鼠模型,并采用腹腔注射二乙基亚硝胺(diethylnitrosamine,DEN)的方式来诱导糖尿病小鼠肝癌形成,探讨PELP1在二乙基亚硝胺诱导糖尿病小鼠肝癌形成中的表达及意义,为肝癌的发生寻求新的危险因素和标志因子。
1 材料与方法
1.1 实验动物
雄性C57BL/6小鼠32只,SPF级,6~8周龄,体重20~25g,购自湖北省实验动物研究中心,动物合格证号为42000600033780。动物自由饮食进水,动物房的温度设定为22℃~26℃,12h昼夜节律。
1.2 仪器和试剂
BAS124S电子天平购自德国Sartorius公司;MDF-U53V-80℃超低温冰箱购自日本Sanyo公司;3K15德国Sigma高速冷冻离心机购自德国Sigma公司;Indiko全自动生化分析仪购自美国Thermo Scientific公司;Epoch全波长酶标仪购自美国Biotek公司;CFX Connect荧光定量PCR仪购自美国Bio-Rad公司。
高脂饲料购自美国Research Diets公司;DEN购自上海源叶生物科技有限公司;谷丙转氨酶和谷草转氨酶活性检测试剂盒购自北京索莱宝科技有限公司;总胆固醇和甘油三酯测定试剂盒购自南京建成生物工程研究所;逆转录试剂盒购自美国Promega公司;Trizol试剂盒购自美国Invitrogen公司;qPCR试剂盒购自日本Toyobo公司。
1.3 动物分组及给药方案
实验小鼠适应性饲养5d后,随机分为4组:正常对照组(Control组),糖尿病组(DM组),二乙基亚硝胺组(DEN组),糖尿病联合二乙基亚硝胺组(DM+DEN组),每组8只。分组后正常对照组和DEN组给予普通饲料饲养,DM组和DM+DEN组给予高脂饲料饲养,连续2次随机血糖≥16.7mmol/L者视为糖尿病模型建立成功。DEN组和DM+DEN组给予腹腔注射DEN,给药剂量为20mg/kg,并在饮水中添加浓度为10mg/L的DEN至12周;正常对照组和DM组腹腔注射相等体积的磷酸盐缓冲液(PBS),正常饮水。
1.4 标本采集及处理
称取各组小鼠体质量,静脉采血用于各项血清指标检测,采血完成后处死小鼠,取肝脏,观察各组小鼠肝脏的大小、颜色、质地以及结节形成状况,记录肝脏质量、肝脏癌变只数和表面癌结节数,计算肝脏指数(肝脏质量/体质量×100%)及癌变率(癌变只数/总数×100%)。
1.5 血清指标检测
从眼眶静脉中取静脉血,室温下静置1h,离心机在4℃以2000~3000rpm离心20min,吸取上清,常规制备并分装于EP管,储存于-70℃备用。通过可见分光光度法检测各组小鼠血清中谷丙转氨酶(ALT)、谷草转氨酶(AST)、甘油三酯(TG)和总胆固醇(TC)的含量。以上步骤均严格按照相关试剂盒说明书操作。
1.6 qPCR检测肝脏PELP1mRNA转录水平
提取小鼠肝脏总RNA,计算RNA浓度,按照逆转录试剂盒要求的标准条件:42℃,60min进行逆转录反应,95℃,5min进行酶灭活;所得cDNA产物保存于-70℃备用。根据GenBank中小鼠GAPDH、PELP1全序列,取其保守区,按照实时荧光定量PCR引物设计原则设计引物,引物序列由武汉擎科生物技术有限公司合成。PCR引物序列见表1。以逆转录后的cDNA为模板,按照qPCR试剂盒操作步骤进行PCR扩增。反应体系(15μL)包括:模板(cDNA)1.5μL,2×SYBR Green Realtime PCR Master Mix 7.5μL,上、下游引物(10μmol/L)各0.5μL,Nuclease-Free Water 5μL。PCR反应条件为:95℃变性30s,60℃退火30s,72℃延伸50s,共39个循环。以GAPDH为内参,使用比较Ct值法(2-△△Ct)对qPCR结果进行相对定量分析。

表1 实时荧光定量PCR引物序列
1.7 统计学方法
2 结 果
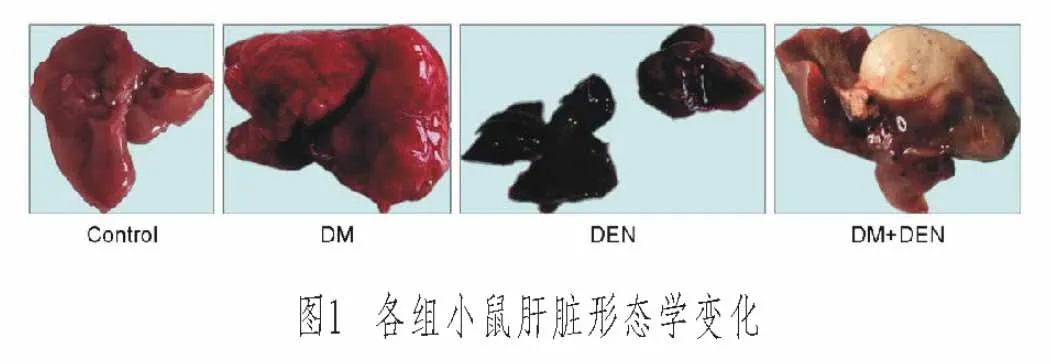
2.1 各组小鼠肝脏形态学变化
Control组小鼠肝脏形态正常,颜色鲜红,质地柔软,表面光滑无结节;DM组小鼠肝脏与正常肝脏比较颜色略深,质地不均,无其他异常表现;DEN组小鼠肝脏颜色呈深褐色,失去正常光泽,肝脏质地硬,表面粗糙,有结节;DM+DEN组小鼠肝脏颜色发黄,无光泽,肝脏质地较硬,可观察到肿瘤生长明显增多,结节数目较多且大小不一。见图1(封三)。
2.2 各组小鼠肝脏一般情况的比较
与Control组比较,DM组、DEN组和DM+DEN组小鼠肝脏指数明显升高,差异有统计学意义(P<0.05);DM+DEN组与DM、DEN组比较,小鼠肝脏指数、肝脏癌变率和肝表面癌结节数均显著升高(P<0.05)。见表2。
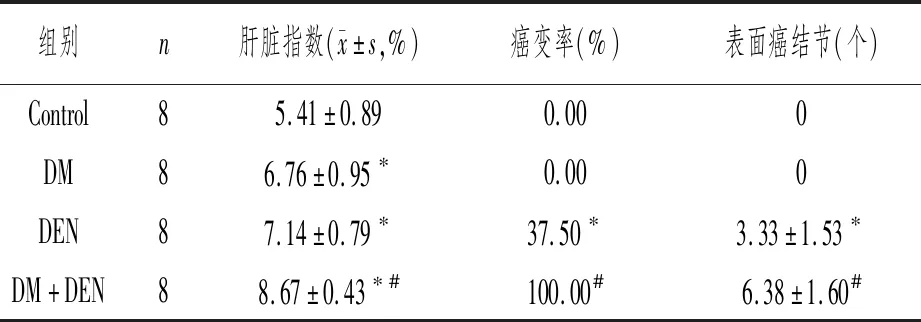
表2 各组小鼠肝脏一般资料比较
2.3 各组小鼠血清生化指标含量变化
与Control组比较,DM组、DEN组和DM+DEN组小鼠血清ALT和AST的含量明显升高,差异有统计学意义(P<0.05),且DM+DEN组较DM、DEN组小鼠血清ALT和AST含量显著升高(P<0.05);与Control组比较,DM+DEN组和DM组小鼠血清TG和TC的含量明显升高,差异有统计学意义(P<0.05),但DM+DEN组的TG和TC含量与DM组比较,差异无统计学意义。见表3。
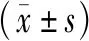
表3 各组小鼠血清生化指标水平比较
2.4 肝脏组织中PELP1 mRNA表达变化
与Control组比较,DM组PELP1 mRNA表达升高,但两组差异无统计学意义,DM+DEN组和DEN组小鼠肝脏组织中PELP1 mRNA表达较Control组显著升高(P<0.05);且DM+DEN组与DM、DEN组比较,差异有统计学意义(P<0.05),见图2。
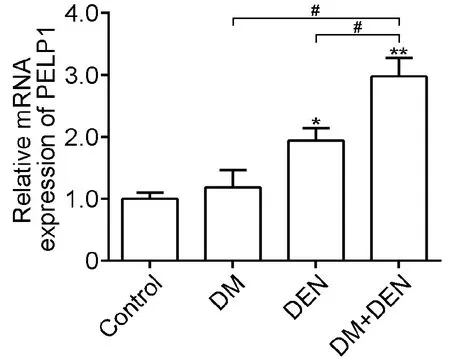
与Control组比较,*P<0.05,**P<0.01;组间比较,#P<0.05图2 qPCR检测各组小鼠脑肝脏组织PELP1 mRNA的转录水平(n=8)
3 讨 论
糖尿病是一种由多病因引起的以高血糖为特征的慢性代谢性疾病,国际糖尿病联合会报告称,全球糖尿病患者人数仍在持续增加,2017年全球18~99岁成年人中约有4.51亿罹患糖尿病,到2045年这一数字预计将增加到6.93亿[5]。糖尿病与肝病关系密切,肝脏是糖代谢的重要器官,约30%~60%的葡萄糖在肝内代谢生成糖原,肝糖原是血糖的重要来源,肝脏同时也是胰岛素重要的靶器官,糖尿病患者胰岛素传递信号受损,葡萄糖运输障碍,以致糖尿病患者的肝病发生率高[6]。糖尿病相关的慢性肝病主要为非酒精性脂肪性肝病(NAFLD)、肝硬化、急性肝衰竭和肝癌等。有研究证明[7]:糖尿病患者与非糖尿病人群相比,肝癌和其它各部位恶性肿瘤的发生风险均可增加27%。糖尿病致肝癌发病率上升的具体机制尚不清楚,其中可能涉及的因素包括:高胰岛素血症和胰岛素抵抗、高血糖、免疫功能受损、氧化和抗氧化系统失衡等[8]。
肝癌的发生是一个由多诱因参与的多步骤演进的病理过程,其发展通常经历由慢性肝损伤致肝炎、肝纤维和肝硬化,最终演变为肝癌。DEN诱发肝癌的过程与人类肝癌发生过程基本相似,早期出现肝细胞变性等中毒性反应,中期出现肝细胞再生及肝纤维化等现象,晚期则在出现结节性增生及肝硬化后演变成肝癌。采用DEN诱导原发性肝癌模型已被广泛用于研究肝癌的发生和防治肝癌药物的研究开发[9]。
本研究采用长期高脂饲料饲养建立糖尿病小鼠模型,模型小鼠连续2次随机血糖≥16.7mmol/L提示模型建立成功且稳定。实验末,DM+DEN组和DM组小鼠血清TG和TC的含量明显升高,提示高脂饲料饲养促进糖尿病形成并伴发血脂代谢紊乱。临床研究证实[10],脂代谢紊乱使进入肝脏的游离脂肪酸增加,游离的脂肪酸促进炎性因子释放,加速炎症的进展,从而最终可能导致癌变。对糖尿病小鼠腹腔注射DEN后进行观察,小鼠肝脏指数、肝脏癌变率和肝表面癌结节数均显著升高,提示DEN加重糖尿病小鼠的肝损伤,并诱导肝癌形成。
ALT和AST是检测肝脏功能的两个指标,是维持肝脏功能正常运转必不可缺的催化剂,在各种细胞都存在,但多数存在于肝细胞内。当肝细胞发生炎症、中毒或坏死的时候,细胞损伤破裂,ALT和AST释放入血,血清转氨酶升高[11]。本研究中DM组、DEN组和DM+DEN组小鼠血清ALT和AST的含量明显升高(P<0.05),且DM+DEN组较DM组和DEN组小鼠血清ALT和AST含量显著升高(P<0.05),表明糖尿病小鼠肝细胞受损,肝脏功能出现损害,而DEN进一步损伤糖尿病小鼠的肝功能。
PELP1是一种雌激素受体辅助活化因子,同时参与核受体基因组和非基因组信号转导过程,是雌激素受体非基因组作用的调节剂和雌激素受体的共调节剂[12]。研究表明,PELP1对激素依赖性肿瘤[3,13]如乳腺癌、卵巢癌、子宫内膜癌和前列腺癌的发生、发展、转移、耐药形成有重要的意义,在非激素依赖性肿瘤如脑肿瘤、肺癌、胃癌和结直肠癌的进展中也有作用[14-15]。本研究结果显示,DM+DEN组和DEN组小鼠肝脏组织中PELP1 mRNA表达较Control组显著升高(P<0.05),且DM+DEN组与DM组和DEN组比较,差异有统计学意义(P<0.05),表明DEN在诱导糖尿病小鼠肝癌形成时PELP1 mRNA表达明显上调,提示PELP1在肝癌发展中发挥重要作用。
本研究表明,糖尿病小鼠的肝细胞受损,肝脏功能出现损伤,二乙基亚硝胺使糖尿病小鼠的肝功能进一步恶化,并诱发癌变,PELP1可作为肝癌发生的标志因子,在DEN诱导糖尿病小鼠肝癌形成中起着重要作用。PELP1是一种原癌基因,可作为一种关键的雌激素受体共调节蛋白,促进肿瘤细胞的生长[4],本研究证实了PELP1在肝癌发生中的作用,但其具体的作用机制需要进一步深入的探讨,这将是我们下一步研究的方向。
