新型冠状病毒肺炎患者病情严重程度与血小板减少关系的meta分析
2021-07-06贾心予马元吴桢珍吉宁飞黄茂
贾心予 马元 吴桢珍 吉宁飞 黄茂
南京医科大学第一附属医院呼吸与危重症医学科 210029
目前,新型冠状病毒肺炎(COVID-19)疫情已蔓延至全球200多个国家和地区。截至2021年3月27日,全球累计确诊人数已超1亿2 000万,累计死亡人数超过279.4万,病死率约为2.33%。新型冠状病毒,即严重急性呼吸综合征冠状病毒2(severe acute respiratory syndrome coronavirus 2,SARS-Co V-2)是一种β属的冠状病毒,可引起非典型肺炎,是已知的第7种可感染人类的冠状病毒[1]。人群普遍易感,传染性强,传染源主要为SARS-Co V-2感染的患者。
COVID-19患者尤其是重症患者易出现凝血功能障碍,多数COVID-19患者的血小板计数处于正常范围或轻度升高,部分COVID-19患者会出现血小板减少,且重症患者和非重症患者的血小板水平存在差异。有研究表明重症患者血小板减少发生率为57.7%,非重症患者发生率为31.6%[2],死亡患者发生率达57.1%[3]。血小板减少可能为重症COVID-19患者重要的血液学改变,既往研究表明严重急性呼吸系统综合征(severe acute respiratory syndrome,SARS)患者也会出现血小板减少[4],SARS-Co V引起血小板减少主要有以下两种潜在机制:病毒通过与CD13或CD66a受体结合,直接入侵造血细胞及骨髓基质细胞引起造血抑制;也可通过生成自身抗体或免疫复合物等免疫介导造成细胞损害[5]。与SARS-Co V相似,SARS-Co V-2也通过血管紧张素转换酶2(angiotensin converting enzyme 2,ACE2)作为其受体进而感染人体引起非典型肺炎[6]。但目前COVID-19患者的血小板减少机制尚不明确,且关于重症和非重症COVID-19患者血小板水平差异的研究多为早期临床研究,仍存争议。本文通过系统评价和荟萃分析对COVID-19病情严重程度与血小板减少的关系进行综述。
1 资料与方法
1.1 数据来源与检索策略 对相关数据库进行了系统的文献检索,包括Pub Med、EMBASE以及Web of Science数据库,筛选国内外涉及新型冠状病毒肺炎的临床研究,并追溯其相关参考文献以纳入其他可能符合条件的文献。共进行了两轮检索,在第一轮检索时使用了下列关键词:“2019-nCo V”、“COVID-19”和“SARS-Co V-2”,为避免文献遗漏,并未采用“血小板”等相关关键词限制。检索时限截至2020年3月15日,检索没有语言限制。为增加文献数量,在第二轮检索时使用了以下关键词:“platelet”、“severity”、“severe”、“2019-nCo V”、“COVID-19”和“SARS-Co V-2”。检索时限截至2020年9月30日,检索语言限制为英文。
1.2 纳入与排除标准
1.2.1 纳入标准 (1)受试者COVID-19诊断明确;(2)受试者可分为重症组和非重症组;(3)可获取受试者血小板计数的相关指标。
1.2.2 排除标准 (1)重复发表文献;(2)无法获得全文且无详细摘要;(3)文献类型为社论、综述或指南等;(4)研究方法为病因研究、机制研究或动物研究等;(5)无法提取必要数据。
1.3 资料提取 由两位研究者独立筛选文献并提取资料,存在意见分歧时与第三位研究者讨论决定。资料提取内容包括第一作者姓名、研究国家、研究地区、多或单中心研究、样本数量、研究对象性别及年龄、重症的评价标准、研究设计、研究时限、血小板水平的截断值、连续型变量数据的统计类型以及文献质量评价结果。
1.4 质量评价 使用Newcastle-Ottawa Scale文献质量评价量表对纳入原始研究的质量进行评估,该量表主要包括研究对象的选择、研究可比性和结果评估3个部分[7]。针对队列研究:(1)暴露队列的代表性(0~1分);(2)非暴露队列选择的合理性(0~1分);(3)暴露因素的确定(0~1分);(4)研究开始时所有研究对象是否发生目标疾病(0~1分);(5)混杂因素的控制(0~2分);(6)结局评价的描述(0~1分);(7)随访时间是否充分以观察结局发生(0~1分);(9)队列随访的充分性(0~1分)。满分为9分,得分超过6分视为研究质量较高。这项工作由两位研究者独立完成,并通过讨论达成一致结论。
1.5 数据提取与统计学分析 采用Stata软件(version 14.1)和Rev Man软件(version 5.3)进行meta分析。对于二分类变量,计算OR和95%CI,而对于连续型变量,计算SMD和95%CI。当血小板计数以中位数表示时,将其视为正态分布并将数据转化为x-±s形式。采用Cochran'sQ检验分析评价异质性,采用I2衡量异质性的大小,I2值超过50%被定义为有异质性。当纳入研究之间存在显著异质性时,采用随机效应模型;否则,采用固定效应模型。对统计模型的稳定性进行敏感性分析,即依次剔除单个研究后重新进行meta分析,估计综合效应大小。此外,根据病情严重性的评价标准进行了亚组分析,以探索异质性的来源。最后通过绘制漏斗图和采用Begg、Egger法量化检测判断发表偏倚。P<0.05为差异有统计学意义。
2 结果
2.1 文献检索结果 从Pub Med、Web of Science以及EMBASE数据库中初步检索出3 135篇文献,从参考文献中纳入9篇文献,去除重复后共剩余1 335篇文献,阅读标题和全文后,由于重复发表、研究内容与主题不相关、研究类型以及文献类型不相符等原因去除了1 191篇文献,经过全文阅读后,去除87篇文献,主要原因为研究内容不相符,无法提取必要数据,文献类型为综述、述评及指南等,最终共纳入57篇文献[2,8-63]。对其中的21篇文献进行二分类变量的meta分析,48篇文献进行连续型变量的meta分析,筛选流程及结果见图1。纳入的57篇文献均为回顾性研究,其中有46篇文献来自中国,另外11篇分别来自美国、巴基斯坦、土耳其、意大利、伊朗和新加坡。每个研究的样本量从12到1 099不等,共分析了10 979例研究对象,其中重症患者3 306例,非重症患者7 673例,重症患者的分组标准包括入院时临床分型(重型或危重型)、进入ICU、使用机械通气、发生ARDS以 及 死 亡。其 中Guan等[2]、Aggarwal等[8]和Zhang等[54]的研究中以入院时达到复合终点(包括进入ICU、使用机械通气、休克或死亡)作为病情严重的评估标准,Xu等[48]的研究以症状超过10 d作为病情严重的评估标准。进行二分类变量meta分析的21篇文献的血小板减少截断值分别为100、125和150,单位以×109/L表示。进行连续型变量meta分析的48篇文献中,有15篇文献的血小板水平以x-±s进行描述,有32篇以中位数进行描述,有1篇文献以均数和中位数分别进行描述。纳入研究的基本特征见表1。
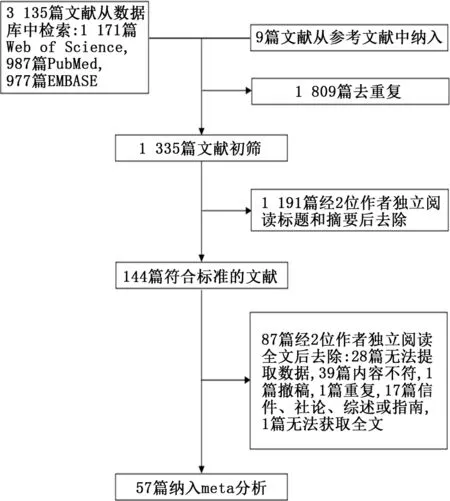
图1 文献纳入流程图

表1 文献一般信息表

续表1
2.2 质量评价 采用Newcastle-Ottawa Scale文献质量评价量表对纳入原始研究的质量进行评估,12个研究得分为8分,10个研究得分为7分,20个研究得分为6分,14个研究得分为5分,1个研究得分为4分。
2.3 二分类变量的森林图结果 21篇文献共4 536例研究对象的森林图结果显示重症COVID-19患者发生血小板减少的人数较非重症组更多,差异有统计学意义(OR=2.51,95%CI:1.93~3.26,P<0.001)。纳入的25个研究结果之间存在异质性(P=0.003,I2=49%),故采用随机效应模型进行meta分析(图2)。敏感性分析结果提示结果稳定,逐项剔除纳入的各项研究后,各合并效应量无明显改变,结果与剔除前总体趋势一致(图3)。为探究异质性的来源,我们对病情严重程度的评价指标进一步开展亚组分析发现,按病情严重性分组的研究中2组间的血小板水平有显著性差异(OR=2.64,95%CI:2.07~3.36,P<0.001,I2=21%,P异质性=0.22)。按疾病预后分组的研究中2组间的血小板水平差异有统计学意义(OR=2.44,95%CI:1.41~4.24,P=0.001,I2=64%,P异质性=0.002)。最 后 对 纳 入 研究进行漏斗图分析,结果显示漏斗图对称性较好。
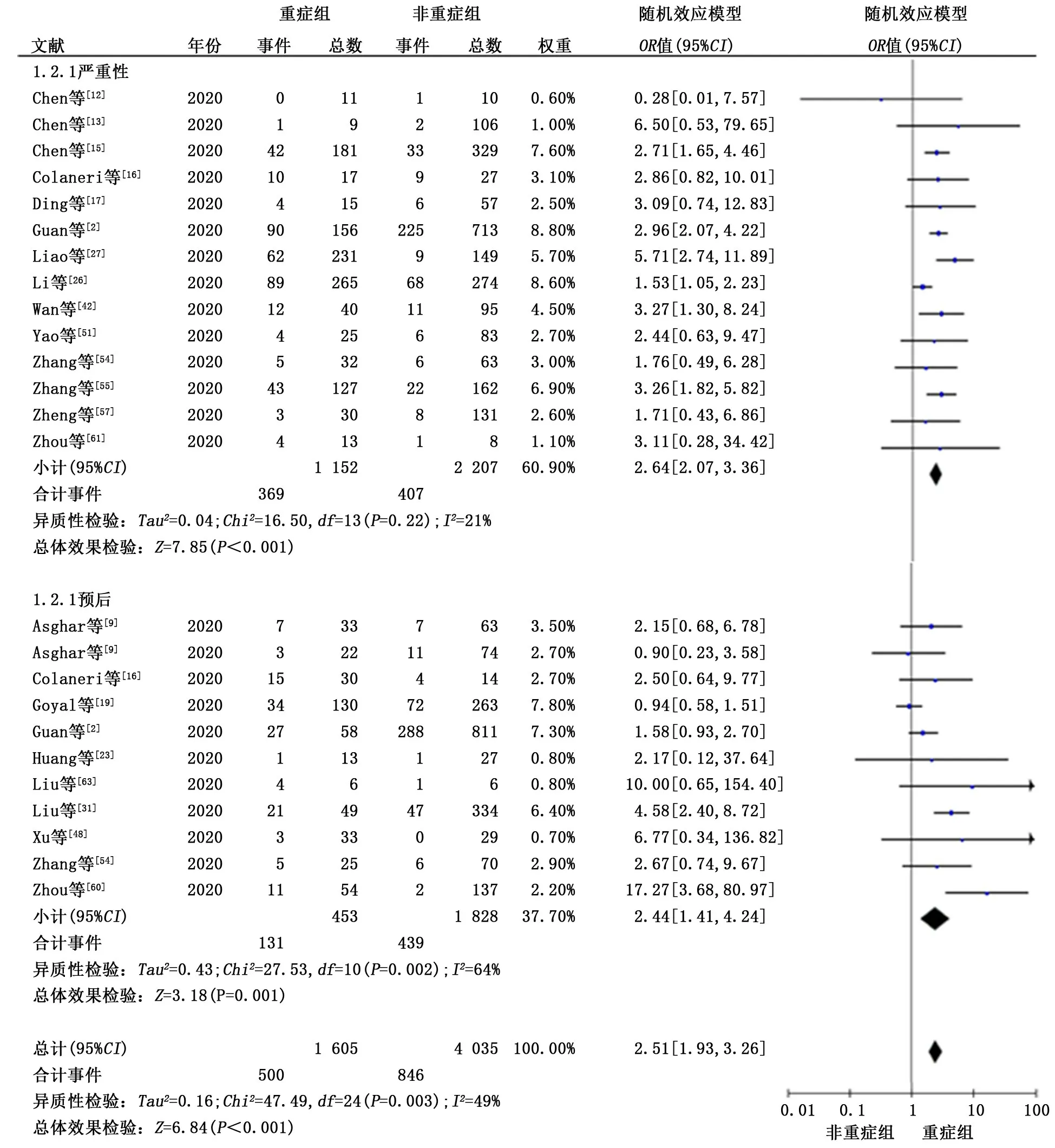
图2 新型冠状病毒肺炎患者病情严重程度与血小板减少二分类变量的森林图

图3 新型冠状病毒肺炎患者病情严重程度与血小板减少二分类变量的敏感性分析结果图
通过Begg法对上述漏斗图的对称性进行量化检验,结果显示P=0.294,故认为本研究不存在发表偏倚(图4)。

图4 新型冠状病毒肺炎患者病情严重程度与血小板减少二分类变量的Begg法检验发表偏倚结果图
2.4 连续型变量的森林图结果 48篇文献共8 468例研究对象的森林图结果显示重症COVID-19患者的血小板计数水平较非重症组更低,差异有统计学意义(SMD=-24.60,95%CI:-30.98~-18.22,P<0.001)。纳入的53个研究结果间存在异质性(P<0.001,I2=65%),故采用随机效应模型进行meta分析(图5)。敏感性分析结果提示结果稳定,逐项剔除纳入的各项研究后,各合并效应量无明显改变,结果与剔除前总体趋势一致(图6)。为探究异质性的来源,我们对病情严重程度的评价指标进一步开展亚组分析发现,按病情严重性分组的研究中2组间的血小板水平差异有统计学意义(SMD=-24.00,95%CI:-32.26~-15.63,P<0.001,I2=66%,P异质性<0.001)。按疾病预后分组的研究中2组间的血小板水平差异有 统 计 学 意 义(SMD=-25.01,95%CI:-35.18~-14.85,P<0.001,I2=66%,P异质性<0.001)。但亚组中均仍存在异质性。最后对纳入研究进行漏斗图分析,结果显示漏斗图对称性较好。通过Egger法对上述漏斗图的对称性进行量化检验,结果显示P=0.141,故认为本研究不存在发表偏倚(图7)。

图5 新型冠状病毒肺炎患者病情严重程度与血小板减少连续型变量的森林图

图6 新型冠状病毒肺炎患者病情严重程度与血小板减少连续型变量的敏感性分析结果图

图7 新型冠状病毒肺炎患者病情严重程度与血小板减少连续型变量的Egger法检验发表偏倚结果图
3 讨论
二分类变量的meta分析结果显示重症患者发生血小板减少的人数更多,连续型变量的meta分析结果显示重症患者的血小板计数水平更低,两者的结果相一致,即重症COVID-19患者更易发生血小板减少。
与SARS患者发生血小板减少相仿[5]。有研究表明COVID-19患者也会出现血小板减少,但其发生率不一,血小板计数<100×109/L患者占5%,<125×109/L患者占12%,<150×109/L患者占36.2%[64],其中重症患者血小板水平降低的发生率较高[2,12]。其相关机制主要为血小板生成减少及血小板消耗、破坏增多。血小板生成减少的机制包括:(1)人体的造血干细胞、巨核细胞和血小板通常高表达CD13,病毒通过与CD13或CD66a受体结合直接侵入造血细胞或感染骨髓基质细胞等,损伤巨核细胞和血小板,加重细胞凋亡,进而引起血小板生成减少[4];(2)结构分析表明SARS-Co V-2可能与ACE2受体结合而感染人体[65]。近年来越来越多的证据表明ACE2在心血管、肾脏和呼吸系统中具有生理和病理作用[66],与急性肺损伤的发生或严重程度密切相关[67]。肺是巨核细胞动态释放血小板的器官之一,约占血小板总生成量的50%[68]。COVID-19患者肺损害可使肺部巨核细胞破坏增多,导致血小板生成减少。血小板消耗、破坏增多的机制包括:(1)与SARS、中东呼吸系统综合征等病毒感染性疾病易引起细胞因子风暴[69-70]相同。有研究发现COVID-19患者血浆中多种细胞因子浓度明显升高,且危重症患者升高的程度显著高于普通患者[23,71],细胞因子风暴会导致免疫过度激活,通过自身抗体或免疫复合物等免疫介导造成细胞损害和血小板破坏增多;(2)同时,免疫过度激活会释放大量炎症因子,促进血小板过度活化和血小板-单核细胞聚集形成[72],在损伤部位形成血栓,进一步导致血小板消耗及破坏增加。
本研究亚组分析结果提示,血小板减少不仅与病情严重程度有关,同时与患者的预后密切相关。部分回顾性研究结果表明死亡患者的血小板计数中位数明显低于幸存者[22,33,56]。Liu等[31]对383例患者资料进行回顾性分析后发现,入院时血小板计数的基线水平和住院期间血小板水平的动态变化均与住院死亡率密切相关。入院时血小板减少患者的死亡率是无血小板减少患者的3倍,血小板每增加50×109/L,死亡率降低40%。但对于ICU、ARDS以及需要辅助供氧患者的血小板计数减少情况,目前尚未得到统一的结果[10,34,39,52]。
血小板是一种无核血细胞,在止血和血栓形成中均发挥着重要作用。同时,血小板还通过与内皮细胞的相互作用来调节血管功能以及维护血管内皮完整性。血小板减少可导致出血风险增加,不利于相关有创操作的进行。一项关于COVID-19患者神经系统表现的研究发现有1.1%的重症患者发生脑出血,轻症患者未出现[73]。此外,血小板减少会导致凝血系统紊乱。重症COVID-19患者血小板相关参数的改变与凝血酶原时间延长、D-二聚体增加和纤维蛋白原减少相关,持续高凝状态会促进血栓形成,最终导致多器官功能衰竭。一项关于重症COVID-19患者肺组织活检的研究证实了肺部微血栓形成[74],同时也有研究表明大多数COVID-19死亡病例中可能存在弥散性血管内凝血[3,23]。
目前已有部分meta分析的研究结果佐证了本研究的观点[75-76],但大多仅纳入早期临床数据结果,本研究在既往研究的基础上,对近期临床文献进行了进一步检索,因纳入文献数量较大,结果相对更为可靠。但本研究仍存在一些局限性:(1)连续型变量的meta分析中有部分文献的血小板水平以中位数的形式表示,数据转换可能会造成误差。(2)纳入的研究设计均为回顾性研究,且有部分研究在全部患者尚未全部出院时即开展并最终发表,文献质量评价结果提示仅有22篇为高质量研究,更多高质量的临床研究亟待纳入。(3)亚组分析结果提示各亚组间仍存在异质性,由于所获得的信息有限,未能完全确定异质性的主要来源。(4)为了扩大文献纳入数量,我们进行了两轮筛选,由于第二轮筛选时文献数量较多,增加了关键词及语言限制,这可能会造成部分相关文献的遗漏。
总而言之,COVID-19的重症患者更易发生血小板减少。对于未来的研究方向,我们认为应该着重于以下几点:(1)需要进一步确定血小板减少的截断值以更好的发挥临床价值。(2)血小板计数对凝血障碍的评估价值有限,重症患者血小板计数的动态变化仍需进一步探讨。(3)亟需更多大样本、高质量临床研究来进一步证实我们的结论。目前的研究表明血小板计数<50×109/L的患者比例较小,且很少有血小板减少引起重要器官出血的报道,但在临床上我们仍需引起重视,防治出血是必要的,并且在面对血小板计数偏低的患者应尽量避免有创性操作,动态监测血小板水平的变化,以便深入了解患者当前的临床状态和及早预判疾病的转归结果,依病情可考虑进行血小板输注。对于危重症患者出凝血功能障碍的临床管理,需及早重视,从而进一步降低患者的死亡风险。
利益冲突所有作者均声明不存在利益冲突
