均相电化学生物传感器的应用研究
2021-07-04杨建梅王玲丽
杨建梅, 王玲丽, 张 金, 赵 焱
(云南师范大学化学化工学院, 云南昆明650500)
0 前言
电化学生物传感器由于仪器便携、 响应快速、灵敏度高、选择性好,因此在生命医学、疾病诊断、食品安全及环境监测等领域发挥着重要的作用[1-2]。 然而,传统的电化学生物传感器通常需要将生物探针固定到电极上, 不仅固定过程耗时费力, 而且传感体系中涉及到的反应发生在电极界面与溶液(固-液)两相介质中,使反应的速率受到一定的限制,进而影响传感器的检测性能[3-4]。 均相电化学生物传感器不需要将生物探针固定在电极表面, 避免了繁琐耗时的固定化过程, 弥补了传统电化学生物传感器所存在的不足[5-6]。 系统深入的探究均相电化学生物传感器的构建策略可以为电化学生物传感器的进一步发展提供有力的理论支撑,从而加速均相电化学生物传感器的发展进程。 该文简要介绍了电化学生物传感器的工作原理及分类,重点讨论了均相及非均相电化学生物传感器各自的特点,并分析了两类均相电化学生物传感器的构建策略。 旨在为均相电化学生物传感器的构建和发展提供理论依据和支撑,从而加速均相电化学生物传感器的研究进展。
1 电化学生物传感器概述
1.1 电化学生物传感器的原理
电化学生物传感器是指用固定化的生物体成分(酶、核酸、蛋白质,抗原、抗体、激素等)或生物体本身(细胞、细胞器、组织等)生物材料作为敏感元件,电极作为转换元件,以电流、电阻或者电位作为特征检测信号的传感器[7]。 电化学生物传感器主要由生物识别元件、 信号转换器及数据分析仪三个部分组成。其工作原理如下,首先通过被测物质与生物识别元件间特异性的相互作用完成生物识别过程;然后通过电极作为信号转换装置将生物识别信号转换为可测的电化学信号,如电流、电阻、电位等;最后通过数据分析仪将信号输出,实现对目标被测物定性或定量的分析[8]。
1.2 电化学生物传感器的分类
根据生物识别元件的不同,可以将电化学生物传感器分为电化学酶生物传感器、电化学DNA生物传感器、电化学免疫生物传感器、电化学适体生物传感器及电化学细胞生物传感器等[9]; 根据信号输出方式的不同,则可以将电化学生物传感器分为电阻型电化学生物传感器、电流型电化学生物传感器、电位型电化学生物传感器、及电容型电化学生物传感器等[10];此外,还可以根据传感体系中反应发生所处介质的不同,将其分为非均相电化学生物传感器和均相电化学生物传感器。 该文主要从传感体系中反应发生所处介质的不同,讨论非均相和均相电化学生物传感器各自的特点,并分析两种传感器常见的构建策略。
1.3 非均相电化学生物传感器
非均相电化学生物传感器也称作固定化电化学生物传感器,一般采用固体电极作为传感界面,将生物识别元件固定到电极表面,目标生物分子通过与敏感元件间的特异性相互作用被捕获到电极表面,使电极表面的电子传递系统受到影响,从而改变传感体系中的电化学信号。 根据电化学信号的变化,实现对被测物质的定性或定量检测。 这种传统的非均相电化学生物传感器通常需要先将生物识别元件固定在电极的表面,由此带来了很多问题:(1) 为了将生物识别元件固定到电极表面,电极要经历“清洗-打磨-修饰”等多个繁琐的预处理过程,增加了传感器构建的成本,耗费了大量的时间;(2)生物识别元件在电极表面固定的效率较低或是固定不稳定,不仅浪费试剂药品,还会影响传感器的灵敏度、稳定性及重现性;(3) 电极预处理及修饰等构建过程难免会存在一定的差异性,由此不可避免的会给检测结果带来相应的检测偏差;(4) 将生物识别元件固定到电极表面不仅会产生较大的空间位阻效应,还会改变识别分子的几何形状,降低结构自由度,影响生物分子间的识别及结合效率,进而影响传感器的灵敏度;(5) 传感体系中涉及到的反应发生在溶液与电极界面(“液-固”)两相非均相介质中, 使得反应的速率受到一定的限制,因此会影响传感器的灵敏度。 生物传感器的性能大都依赖于生物探针的表面固定化,因此生物探针固定化是制约电化学生物传感器进一步发展的瓶颈。
1.4 均相电化学生物传感器
均相电化学生物传感器是指不需要将生物识别元件固定到电极表面,生物识别过程及传感体系中涉及到的其它反应过程都在均相溶液中进行的免固定化的传感器。 利用目标分析物引发信号分子扩散或者吸附在电极表面,即可实现对目标分析物的检测。 与传统的电化学生物传感器相比,免生物探针固定的均相电化学生物传感器不论在传感器构建过程中,还是传感器的检测性能方面都凸显出了独特的优势:(1) 避免了繁琐的电极处理及修饰等过程,进一步简化了电化学生物传感器的操作步骤,降低了传感器构建的成本;(2)无需将识别元件固定到电极表面,所有加入传感体系内的生物分子均可以充分的参与反应,不会造成试剂药品的浪费;(3)避免了电极预处理及修饰等构建过程的差异性,减小了检测结果的偏差;(4) 参与反应的生物分子脱离了电极的束缚,恢复到最佳的几何形态及自由度,可以自由的参与反应, 同时保持最佳的生物活性、生物识别及结合能力,提高了生物分子间的结合效率,进而提升了传感器的灵敏度;(5)所有的反应在均相溶液中进行,使得参与反应的生物分子可以进行高效的碰撞, 不仅可以加快反应速率,还可以确保反应的有序进行,从而保证了传感器的灵敏度。 近年来,基于上述这些独特的优势,一系列简单、快速、灵敏的均相电化学生物传感器相继被报道。 均相电化学生物传感器的发展弥补了传统电化学生物传感器所存在的不足,使电化学生物传感器的应用变得更加的简单方便。 系统深入地探究均相电化学生物传感器的构建策略可以为电化学生物传感器的进一步发展提供有力的理论支撑,从而加速均相电化学生物传感器的发展进程。
1.5 非均相与均相电化学生物传感器性能比较
表1 对非均相和均相电化学生物传感器在核酸、蛋白质、小分子等检测中的性能进行了比较。 从表中对比结果可以看出,非均相电化学生物传感器构建过程中,其电极处理及修饰所需的时间通常达几个小时以上。 然而均相电化学生物传感器不需要生物探针在电极表面的固定,避免了长达数小时的电极处理和修饰过程。 更重要的是,均相电化学生物传感器的检测性能与非均相电化学生物传感器的检测性能相当, 甚至更优。由此可见,均相电化学生物传感器在生物分析检测中具有很大的优势,相信其将会在未来电化学生物检测中发挥重要的作用。
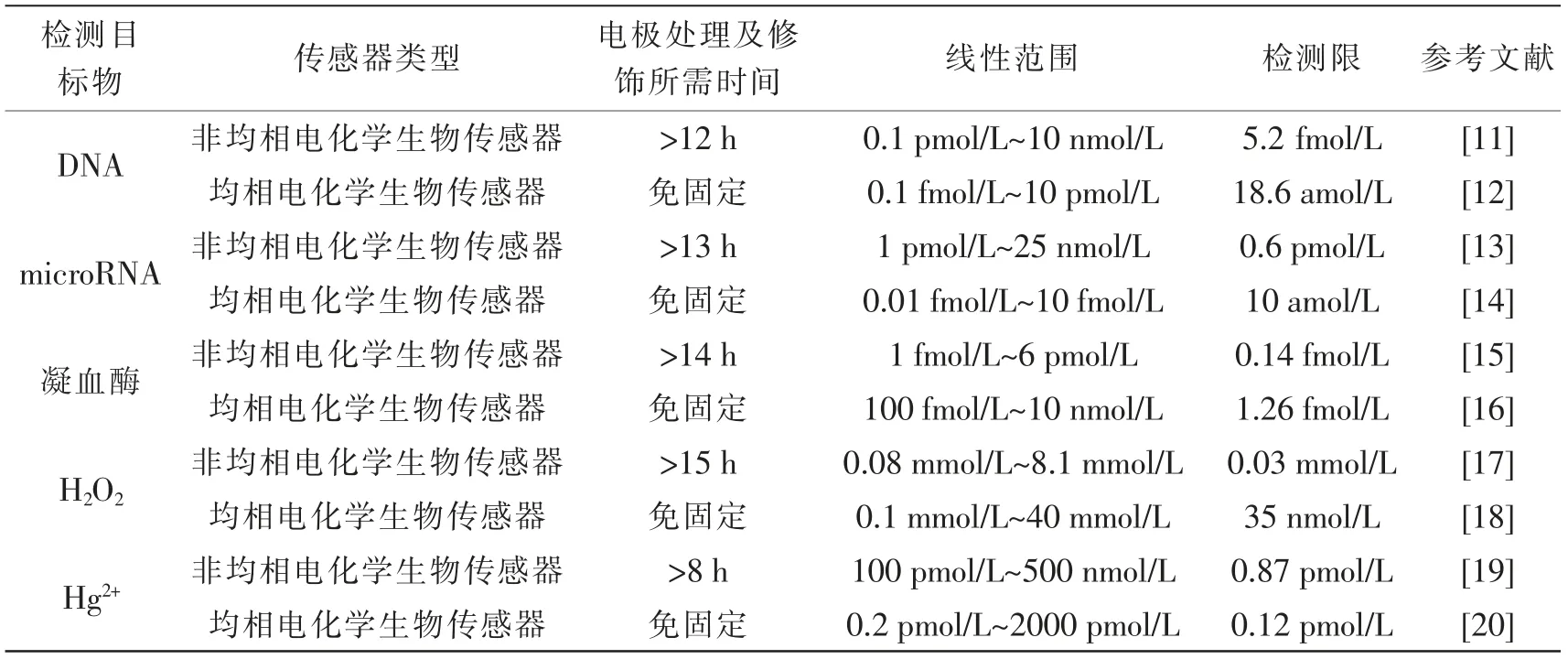
表1 非均相电化学生物传感器和均相电化学生物传感器性能比较Tab.1 Performance comparison of traditional heterogeneous electrochemical biosensors and homogeneous electrochemical biosensors
2 均相电化学生物传感器的应用研究
在均相电化学生物传感器中,电化学信号的产生主要通过电活性分子在电极表面的扩散或吸附两种形式实现。 根据电活性分子与电极表面接触方式的不同,可以将均相电化学生物传感器分为扩散介导的均相电化学生物传感器及亲和介导的均相电化学生物传感器两类。 接下来将对这两类均相电化学生物传感器的构建策略进行分析总结。
2.1 扩散介导的均相电化学生物传感器
扩散介导的均相电化学生物传感器是基于不同存在形式电活性分子在电极表面扩散速率的不同而发展起来的传感器。 电活性分子扩散到电极表面后,发生氧化还原反应,产生电化学信号,从而实现对目标物的分析检测。 在这类传感器中,通常采用铟锡氧化电极(ITO 电极)作为工作电极,DNA 作为生物探针。 ITO 电极表面带有大量的负电荷,DNA 的磷酸骨架使其带有负电荷。 因此研究者通常利用酶剪切或DNA 自组装等途径改变DNA 的结构,从而改变DNA 结构与ITO 电极间静电作用力的大小, 实现对目标分子的定量分析与检测。
2.1.1 基于酶剪切-扩散介导的均相电化学生物传感器
酶剪切-扩散介导的均相电化学生物传感器的构建通常采用以下的方式: 合理的设计DNA结构, 使标记有电活性物质的DNA 探针在没有目标物时与电极间有较大的静电排斥力,加入目标物后,引发DNA 结构的变化,使其能被酶识别剪切,形成单核苷酸片段,与电极间的排斥力减小,从而使得标记有电活性物质的核苷酸片段靠近电极表面,产生电流信号,实现对目标物的定量检测。
香港科技大学I-Ming Hsing 教授课题组在2011 年首次提出了免固定的均相电化学生物传感器的概念,并发展了一系列新型的免固定化的电化学生物传感器实现了对多种生物分子的均相检测[21-23]。 例如在2013 年,该课题组借助汞离子(Hg2+)诱导DNA 链的构象变化及核酸外切酶-III(Exo-III)剪切构建了免固定电化学生物传感器,对Hg2+进行了均相电化学检测[22]。 如图1 所示,当没有Hg2+存在时,标记有电活性物质亚甲基蓝(MB)的DNA 链与ITO 电极间存在较大的排斥力,导致DNA 链无法靠近电极,因此产生的电化学响应信号很弱。 而向体系中加入Hg2+时,Hg2+诱导DNA 单链发生构型变化, 形成能被Exo-III 识别的DNA 双链结构,Exo-III 酶将其剪切为单核苷酸片段,使标记有MB 的核苷酸与电极间的排斥力减小。 此时,标记有MB 的核苷酸可以靠近电极表面, 产生较大的电流响应信号。基于此, 实现了对Hg2+快速简单的均相检测,检测限达0.2 nmol/L。 该均相电化学生物传感器无需繁杂的电极打磨和修饰等预处理过程, 十分简单便捷, 为金属离子的检测提供了新的检测平台。
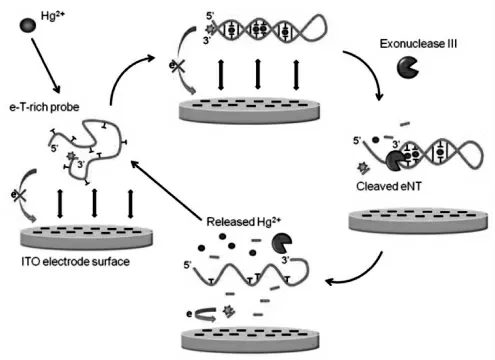
图1 扩散介导的免固定均相电化学生物传感器检测Hg2+的原理示意图[22]Fig.1 Illustration of the Hg2+detection by the diffusion mediated immobilization-free homogeneous electrochemical biosensor[22]
青岛农业大学李峰教授课题组也在均相电化学生物传感器方面做了大量的研究工作[24-27]。2017 年,该课题组报道了一种基于Exo-III 等温切割循环放大的超灵敏均相电化学生物传感器,对转录因子NF-κB p50 进行了检测[28]。如图2 所示,没有目标物存在时,标记有亚甲基蓝(MB)的发夹探针不能被Exo-III 识别剪切, 它与带负电荷的ITO 电极间存在较大的静电排斥力,因此无法靠近电极,只能得到一个微弱的电流信号。 而当加入目标物NF-κB p50 时, 发夹探针被Exo-III 识别切割,释放出小尺寸且负电荷减少的单核苷酸-MB 片段,使MB 与ITO 电极间的排斥力减弱,MB 可以靠近电极, 产生放大的电流响应信号。 基于此,该传感器实现了对转录因子NF-κB p50 的高灵敏检测。 这个工作为转录因子的检测提供了一个简单、快速且成本低的分析平台。

图2 扩散介导的免固定均相电化学生物传感器检测NF-κB p50 的原理示意图[28]Fig.2 Illustration of the NF-κB p50 detection by the diffusion mediated immobilization-free homogeneous electrochemical biosensor[28]
此外,还有很多科研小组也在均相电化学生物传感器研究领域做出了贡献。 例如南开大学的唐波教授课题组研究了一种基于核酸外切酶辅助的均相电化学生物传感器, 对DNA 进行高灵敏检测,检测原理如图3[29]。该方法为发展其他的核酸检测方法提供了一定的理论支撑和新的途径。 福州大学杨黄浩教授课题组提出了一种基于切刻酶辅助的均相电化学生物传感器,对赭曲霉素A(OTA)进行高灵敏的检测,检测原理如图4所示[30]。 该方法简单,快速,具有高灵敏度,检测下限低达0.004 ng/mL。
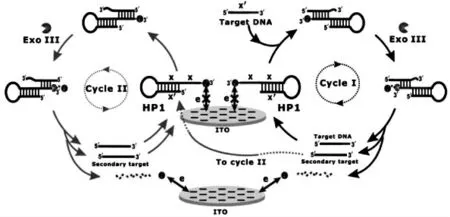
图3 扩散介导的免固定均相电化学生物传感器检测DNA 的原理示意图[29]Fig.3 Illustration of the DNA detection by the diffusion mediated immobilization-free homogeneous electrochemical biosensor[29]
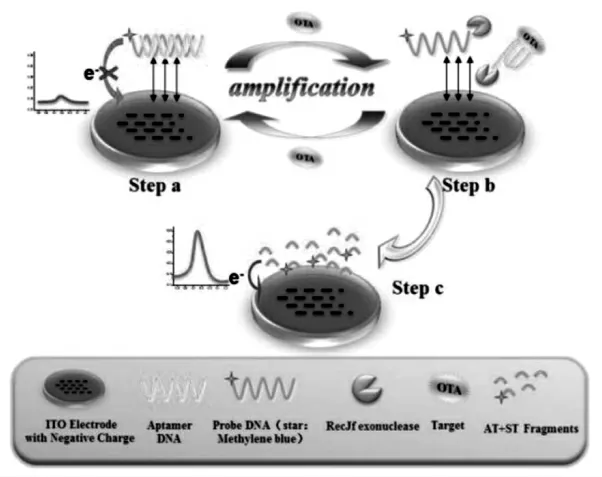
图4 扩散介导的免固定均相电化学生物传感器检测OTA 的原理示意图[30]Fig.4 Illustration of the OTA detection by the diffusion mediated immobilization-free homogeneous electrochemical biosensor[30]
2.1.2 基于DNA 自组装-扩散介导的均相电化学生物传感器
除了通过酶剪切改变DNA 结构与电极间的排斥力之外, 还可以利用DNA 自组装改变DNA结构与电极间静电排斥力的大小,实现对目标分析物的检测。 I-Ming Hsing 教授课题组提出了一种基于DNA 和肽核酸(PNA)自组装构建的均相电化学生物传感器,实现了对特定核酸序列的高灵敏检测[23]。 如图5 所示,当没有目标核酸序列时,标记有二茂铁的PNA(Fc-PNA)由于不带电荷,因此可以自由的移动到ITO 电极表面,产生较大的电流响应信号。 而当存在目标物时,目标物引发DNA 和PNA 之间的级联自组装,得到树枝状的DNA/PNA 的纳米结构,此时,由于纳米结构中含有大量的DNA 序列, 使其带有大量的负电荷, 与电极之间产生很大的排斥力, 阻碍Fc-PNA 接近电极表面,只能得到一个较小的电流响应信号。 根据电流响应信号的变化,即可对目标物进行定量检测。 该方法构建简单、灵敏度高,检测限低达100 fmol/L, 为核酸的高灵敏且简单快捷地检测开辟了新途径。
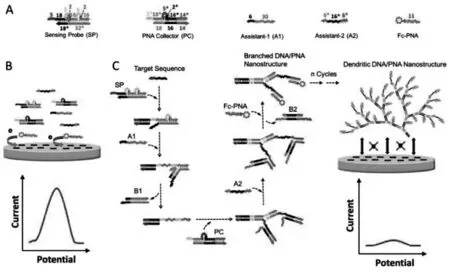
图5 扩散介导的免固定均相电化学生物传感器检测特定核酸序列的原理示意图[23]Fig.5 Illustration of the nucleic acids detection by the diffusion mediated immobilization-free homogeneous electrochemical biosensor[23]
李峰教授课题组报道了一个免标记、免固定化的均相电化学生物传感器,对有机磷和氨基甲酸酯类杀虫剂进行了检测[31]。 如图6 所示,没有杀虫剂存在时,乙酰胆碱酶能催化HP 探针水解,使其由发夹型结构变为单链结构, 单链DNA 引发挂锁探针在T4 聚合酶下聚合形成双链, 从而引发滚环扩增放大反应, 产生一条包含很多G-四分体结构的DNA 长链, 捕获大量的亚甲基蓝分子, 亚甲基蓝与电极表面间的扩散速率减小,导致电流信号减弱。 当有杀虫剂时,杀虫剂能抑制乙酰胆碱酶的活性, 因此不能引发接下来的滚环扩增放大反应, 大量自由的亚甲基蓝可以扩散到ITO 电极表面, 产生较大的电流响应信号。 根据电流信号的变化,即可对杀虫剂进行定量检测。 该传感器能应用于实际样品检测中,为传感器在环境及食品安全方面的监测开辟了新的途径。
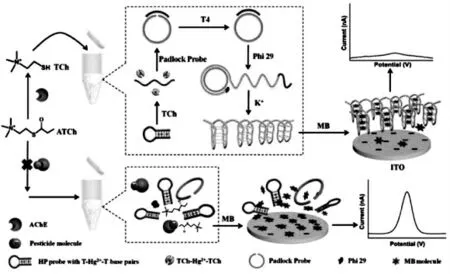
图6 扩散介导的免固定均相电化学生物传感器检测杀虫剂的原理示意图[31]Fig.6 Illustration of the pesticide detection by the diffusion mediated immobilization-free homogeneous electrochemical biosensor[31]
2.2 亲和介导的均相电化学生物传感器
除扩散介导的均相电化学生物传感器外,研究者在电极表面修饰特殊的能吸附生物分子的分子层,利用生物分子与电极表面功能化修饰的表面分子之间的π-π 堆积等非共价键相互作用,发展了亲和介导的均相电化学生物传感器。
据文献报道, 石墨烯六元碳环与单链DNA碱基中碳环结构间的π-π 堆积相互作用使石墨烯对单链DNA 有着较强的亲和力。 而DNA 双螺旋结构会屏蔽核酸碱基, 因此石墨烯与DNA 双链间的亲和力很小。 李峰教授课题组结合石墨烯独特的性质和电化学传导的高灵敏性, 构建了π-π 堆积亲和介导的均相电化学生物传感平台,对癌胚抗原(CEA)进行了检测[32]。 如图7 所示,通过电化学还原在玻碳电极上修饰还原氧化石墨烯得到传感器界面 (GCE/rGO)。 没有目标物CEA 时,体系中所有的DNA 以发夹型结构(双链结构)存在,不能被吸附到电极表面。 而当加入目标物CEA 时,CEA 引发两个发夹探针间的自组装,使HP2 的5’末端变为能被T7Exo 酶识别的状态,在酶的切割下,释放出标记有亚甲基蓝的DNA 单链。 单链DNA 通过与还原氧化石墨烯间的π-π 堆积相互作用吸附到GCE/rGO 电极表面,产生放大的电化学信号,实现对CEA 的高灵敏检测。 这种基于亲和介导的方式为均相电化学生物传感器的构建提供了新的途径,并为癌症标志物的检测提供了新的思路。
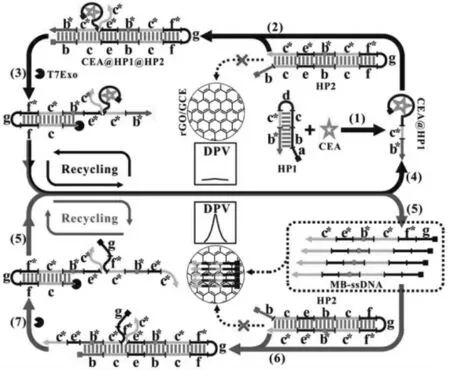
图7 亲和介导的免固定均相电化学生物传感器检测CEA 的原理示意图[32]Fig.7 Illustration of the CEA detection by the affinity mediated immobilization-free homogeneous electrochemical biosensor[32]
Li Wang 教授课题组在电极表面修饰十二烷基硫醇单层膜,利用十二烷基硫醇上烷基链与亚甲基蓝之间的疏水作用,构建了亲和介导的均相电化学生物传感器, 对目标DNA 分子进行了检测[33]。 其工作原理如图8 所示,将亚甲基蓝标记在发夹型DNA 探针上时,由于DNA 探针较大的分子尺寸和亲水骨架, 标记在发夹型DNA 探针上的亚甲基蓝无法靠近电极表面。 当加入目标DNA 分子后,引发Exo III 对DNA 探针进行循环剪切,得到尺寸较小的标记有亚甲基蓝的单核苷酸片段。 此时,标记有亚甲基蓝的单核苷酸片段通过与十二烷基硫醇上烷基链间的疏水作用被吸附到电极表面,得到放大的电流信号,实现对目标DNA 分子的检测。 这种均相电化学生物传感器为核酸的检测提供了新的检测平台,不仅简化了实验步骤,还有利于灵敏度的提高。
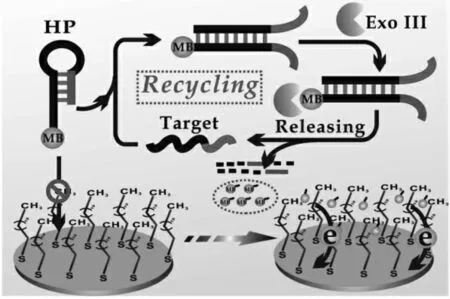
图8 亲和介导的免固定均相电化学生物传感器检测DNA 的原理示意图[33]Fig.8 Illustration of the DNA detection by the affinity mediated immobilization-free homogeneous electrochemical biosensor[33]
3 总结与展望
综上所述,均相电化学生物传感器的构建主要通过电活性分子的扩散介导或亲和介导两种方式实现。 由于均相电化学生物传感器的构建中, 不需要将生物识别元件固定到固体电极表面,因此避免了繁琐耗时的固定化技术及其带来的重现性差等问题,简化了实验操作流程。 此外,由于均相电化学生物传感器中涉及到的反应发生在均相溶液中,从而提高了反应效率,确保了传感器的检测性能。总体而言,均相电化学生物传感技术为电化学生物传感器的进一步发展开辟了新的道路。但是,现有的均相电化学生物传感器仍然存在一些亟待解决的问题:(1)均相电化学生物传感器的设计思路过于复杂, 反应所需时间较长;(2)电活性信号分子过于单一,目前应用于均相电化学生物传感器中的信号分子只局限于亚甲基蓝、二茂铁和硫瑾等,由此导致输出的信号也比较单一, 单一信号的输出易受环境的影响,可能会给检测结果带来较大的影响。 因此,均相电化学生物传感器仍然具有很大的发展前景。
