抗GPC3/CD3双特异性重链抗体的制备及其抗肝癌作用评价
2021-07-03李永成祝强强王彦婷孙亚奇
李永成, 祝强强, 王彦婷, 王 洋, 孙亚奇, 陆 斌*
1. 海军军医大学药学院生化药学教研室,上海 200433 2. 上海市第四人民医院病理科,上海 200434 3. 海军军医大学长海医院药剂科,上海 200433
肝细胞肝癌(hepatocellular carcinoma,HCC)是全球癌症死亡的第四大常见病种[1],五年生存率仅为10%[2]。晚期肝癌患者丧失手术切除指征,只能进行放化疗,治疗效果欠佳[3-4]。因此针对肝癌进行特异性靶标的筛选和生物靶向治疗成为了研究热点。Glypican-3(GPC3)是硫酸乙酰肝素糖蛋白家族中的一员,通过糖基磷脂酰肌醇(GPI)锚定在细胞膜表面。约70%的HCC存在GPC3表达[5],而绝大多数正常成人组织及肝脏良性病变中没有表达[6]。研究[7]还发现,GPC3在刺激细胞恶性转化,通过经典Wnt信号通路促进肝癌生长中起着关键作用。因此,GPC3作为一种肝癌特异性表达抗原,是肝癌免疫治疗的潜在靶点。
既往抗GPC3人源化抗体GC33的Ⅱ期临床试验发现其在晚期HCC患者中疗效未达到预期,终止了临床试验[8]。抗GPC3单域抗体HN3作为一种仅含单个重链可变区的特殊抗体,具有相对分子质量小且易于渗透的特点,能发挥一定的抗肝癌效果[9]。将其与PE38等毒素融合构建免疫毒素,可进一步增强抗肿瘤活性[10]。将抗CD3 scFv和抗GPC3 scFv用短的Linker进行连接构建双特异性T细胞衔接子(BiTE),可有效募集T细胞靶向杀伤GPC3阳性肝癌细胞[11]。但BiTE亲和力低、纯化困难和半衰期短的缺点限制了其应用。
另外靶向GPC3的嵌合抗原受体T细胞(CAR-T)免疫疗法也是目前肝癌治疗热点之一,多个机构开展了临床试验,其中一项Ⅰ期临床试验结果表明了其初步安全性[12]。但是发热、淋巴细胞计数减少和细胞因子释放综合征(CRS)等不良反应以及个体化疗法存在的高成本和批量生产的局限性,限制了其进一步发展。
因此,本研究通过将抗GPC3 sdAb和抗CD3 sdAb相结合构建抗GPC3/CD3 BiHcAb,一方面较传统双特异性抗体相对分子质量小,易于渗透;另一方面加入IgG4 Fc段有利于提高稳定性、便于纯化。本研究主要初步评价其体内外的抗肝癌效果。
1 材料与方法
1.1 细胞系 人肝癌细胞系SK-Hep-1和Hep3B,人皮肤鳞癌细胞系A431,HEK-293F,人淋巴瘤细胞Raji均由本实验室保存。A431-GW为稳定转染人GPC3的A431细胞。PMBC来源于健康人(海军军医大学医学研究伦理委员会伦理审批号:NMUMREC-2021-050)。
1.2 细胞培养 A431和A431-GW于含10% FBS的DMEM培养基中进行培养,Hep3B和SK-Hep-1于含15% FBS的MEM培养基中进行培养,PBMC于10% FBS的RPMI 1640培养基中进行培养,培养条件5%CO2、37℃、饱和湿度。HEK-293F细胞在无血清CD 293 TGE Medium培养基中进行培养,培养条件7%CO2、37℃,转速115 r/min(r=2.5 cm),饱和湿度。
1.3 载体构建 委托金唯智生物公司全基因合成抗CD3和抗GPC3重链可变区,其氨基酸序列参考WO2010037838A2和US9206257B2,通过密码子优化方式将其转换为核酸序列;合成抗GPC3/CD3 BiTE序列,其氨基酸序列参考GC33和OKT3序列,C端加入6×His。二者序列分别以AgeⅠ、ApaⅠ和AgeⅠ、BamHⅠ插入pCMV-IgG4载体中。
1.4 抗体表达纯化 将重组质粒以PEI转染法导入HEK-293F细胞中,6~7 d后收集培养上清。BiHcAb通过Protein A柱进行纯化,BiTE通过镍柱进行纯化。
1.5 流式细胞术 收集细胞,将检测抗体用5%的BSA稀释到10 μg/mL,冰上孵育1 h,清洗2遍后,BiHcAb用Alexa Fluor 488标记的Anti-human IgG抗体,BiTE用Alexa Fluor 488标记的Anti-His Tag抗体,避光孵育45 min,再清洗2遍,上机检测。
1.6 细胞杀伤实验 以1×105个/孔的靶细胞与PBMC以1∶20的比例共培养并加入10 μg/mL抗体为实验组,并设置效应空白组、靶细胞空白组以及阳性对照组,培养72 h后用CytoTox-Glo Cytotoicity Assay进行检测。
1.7 ELISA检测 采用森雄公司的IFN-γ、TNF-α、IL-2、IL-6的ELISA检测试剂盒,按说明书检测上述共培养体系中细胞培养上清中各细胞因子浓度。
1.8 裸鼠体内肝癌细胞异体移植模型 每组4周龄雄性裸鼠5只,共5组,分别在其背部接种1×107个Hep3B细胞和1×108个PBMC。注射后0.5 h,尾静脉注射含有相应浓度的BiHcAb和BiTE抗体150 μL,以生理盐水为阴性对照,连续5 d通过尾静脉注射抗体。观察21 d后处死小鼠,期间测量肿瘤直径大小,并计算肿瘤体积=(长×宽2)/2。

2 结 果
2.1 抗GPC3/CD3双特异性重链抗体的构建与表达 将全基因合成的抗GPC3和抗CD3的单域抗体VHH序列以AgeⅠ和ApaⅠ酶切位点克隆至含IgG4 Fc段(包括野生型、Knob或Hole突变体)的表达载体pCMV-IgG4中,双酶切筛选获得正确克隆(图1A)。同时将抗GPC3/CD3 BiTE序列以AgeⅠ和BamHⅠ酶切位点克隆至表达载体pCMV中。转染HEK-293F细胞,摇瓶中悬浮培养进行表达。纯化浓缩后,进行蛋白电泳和考马斯亮蓝染色。结果显示:抗GPC3 HcAb、抗CD3 HcAb、抗GPC3/CD3 BiHcAb的相对分子质量约100 000,还原状态下相对分子质量约40 000;抗GPC3/CD3 BiTE的相对分子质量约为50 000(图1B),提示成功构建了4种抗体。
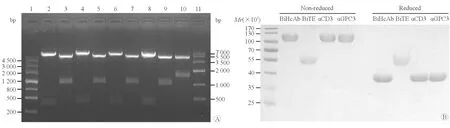
图1 重链抗体和BiTE真核表达载体的构建和蛋白表达检测
2.2 重链抗体与细胞表面相关抗原的结合能力 流式细胞术检测结果(图2)发现:抗GPC3重链抗体能够与内源性表达GPC3的Hep3B细胞和过表达GPC3的A431-GW细胞相结合,而不能与不表达GPC3的SK-Hep-1和A431细胞结合;抗CD3重链抗体能够与PBMC结合,而与不表达CD3的Raji细胞不结合。结果提示前期构建的重链抗体具有与细胞表面相应抗原的结合能力。
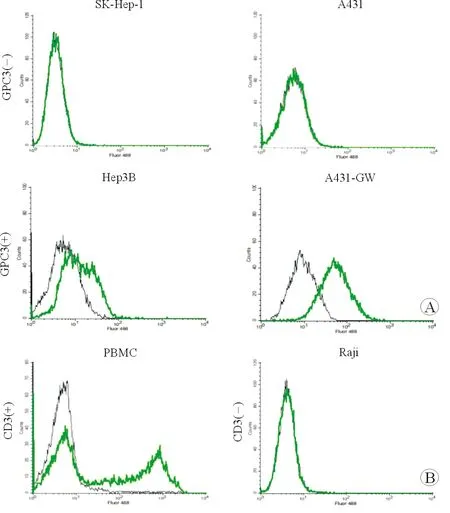
图2 流式细胞术检测重链抗体与细胞表面蛋白的结合
2.3 双特异性重链抗体与细胞表面相关抗原的结合能力 结果(图3)发现,抗GPC3/CD3 BiHcAb既能与内源性表达GPC3的Hep3B细胞和过表达GPC3的A431-GW细胞相结合,也能与PBMC结合,而与不表达GPC3的SK-Hep-1和A431细胞不结合,也与不表达CD3的Raji细胞不结合(图3A);而抗GPC3/CD3 BiTE也具有相似的结合能力(图3B)。结果表明构建的BiHcAb和BiTE都具有与细胞表面相应抗原的结合作用。
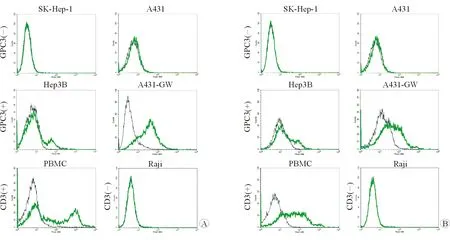
图3 流式细胞术检测双特异性抗体与细胞表面蛋白的结合
2.4 双特异性重链抗体介导的细胞杀伤作用 将靶细胞、PBMC和抗GPC3/CD3 BiHcAb(抗GPC3/CD3 BiTE、抗GPC3 HcAb或抗CD3 HcAb)共孵育72 h,细胞毒性检测结果(图4)发现:BiHcAb在表达GPC3的A431-GW和Hep3B细胞中的杀伤率分别是(43.1±9.0)%和(55.5±7.6)%,显著高于BiTE组的杀伤率(5.3±10.1)%和(11.0±2.8)%,差异有统计学意义(P<0.01);也显著高于BiHcAb在不表达GPC3的A431和SK-Hep-1细胞的杀伤率(11.1±7.6)%和(12.6±1.3)%,差异有统计学意义(P<0.01)。
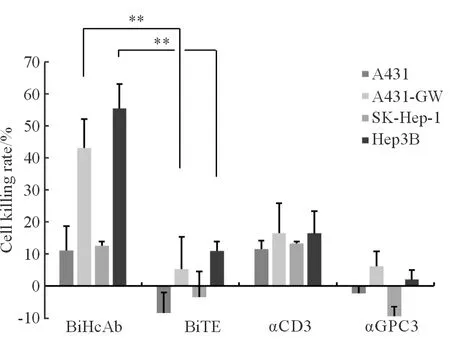
图4 双特异性抗体介导的细胞杀伤效应
2.5 双特异性重链抗体介导的细胞因子释放 结果(图5)表明:BiHcAb在表达GPC3的A431-GW细胞上清中诱导IFN-γ、TNF-α、IL-2和IL-6的表达量分别为(936.3±20.9)、(1 178.2±35.8)、(854.1±81.0)和(818.8±25.2) pg/mL,显著高于BiTE组,分别为(542.1±74.0)、(294.5±28.1)、(460.3±36.0)和(620.0±12.1) pg/mL,差异有统计学意义(P<0.01)。 同样在内源性表达GPC3的Hep3B细胞中,BiHcAb诱导IFN-γ、TNFα、IL-2和IL-6的表达量分别为(840.3±50.3)、(956.5±49.0)、(870.0±53.0)和(951.3±136.4) pg/mL,显著高于BiTE组,分别为(386.2±27.1)、(362.0±22.7)、(542.5±33.7)和(505.1±26.1) pg/mL,差异有统计学意义(P<0.01)。

图5 双特异性抗体介导的细胞因子释放
2.6 双特异性重链抗体体内抑制裸鼠肝癌细胞的生长 裸鼠种植实验结果(图6)表明:与NS组相比,高低浓度BiHcAb组均能显著抑制肝癌细胞在裸鼠体内的生长(P<0.01),且也显著优于BiTE组(P<0.05)。与NS组相比,BiTE高浓度组可抑制肝癌生长(P<0.05),但低浓度组作用不显著。当第21天时,各组裸鼠未出现恶液质表现,但因肿瘤体积大于1 000 mm3,实验终止,处死裸鼠,称量体质量,NS组、2 μg BiHcAb组、20 μg BiHcAb组、1 μg BiTE组和10 μg BiTE组的体质量分别为(25.8±1.5)、(25.4±1.8)、(25.7±3.0)、(26.2±2.2)和(26.5±1.9) g。分离肿瘤组织,观察发现GPC3/CD3 BiHcAb组裸鼠肿瘤平均直径小于其他组别,提示BiHcAb具有良好的抗肿瘤活性。
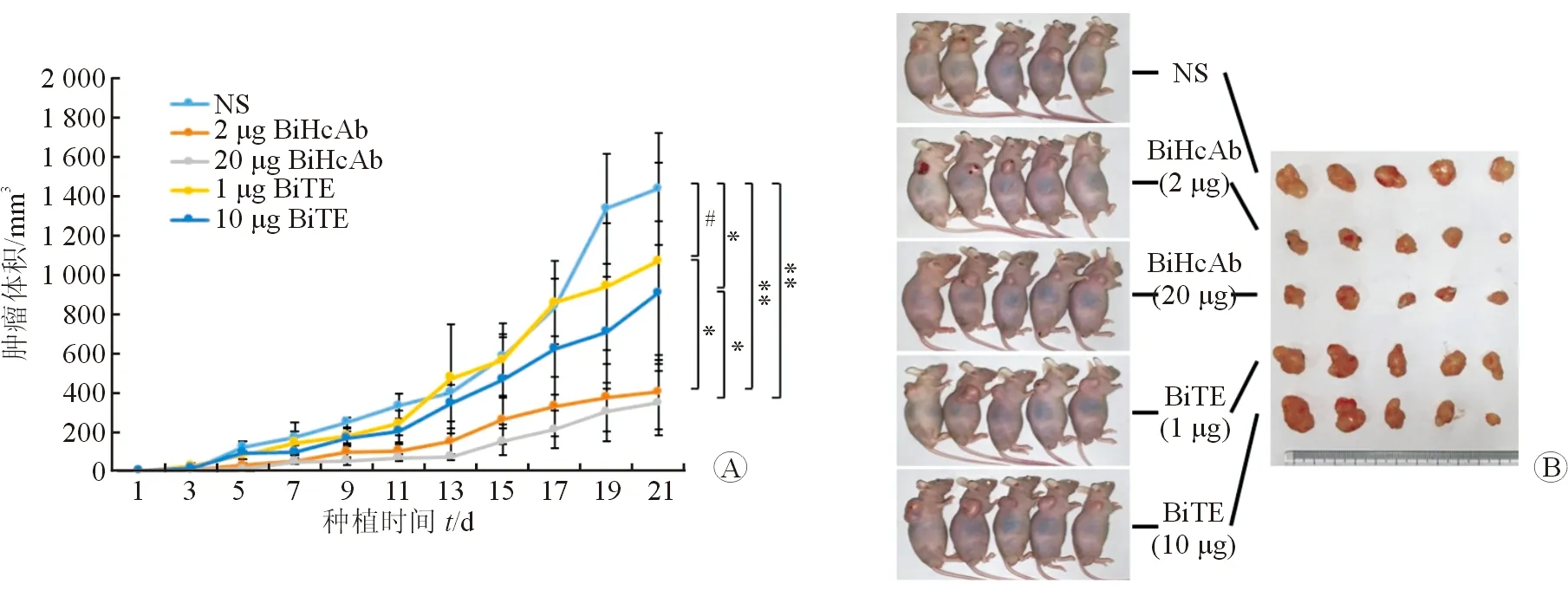
图6 双特异性抗体体内抑制裸鼠肝癌细胞生长
3 讨 论
GPC3作为一种肝癌细胞表面特异性表达的糖蛋白,被认为是肝癌靶向治疗的重要标志物,成为近年来肝癌诊治研究的热点。研究表明GPC3特异性抗体在肝癌的治疗和诊断中具有重要的作用;同时靶向GPC3的免疫细胞治疗如CAR-T细胞治疗也已进入了临床试验阶段。
然而目前CAR-T治疗还处于发展阶段,部分关键问题如细胞因子释放综合征、通用型CAR-T的制备及其在实体瘤的治疗等方面都还未得到很好的解决,而且个体化疗法所带来的高昂治疗费用是一般家庭难以承受的。
靶向人CD3/肿瘤相关抗原(TAA)的BiTE可作为抗肿瘤治疗的重要手段。BiTE作用的发挥必须同时与T细胞表面的CD3和肿瘤细胞上的TAA相结合,然后激活T细胞,诱导细胞毒活性,释放众多细胞因子,从而发挥其抗肿瘤效应[13]。BiTE具有相对分子质量小、易穿透肿瘤组织、免疫原性低等优点[14],但其缺乏Fc段,易在体内被快速消除,血液半衰期较短,仅为1.25 h左右,因此需要持续推注或者一天内多次输注以维持血药浓度[15]。目前仅有一种靶向CD19/CD3的BiTE博纳吐单抗(Blinatumomab),被美国FDA批准用于治疗急性淋巴细胞性白血病。
20世纪90年代初,Hamers-Casterman等[16]偶然从骆驼中发现了一种缺乏轻链、仅有重链的抗体,称为重链抗体(Heavy chain antibodies,HcAbs),其单个重链可变区(VHH)即具有与抗原的结合能力,又被称为纳米抗体(Nanobody)。不同于VH中包含一个面向VL的疏水面,VHH是完全亲水的结构,其稳定性和溶解度优于VH。VHH的CDR3区通常比常规抗体VH的CDR3长,可形成指状延伸,以触及常规抗体无法到达的抗原表位;同时长的CDR3可增大与抗原的相互作用面,部分补偿了VL缺失带来的影响[17]。
本研究通过构建抗GPC3/CD3 BiHcAb,发挥其类似BiTE的功能,以分别结合T细胞和肝癌细胞,随之激活T细胞发挥杀伤肝癌细胞的作用。同时重链抗体比完整抗体小、易于渗透,且因含Fc段,比BiTE的稳定性高,纯化更为方便。研究结果表明BiHcAb在体外实验中针对GPC3阳性细胞的杀伤率约为50%,远高于BiTE的杀伤(约10%)。同时BiHcAb诱导释放的IFN-γ、TNF-α、IL-2、IL-6等细胞因子的水平也高于BiTE组。这一方面由于BiHcAb带有Fc段,其稳定性优于BiTE;另一方面由于与CD3和TAA抗原表位结合的VHH结构域比BiTE中的scFv部分更小,可能使肿瘤细胞与T细胞在空间上更为靠近,导致能够更好地持续性激活T细胞,释放更多的细胞因子,最终发挥更好的肿瘤细胞杀伤活性。在裸鼠体内移植瘤模型中,本研究进一步观察了不同浓度抗GPC3/CD3 BiHcAb和抗GPC3/CD3 BiTE对肝癌生长的抑制效果,发现高低浓度BiHcAb组均具有较明显的肿瘤抑制效果,而低浓度BiTE组抑制效果不明显。结合体内外的实验,本研究初步证实BiHcAb较之BiTE具有更好的抗肿瘤活性。然而本研究仅初步评价了抗GPC3/CD3 BiHcAb的体内外抗肝癌作用,以验证本BiHcAb模型在肿瘤治疗中的有效性。下一步还将深入探讨该抗体的作用和具体机制,为将来的临床应用提供依据。
