恶性胸膜间皮瘤免疫检查点抑制剂的研究进展
2021-07-02黄亚茹孟庆威
黄亚茹 孟庆威
恶性胸膜间皮瘤(malignant pleural mesothelioma,MPM)起源于胸膜间皮细胞,是一种侵袭性极强且极少被治愈的罕见癌症,占所有癌症病例的0.3%[1]。石棉暴露是80%患者的致病因素[2]。近年来,免疫治疗中免疫检查点抑制剂(immune checkpoint inhibitors, ICIs)已经很好地改善了多种实体瘤预后[3],ICIs在MPM中也可能具有良好的抗肿瘤作用。
ICIs治疗间皮瘤的早期试验报告了部分患者的临床反应,但是单药ICIs的疗效在MPM中受到限制[4],可预测MPM免疫治疗疗效的生物标志物仍不确定。在这篇综述中,我们重点总结了MPM中ICIs的相应临床研究的最新进展,探讨了生物标志物程序性死亡受体配体1(programmed cell death ligand 1, PD-L1)在ICIs治疗中的意义。
1 MPM的组织学异质性
MPM的组织学亚型是治疗决策和预后评估的主要指标,根据肿瘤细胞的形态将其分为3种亚型:上皮样、双相(或混合)和肉瘤样,中位生存期(median overall survival,mOS)分别为19个月、12个月和4个月,其中上皮样与最佳预后和最佳化疗反应相关,肉瘤样预后最差[5]。不同组织学亚型表达的免疫检查点不同,肉瘤样MPM中PD-L1表达明显高于其他组[6],上皮样亚型中细胞毒性T淋巴细胞相关蛋白4(cytotoxic T lymphocyte-associated antigen 4,CTLA-4)表达更高[7],T细胞活化的含V区免疫球蛋白抑制物(V-domain Ig suppressor of T-cell activation, VISTA)在上皮样MPM中过度表达[8]。有研究[9]表明,双相MPM细胞对可协同提高MPM铂类化学疗法的蛋白酶体抑制剂硼替佐米更为敏感。MPM组织分子的异质性有助于开发个性化疗法,尤其是免疫疗法和靶向疗法。
2 MPM的肿瘤微环境异质性
肿瘤内和肿瘤间异质性相关的研究大多数都指出了微环境(特别是免疫细胞)的强大作用。MPM微环境的免疫抑制性表现为细胞毒性淋巴细胞(cytotoxic T lymphocyte, CTL)数量少,T细胞上共抑制受体如程序性死亡受体1(programmed cell death 1, PD-1)和T细胞免疫球蛋白黏蛋白-3(T cell immunoglobulin mucin-3, TIM-3)上调,免疫抑制性细胞如髓系来源抑制细胞(myeloid-derived suppressor cells, MDSCs)和调节性T细胞(regulatory T cells,Tregs)增多[10]。相关研究[11,12]分析表明肉瘤样MPM中M2巨噬细胞和CD8+T淋巴细胞以及单核细胞和成纤维细胞的水平升高,上皮样MPM中自然杀伤细胞和CD4+T淋巴细胞以及CD20+B淋巴细胞比重大。MPM中上皮样和肉瘤样成分的比例与免疫反应相关,可预测预后和抗肿瘤药物的敏感性[13]。
在一项研究[11]中,当肿瘤被CD8+肿瘤浸润淋巴细胞(tumor infiltrating lymphocytes, TILs)和辅助性T细胞(helper T cell, Th)高度浸润时,MPM患者的生存期更长,相反,也有研究[12,14]表明较高CD8+TIL浸润的MPM患者化疗反应更低、预后更差,可能与CD8+TIL中较高的PD-L1表达相关;M2巨噬细胞比例高是上皮样MPM的阴性预后因素[15]。
组织学和微环境异质性之间的相互作用是MPM治疗的主要挑战,也可能是MPM目前治疗机会有限的主要原因之一。
3 免疫检查点抑制剂
目前ICIs靶向的两条主要途径是CTLA-4/B7和PD-1/PD-L1轴[2],临床上经常使用的ICIs包括CTLA-4抑制剂Ipilimumab和Tremelimumab,PD-1抑制剂Nivolumab和Pembrolizumab以及PD-L1抑制剂Durvalumab、Avelumab和Atezolizumab。
部分ICIs已经应用在MPM临床治疗中。根据MERIT试验结果,日本于2018年批准了Nivolumab作为间皮瘤的挽救疗法。III期临床试验Checkmate 743研究首次证明与化疗相比,Nivolumab联合Ipilimumab的一线治疗可为晚期MPM患者提供长期OS获益[16],据此,美国食品药品监督管理局(Food and Drug Administration, FDA)批准Nivolumab联合Ipilimumab作为晚期MPM的初始疗法。
3.1 MPM中ICIs作为挽救性治疗的临床试验 MPM患者标准一线治疗方案的mOS只有约12.1个月[17],进展后的二线治疗疗效更差强人意。因此迫切需要新的挽救疗法。ICIs作为挽救性治疗的试验结果(表1)为复发或进展的MPM患者带来了新曙光。
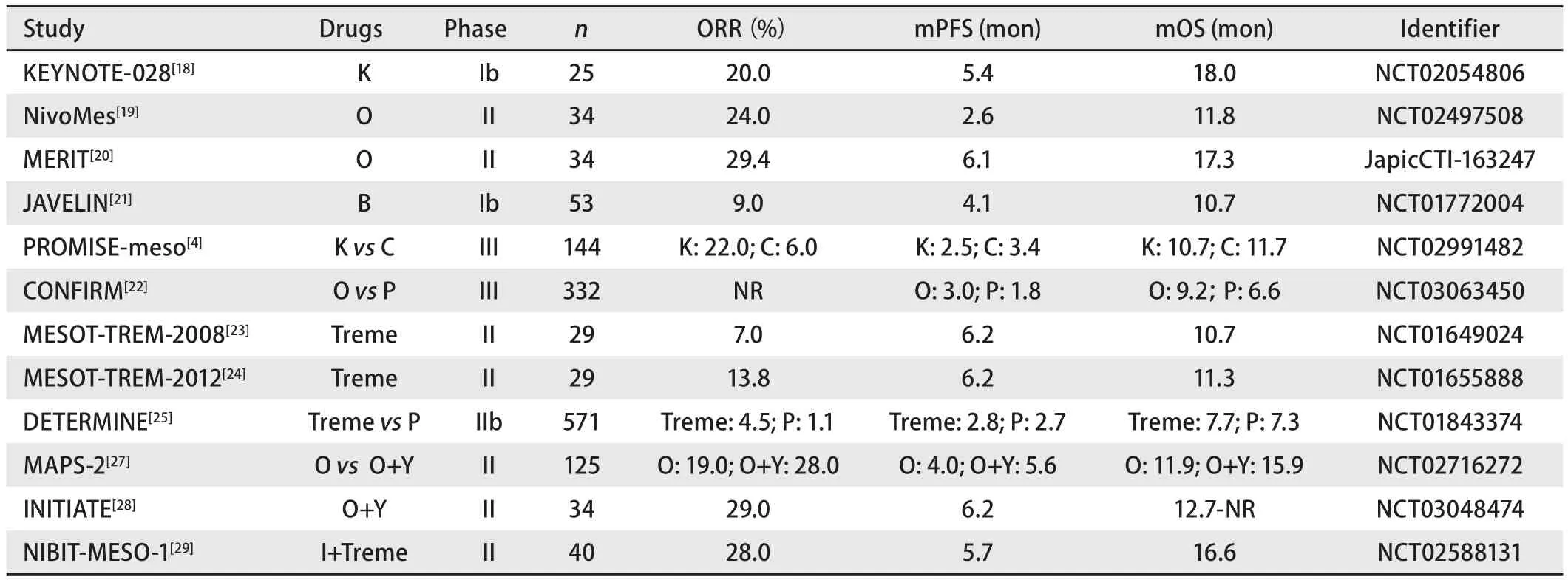
表1 MPM中ICIs挽救性治疗的临床试验Tab 1 Salvage therapy checkpoint inhibitor trials in MPM
3.1.1 PD-1/PD-L1抑制剂单药临床试验 KEYNOTE -028研究首次对Pembrolizumab单药治疗进行了评估,该研究纳入25例PD-L1表达阳性(TPS≥1%)的患者,疗效数据显示客观缓解率(objective response rate, ORR)为20%,疾病控制率(disease control rate, DCR)为72%,mOS和中位无进展生存期(median progression-free survival, mPFS)分别为18个月和5.4个月,结果令人鼓舞[18]。然而,同期的NivoMes、MERIT、JAVELIN研究结果并不亮眼,此3项研究均未将PD-L1表达纳入患者筛选标准。NivoMes试验[19]表明PD-L1表达与ICIs治疗反应率之间无明显相关性;MERIT试验[20]表明PD-L1表达阴性(TPS<1%)的患者也获得了临床益处;JAVELIN研究结果[21]显示PD-L1表达不同(阈值为5%),ORR和OS也不同。
III期随机试验PROMISE-meso结果令人失望,该研究比较了Pembrolizumab与单药化疗(吉西他滨或长春瑞滨)作为二线治疗的疗效。尽管Pembrolizumab的ORR为22%,化疗组为6%,但Pembrolizumab的mPFS为2.5个月,化疗组为3.4个月,未能显示出PD-1治疗的优越性。但是发现了对Pembrolizumab的长期应答者[4],再次说明了解哪些患者受益于PD-1抑制剂治疗的重要性。
另一项以Nivolumab单药治疗的III期CONFIRM研究结果可喜,该研究报告了Nivolumab治疗使上皮样MPM患者死亡风险相对下降29%,Nivolumab同时增加了PFS和OS获益;上皮样亚组中Nivolumab和安慰剂组的mOS分别为9.4个月和6.6个月(HR=0.71,P=0.021),上皮样MPM患者OS获益显著;该研究表明PD-L1表达对Nivolumab治疗OS无预测价值,但组织学类型可能有预测价值[22]。
3.1.2 CTLA-4抑制剂单药临床试验 至今为止,单药CTLA-4抑制剂的临床研究有3项。最初,II期MESOTTREM-2008[23]和MES OT-TREM-2012[24]试验显示了有希望的结果,因此开始进行以Tremelimumab单药治疗的随机对照试验DETERMINE,该试验结果显示mPFS和mOS未能显著超越安慰剂组,结果令人失望[25]。
3.1.3 联合应用免疫检查点抑制剂的临床试验 Ning等[26]研究表明CTLA-4抑制剂可诱导T细胞增殖和产生新的抗肿瘤T细胞反应,PD-1/PD-L1抑制剂可恢复现有的T细胞抗肿瘤功能,鉴于联合应用ICIs有较好的理论基础,几项临床试验研究了MPM中ICIs联合治疗的可能性。
II期MAPS-2试验表明单用Nivolumab或联合应用Ipilimumab和Nivolumab都有临床意义,两组患者的DCR分别为40%和52%,ORR分别为19%和28%,mOS分别为11.9个月和15.9个月,但是联合治疗组的药物相关不良事件比例略高;同时该研究报告了由于免疫疗法引起的超进展(hyperprogressive disease, HPD)[27],此结果有待深究。
INITIATE试验中也观察到了Ipilimumab+Nivolumab组合的临床活性,ORR为29%,mPFS为6.2个月,但是联合治疗的毒性更大,有94%的患者发生了不良事件,但大多数副作用易于控制,且未观察到5级毒性[28]。
NIBIT-MESO-1试验[29]是Dur va lumab联合Tremelimumab的研究,ORR为28%,DCR为65%,mOS为16.6个月,17.5%的患者出现了3级-4级与治疗相关的副作用,不良事件较MAPS-2研究少。
3.2 MPM中ICIs作为一线治疗的临床试验 为进一步提高MPM患者对ICIs治疗的应答率,将ICIs移至一线治疗,并与不同靶点ICIs组合,或将其与化学疗法相结合,从而更有效的恢复免疫系统活力的临床试验(表2)值得期待。
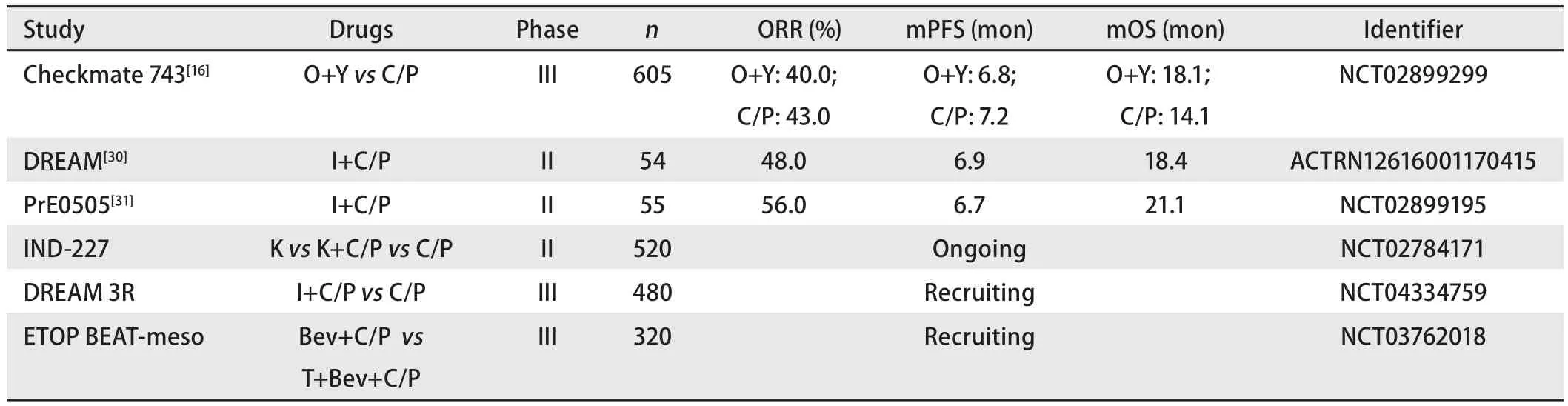
表2 MPM中ICIs一线治疗的临床试验Tab 2 Front-line checkpoint inhibitor trials in MPM
近期,Checkmate 743临床试验报告了Ipilimumab+Nivolumab组和化疗组的mOS分别为18.1个月和14.1个月(HR=0.74,P=0.002),其中上皮型和非上皮型患者的mOS基本相当(18.7个月vs18.1个月),因此无论组织学类型如何,较化疗组,双免疫治疗均能给MPM患者带来生存获益且不良反应发生率更低;其中非上皮样患者疗效更高,OS增益有显著差异;PD-L1表达阳性(TPS≥1%)的患者OS获益更大[16]。
目前,多项ICIs联合化疗的临床研究正在进行或等待评估:如IND-227研究,将化疗与Pembrolizumab联合,探讨一线治疗中Pembrolizumab的价值;基于II期DREAM[30]和PrE0505[31]试验令人欣喜的结果,启动了DREAM3R研究探讨在基于铂的标准疗法中加入Durvalumab与标准化疗的效果;鉴于最近的研究表明贝伐珠单抗在MPM一线治疗中具有疗效,ETOP BEAT-meso试验比较了贝伐珠单抗+卡铂+培美曲塞三联疗法与贝伐珠单抗+Atezolizumab+卡铂+培美曲塞四联疗法治疗新诊断MPM患者的疗效。
3.3 MPM中PD-L1表达及其意义 MPM微环境中多种成分可以表达PD-L1,包括肿瘤细胞和浸润的免疫细胞。一项荟萃分析[32]表明PD-L1高表达是MPM患者OS而非PFS的阴性预后因素。肿瘤细胞PD-L1表达与MPM中间质TILs的浸润有关,与肿瘤细胞PD-L1高表达相比,间质TILs中PD-L1高表达与临床治疗反应的相关性更强[26]。有研究[14,33]表明肉瘤样MPM侵袭性更强,化疗反应更低,更易受益于免疫疗法,可能与肉瘤样亚型中PD-L1+CD8+TIL数量较多有关。
Checkmate 743研究[34]报告了双免疫治疗一定程度上逆转了PD-L1的负面预后作用,提示PD-L1表达可能是双免疫治疗的有效预测因素。Terra等[35]研究表明PD-L1表达在治疗过程中可能会发生变化,或许限制了抗PD-L1治疗的疗效。ICIs治疗的敏感性可能与PD-L1表达有关,但是部分临床试验表明PD-L1表达低的患者也可从ICIs治疗中受益。
总之,PD-L1作为MPM治疗的预测性生物标志物一直存在争议。PD-L1表达检测阈值的不同、MPM组织学异质性和微环境异质性以及其他免疫抑制和激活因素(例如TILs、Tregs、炎症、HLA分型和微生物组成成分[36]等)限制了PD-L1被用作ICIs治疗MPM的预测性生物标志物。
3.4 其他潜在的免疫检查点抑制剂靶点 鉴于MPM的肿瘤异质性,靶向CTLA-4和PD-1/PD-L1轴的抑制剂仅可为部分患者带来长期生存获益,因此与治疗相关的其他共抑制和共刺激分子,例如:VISTA[8]、TIM-3[37]、淋巴细胞激活基因3(lymphocyte-activation gene 3, LAG-3)[38]、T细胞共刺激因子OX40(TNFRSF4)及其配体OX40L(TNFSF4)[39]以及诱导型T细胞共刺激物(inducible T-cell costimulatory,ICOS)[40],正在研究中,以期为更多MPM患者带来新的免疫治疗希望。
4 总结
晚期MPM的ICIs治疗已经取得了期待已久的进步,为患者提供了除标准化疗以外更多的治疗选择。但是,生物标志物PD-L1的表达在预测ICIs治疗MPM疗效中的作用有限。鉴于ICIs治疗仅可为部分患者带来长期生存获益,需要进一步研究和探索可以预测治疗效果的生物标志物,以期实现个体化精准治疗。
