3株临床分离产OXA-232碳青霉烯耐药肺炎克雷伯菌的流行病学分析*
2021-07-02付宏煜谢小芳范银银朱志宸徐塑凯杜鸿苏州大学附属第二医院检验科江苏苏州215004
付宏煜,谢小芳,范银银,朱志宸,徐塑凯,杜鸿(苏州大学附属第二医院检验科,江苏苏州215004)
肠杆菌科细菌对碳青霉烯耐药主要的机制是产KPC(Ambler A类)、NDM、VIM和IMP(B类)[1]和OXA-48样(D类)β-内酰胺酶[2]。产OXA-48样碳青霉烯酶肠杆菌科在不同生态系统中的快速传播给临床带来巨大挑战[3]。目前已报道的OXA-48样碳青霉烯酶包括OXA-48[4]、OXA-162[5]、OXA-181[6]、OXA-204[7]、OXA-232[8]、OXA-244[9]、OXA-245[9]、OXA-247、OXA-436、OXA-484、OXA-519。其中,OXA-232在中国最普遍[10],与国外常见OXA-48样酶的流行趋势不同[11]。近年来,OXA-232样肠杆菌科在中国开始出现[12-13],以肺炎克雷伯菌最为常见。我国不同地区产OXA-232肺炎克雷伯菌(OXA-232-producingK.pneumoniae,OXA-232Kp)的分子流行病学特征与遗传环境所知甚少。
OXA-232Kp的克隆性传播多次在上海[10,14]、浙江[15]报道,尚未发现OXA-232Kp在江苏地区的报道。本文首次调查江苏地区临床OXA-232Kp的流行病学特征,包括药敏分析、耐药基因检测、克隆性及质粒的相关性。
1 材料与方法
1.1菌株来源 收集2018年9月至2019年9月江苏地区5家医院(盐城市第一人民医院、苏州大学附属第二医院、苏州市立医院、张家港市第一人民医院和苏州市吴中人民医院)临床连续分离的非重复碳青霉烯耐药肺炎克雷伯菌(carbapenem-resistantKlebsiellapneumoniae, CRKP)菌株,根据2020年美国临床和实验室标准化协会(Clinical and Laboratory Standards Institute,CLSI)指南M100,亚胺培南、美罗培南和厄他培南最低抑菌浓度(minimum inhibitory concentration,MIC)>2 μg/mL为耐药,至少对其中一种药物耐药的肺炎克雷伯菌判定为CRKP。用基质辅助激光解吸电离飞行时间质谱(matrix-assisted laser desorption ionization time-of-flight mass spectrometry,MALDI-TOF MS)进行菌种鉴定。质控菌株肺炎克雷伯菌ATCC BAA-1705和ATCC BAA-1706、大肠埃希菌J53由本实验室保存。
1.2主要仪器与试剂 MALDI-TOF MS仪(德国Bruker公司),Phoenix-M50全自动细菌鉴定仪及配套药敏板卡、琼脂糖凝胶核酸电泳仪、凝胶成像系统分析仪(美国Bio-Rad公司),PCR扩增仪(美国Applied Biosystems公司),NanoDrop 2000超微量分光光度计(美国Thermo公司),麦氏比浊仪(法国生物梅里埃公司);胰蛋白胨、酵母提取物(美国Oxoid公司),琼脂粉(美国VETEC公司),琼脂糖凝胶粉(西班牙BIOWEST公司),DL2000分子质量标准(日本TaKaRa公司),美罗培南、亚胺培南(干粉,中国BIOSHARP公司),生理盐水、氯化钠、异丙醇、甘油(国药集团),SYBR Green PCR Master Mix(美国Applied Biosystems公司),低温台式高速离心机(Eppendorf Biophotometer公司),DNA试剂盒、质粒Mini 试剂盒(OMEGA公司),Illumina MiSeq平台(美国Illumina公司)。
1.3药敏试验 用Phoenix-M50全自动细菌鉴定仪配套的革兰阴性杆菌药敏板测定菌株对常见抗菌药物的MIC值。药敏结果根据2020年CLSI-M100标准进行判读。
1.4碳青霉烯酶表型检测 根据2020年CLSI-M100指南,采用改良碳青霉烯酶灭活试验(mCIM),同时设置浸没于无菌TSB肉汤的美罗培南抗菌药物纸片和干燥的美罗培南抗菌药物纸片作为空白对照;质控菌株肺炎克雷伯菌ATCC BAA-1705 和ATCC BAA-1706菌悬液的美罗培南抗菌药物纸片分别为阳性对照和阴性对照,检测结果根据CLSI标准判读。
1.5耐药基因检测 PCR技术扩增碳青霉烯酶表型试验阳性菌株blaOXA-48-like基因(blaOXA-232,blaOXA-48,blaOXA-181)。引物序列见文献[16],由上海生工公司设计合成。DNA模板制备:取分纯后长出的菌落溶于100 μL的EP管中,混匀后置于100 ℃的水中煮沸15 min,取出EP管静置冰上5 min,20 000 r/min离心2 min,取上清液1.5 μL作为DNA模板。PCR反应体系共15 μL,包括模板DNA 1.5 μL,上、下游引物(10 μmol/L) 各0.75 μL,2×PCR mixture 7.5 μL,dd H2O 4.5 μL。PCR反应参数:95 ℃预变性10 min;95 ℃变性30 s,60 ℃退火40 s,72 ℃延伸60 s,35个循环;72 ℃延伸7 min。将质控菌株肺炎克雷伯菌ATCC BAA-1706作为阴性对照,扩增阳性产物由上海Sangon公司用3730xl 测序仪进行Sanger法测序。测序过程如下:醋酸钠/乙醇法纯化PCR产物;使用TSR溶解纯化后的PCR产物并置于95 ℃热变性2 min;按测序仪操作说明书安装毛细管,进行毛细管位置的校正,人工手动灌胶(至测序仪)和建立运行的测序顺序文件;仪器自动灌胶至毛细管,1.2 kV预电泳5 min,按编程次序自动进样,再1.2 kV预电泳20 min后,7.5 kV电泳2 h;仪器自动分析电泳结果并输出测序序列。测序结果与 GenBank的原序列进行比对。
1.6质粒接合转移 将待测菌株与受体菌J53的单菌落分别接种1 mL LB液中(含抗菌药物以抑制杂菌),置于37 ℃、250 r/min的摇床上震荡过夜,分别以体积比1∶100转接种于1 mL新鲜LB,培养3~4 h至对数期,将无菌滤纸片紫外照射30 min,平铺于普通琼脂平板上,取供、受体各100 μL混匀滴在滤纸片,37 ℃温箱培养2 h,1 mL LB洗脱。吸取50~100 μL洗脱液均匀涂布于美罗培南和叠氮钠的双抗性平板,37 ℃培养过夜,通过PCR技术确定接合子是否含有目的基因,同时通过MALDI-TOF MS仪对接合子进行菌种鉴定。
1.7多位点序列分型(multilocus sequence typing,MLST) 使用文献报道的引物序列、反应体系及反应参数[17],PCR法扩增肺炎克雷伯菌rpoB、infB、phoE、mhd、pgi、gapA、tonB7个管家基因。扩增产物由上海Sangon公司3730xl测序仪进行Sanger法测序,测序结果与http//www.mlst.net上公布的相应等位基因序列比较,获得该菌株7个管家基因的等位基因谱,提交 MLST网站,确定临床分离株的序列分型(sequence type,ST)。
1.8脉冲场凝胶电泳(pulsed field gel electrophoresis,PFGE) 为确定OXA-232Kp菌株的同源性,对OXA-232Kp分离株进行限制性内切酶XbaⅠ的PFGE,如文献[18]所述。利用Gel J软件相似系数分析PFGE模式。PFGE图谱中具有≥85%的遗传相似性或少于4个片段差异的菌株被认为是同一克隆(类型)。菌株(型)与原菌株差异≤3个片段的菌株(型)认为是暴发菌株的一个亚型。
1.9质粒的提取与序列分析 质粒试剂盒提取含blaOXA-232基因的质粒菌株的质粒,Illumina MiSeq平台测序分析,SPAdes软件对序列拼接,通过plasmidfinder网站比对获取质粒复制子型。
2 结果
2.1OXA-232肺炎克雷伯菌 共收集78株CRKP菌株,2株菌株(K.PN6655和K.PN6703)疑似blaOXA-48-like阳性,1株菌株(K.PN6665)疑似blaOXA-232阳性,电泳结果见图1。将3株疑似阳性产物送上海生工测序,序列在NCBI Blast比对,结果显示3株菌株均携带blaOXA-232基因。

注:A,OXA-48扩增产物电泳分析;B,OXA-232扩增产物电泳分析。K.PN6655、K.PN6703、K.PN6703,待测菌株;ATCC BAA-1706,阴性对照;M,DL 2000 marker。
2株OXA-232Kp菌株来自痰液(66.7%),1株来自泌尿道(33.3%),其中有2株肺炎克雷伯菌(K.PN6655和K.PN6703)来自于同一患者,但该患者在2次不同的住院期间感染肺炎克雷伯菌。3株OXA-232Kp对头孢菌素类、氨曲南、复方磺胺甲噁唑、喹诺酮类药物均耐药,2名患者出院前经哌拉西林-他唑巴坦、阿米卡星、头孢他啶、庆大霉素等治疗后恢复。
所有菌株mCIM表型呈阳性。3株OXA-232Kp可同时产超广谱β-内酰胺酶(ESBL)。所有菌株药敏结果、基因型及临床转归见表1。
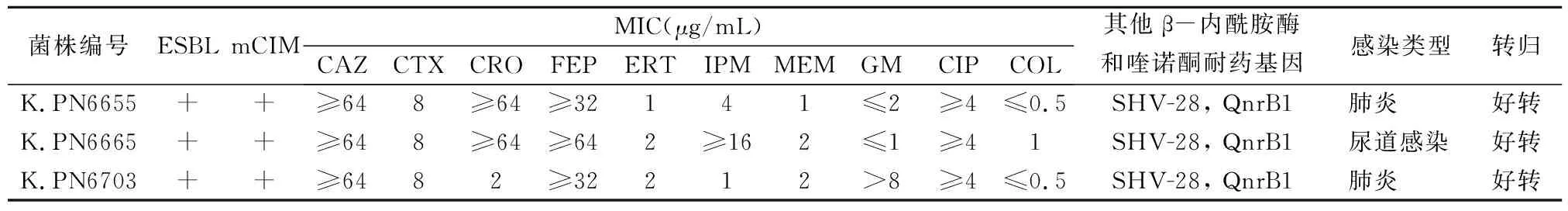
表1 3株OXA-232Kp菌株的药敏结果、基因型及临床转归
MLST分析均属于ST15型,基于Gel J分析≥85%的基因连锁率,分离菌株属于同一克隆,PFGE图像见图2。

图2 OXA-232Kp菌株PFGE分析
2.2携带blaOXA-232基因的质粒周围环境 3株菌株质粒均不能发生转移,提示该质粒为非接合质粒。质粒测序表明,携带blaOXA-232基因的接合子呈现6 141 bp的质粒,属于ColKp3型,blaOXA-232基因位于一个Tn2013-like基因转位单元,见图3。
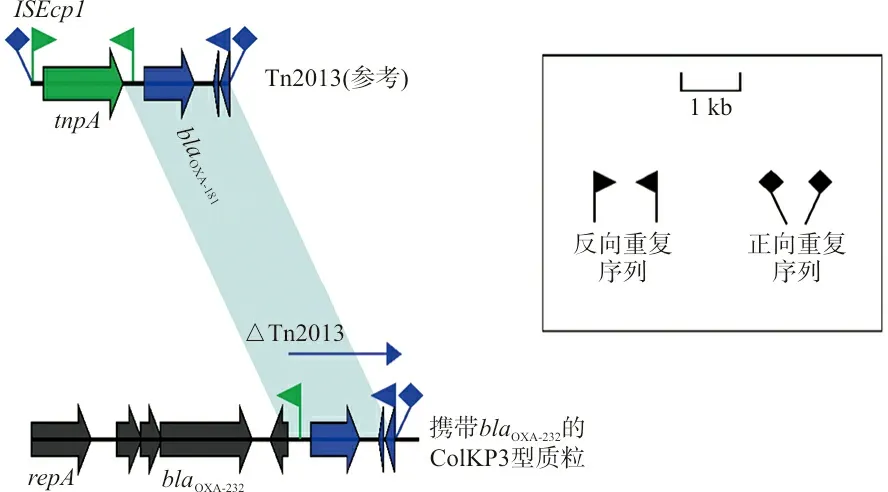
注:阴影部分表示重叠区域。
Blast分析发现,该质粒与曾在中国东部报道的携带blaOXA-232的质粒pkNICU5(GenBank accession no.KY454616)质粒周围环境相同。全基因组测序分析,3株菌株同时携带多种耐药基因RmtF、Arr-2,携带rmpA2、icu1相关毒力基因位于毒力质粒上,血清分型属KL112型,见表2。

表2 OXA-232Kp菌株的携带耐药、毒力基因与血清、质粒分型
3 讨论
目前,中国是世界上CRE流行较高的国家,除碳青霉烯类酶外,ESBL的产生,特别是CTX-M-15和/或AmpC的产生,以及外膜孔蛋白(OMP)的丢失,都可能导致肺炎克雷伯菌对碳青霉烯类药物耐药。目前已有大量文献研究产KPC/NDM碳青霉烯耐药肺炎克雷伯菌的耐药特征与机制[19]。近几年携带OXA-48样碳青霉烯酶的肺炎克雷伯菌在中国出现,并出现院内暴发的案例[20]。
OXA-232是目前全球第3种常见的OXA-48样碳青霉烯酶,首次报道在大肠埃希菌和肺炎克雷伯菌中,分离的大肠埃希菌对所有β-内酰胺类(不包括亚胺培南、厄他培南和美罗培南)、氟喹诺酮类、氨基糖苷类、磺胺类和四环素不敏感,肺炎克雷伯菌分离株具有类似的药敏模式,但对碳青霉烯类药物具有耐药性。其耐药特征与本研究中3株OXA-232Kp菌株耐药模式基本类似。据报道,blaOXA-232基因通常位于ISEcp1的下游Tn2013转座元件6 141 bp的ColE型质粒上,属于ColKP3型流行质粒,是blaOXA-232基因在全球传播的主要原因[11]。本研究中OXA-232Kp菌株对碳青霉烯类药物具有低水平的抗性。所有菌株携带blaOXA-232基因的6 141 bp ColKP3型质粒,该质粒与中国东部其他研究发现的携带blaOXA-232基因的质粒高度同源[14],且无法完成接合转移,推测是非接合质粒。全球范围内几乎所有携带blaOXA-232基因的菌株携带pOXA-232样质粒(与pOXA-232高度相似或相同的质粒)。结构上除Tn2013在ISEcp1的5′端有一个大的缺失,blaOXA-232与blaOXA-181基因的遗传环境非常相似,区别在于一个核苷酸取代(A642T)导致一个氨基酸改变(Arg214Ser)。ISEcp1转座酶活性的缺失最有可能使blaOXA-232稳定在pOXA-232样质粒上。迄今为止,Tn2013是唯一报道与blaOXA-232基因相关的遗传环境的转座子。
世界各地曾报道携带blaOXA-232基因的pOXA-232质粒的肺炎克雷伯菌引起的医院暴发,与blaOXA-232相关的肺炎克雷伯菌ST15是中国常见的STs之一,例如,ST15型肺炎克雷伯菌在中国医院重症监护病房(ICU)和新生儿ICU病区的传播[21]。大多数OXA-232Kp菌株共同产生CTX-M-15和NDM-1[22]。导致中国NICU暴发的OXA-232Kp(ST15型)也含有不同毒力相关基因的高毒质粒(即pLVPK样IncHI1B/IncFIB质粒),包括rmpA2[23]。本研究中筛选出2018—2019年江苏地区3株ICU病区分离的OXA-232Kp,MLST分型均属于ST15型, PFGE分析显示同一医院内的克隆性传播。全基因组测序表明,3株OXA-232Kp菌株同时表达CTX-M-15与NDM,同时携带icuA、rmpA2等毒力相关基因,荚膜血清分型KL112型。
综上所述,本文首次调查江苏地区临床OXA-232Kp(ST15型)的流行病学数据。携带blaOXA-232基因的质粒具有高度的同源性,表明该6 141 bp的ColE型质粒对blaOXA-232基因在中国的流行具有重要作用。
