基于“肠-肾”途径的健脾祛湿中药抗痛风病研究
2021-07-01王雨褚梦真李文静林志健张冰
王雨 褚梦真 李文静 林志健 张冰


摘要 目的:從“肠-肾”途径探讨健脾祛湿中药防治痛风病作用。方法:10%果糖塑造大鼠高血尿酸模型,高钙高嘌呤食饵并限水诱导鹌鹑尿酸盐沉积模型,以菊苣、参苓白术散为示例药。生化检测大鼠血清尿酸(SUA)、粪便尿酸(FUA)水平,计算肾脏尿酸清除率(RCUA);检测鹌鹑粪尿中尿酸含量,计算尿酸排泄量。免疫组化分析大鼠肠道ABCG2、肾脏URAT1、OAT1,及鹌鹑肠道Occludin、肾脏p-p65表达。六胺银染色分析尿酸盐沉积。结果:1)菊苣可显著降低模型大鼠SUA、增加FUA、RCUA,促进肠道ABCG2表达,减少肾脏URAT1表达。2)参苓白术散可显著减少模型鹌鹑肾脏尿酸盐沉积,增加尿酸排泄量,增加肠道Occludin表达,减少肾脏p-p65表达。结论:痛风病发生发展中存在“肠-肾”途径的病理改变,健脾祛湿中药通过调节“肠-肾”尿酸转运促尿酸排泄、改善肠道屏障功能及肾脏炎症状态以祛除尿酸盐沉积,共同发挥防治痛风病作用。
关键词 “肠-肾”途径;健脾祛湿中药;痛风病;高血尿酸;尿酸盐沉积
Study on Anti-gout Disease of Traditional Chinese Medicines for Invigorating Spleen and Removing Dampness Based on Intestine and Kidney Axis
WANG Yu,CHU Mengzhen,LI Wenjing,LIN Zhijian,ZHANG Bing
(School of Chinese Materia Medica,Beijing University of Chinese Medicine,Beijing 102488,China)
Abstract Objective:From the “intestine-kidney” axis to explore the anti-gout disease effect of traditional Chinese medicine for invigorating spleen and removing dampness.Methods:10% fructose created a rat model of high blood uric acid,a high-calcium,high-purine diet and water restriction induced quail urate deposition model,with Cichorium intybus L.and Shenlingbaizhu Powder as example drugs.Biochemical detection of rat serum uric acid(SUA)and fecal uric acid(FUA)levels were detected.The renal uric acid clearance(RCUA)was calculated; uric acid content in quail feces and urine were detected; uric acid excretion was calculated.Rat intestine ABCG2,kidney URAT1,OAT1,quail intestine Occludin,and kidney p-p65 expression were analyzed by Immunohistochemistry.Hexamine silver staining was used to analyze urate deposition.Results:1)Cichorium intybus L.could significantly reduce SUA level,increase FUA and RCUA levels of model rats,increase expression of intestinal ABCG2 and decrease expression of renal URAT1.2)Shenling Baizhu Powder could significantly reduce the renal urate deposition in quails,increase the excretion of uric acid,as well as raise expressions of intestinal Occludin and decrease expressions of renal p-p65.Conclusion:There are some pathological changes of ‘intestine-kidney axis in the development of gout disease.Traditional Chinese medicine for invigorating spleen and removing dampness could prevent and treat the gout disease by adjusting the urate transporters in the intestine and kidney to promote excretion of uric acid,and improving the intestinal barriers and renal inflammatory state to remove the urate deposition.
Keywords Intestine and kidney axis; Traditional Chinese medicine for invigorating spleen and removing dampness; Gout disease; Hyperuricemia; Urate deposition
中图分类号:R242;R285.5文献标识码:Adoi:10.3969/j.issn.1673-7202.2021.01.003
痛风病是指与高尿酸血症、尿酸盐沉积密切相关的进展性代谢性疾病,2020年《高尿酸血症/痛风患者实践指南》根据临床疾病状态,将痛风病理进展分为了3个阶段、8个状态[1],其中高血尿酸是痛风病发生的重要生化基础,尿酸盐沉积是诱发痛风病急性炎性反应的重要因素。由此提示,降低高血尿酸、减少尿酸盐沉积将有助于抑制痛风病的发生发展。中医学理论认为尿酸代谢异常引起的高血尿酸及其沉积属于“湿邪”“浊滞”范畴,临床常切入脾胃肠肾等器官以健脾化湿泄浊,取得了较好的疗效[2],本组前期也发现健脾祛湿药物对实验性高血尿酸亦有显著的降低作用[3-4]。现代研究显示,肠道与肾脏是参与尿酸排泄的关键器官,主要通过组织中分布的尿酸转运体介导了机体99%的尿酸外排[5]。同时,亦发现在痛风病的进展过程中均伴随着肠道及肾脏的病理变化[6-7],提示“肠-肾”可能是降低高血尿酸、减少尿酸盐沉积的重要靶器官。因此,本研究拟分别从痛风病高血尿酸阶段、尿酸盐沉积阶段着手,切入“肠-肾”途径,以中药菊苣及方药参苓白术散为示例药物,开展健脾祛湿中药抗痛风病的系统观察。
1 材料与方法
1.1 材料
1.1.1 动物
SD大鼠50只,雄性,体质量(240±10)g,购于斯贝福(北京)实验动物科技有限公司,动物合格证号为SCXK(京)2011-0004。迪法克鹌鹑30只,雄性,体质量(150±10)g,购于北京市种禽公司德岭鹌鹑厂,动物检疫合格证明号为1100375960。均于室温(23±1)℃,湿度(45±5)%,12 h光照条件下饲养5 d后开始实验。实验动物伦理审批号:BUCM-4-2019090302-3033。
1.1.2 药物
菊苣药材购于新疆市场,由本课题组分别以10倍、8倍水各回流提取1 h后收集滤液、浓缩,获得菊苣提取物。苯溴马隆片(德国赫曼大药厂,批号:1208106)。参苓白术散(山西华康药业股份有限公司,批号:Z14020346)。
1.1.3 试剂与仪器
果糖(AMRESCO公司,美国,批号:3573C350);酵母粉(Oxoid公司,英国,批号:1424987);骨粉(衡水爱宠商贸有限公司,批号:20180715);尿酸检测试剂盒(中生北控生物科技股份有限公司,批号:151221);ABCG2 Polyclonal Antibody(Santa Cruz公司,美国,批号:13041);URAT1 Polyclonal Antibody(ABBIOTEC公司,美国,批号:250521);OAT1 Polyclonal Antibody,Occludin Polyclonal Antibody,p-p65 Polyclonal Antibody(ABCAM公司,英国,批号:ab131087,ab168986,ab86299);兔超敏二步免疫组化检测试剂,DAB显色试剂盒,山羊血清(北京中杉金桥生物技术有限公司,批号:K162714G,16175A01,WK153622);尿酸盐染色试剂盒(六胺银染色法,北京索莱宝科技有限公司,批号:20180604)。
酶标仪(Teacan公司,瑞士,型号:Sunrise型);低温高速离心机(Sigma公司,德国,型号:3K15型);恒温水浴箱(北京医疗设备厂,型号:HH-600型);电子天平(岛津公司,日本,型号:B1-220H);石蜡组织切片机(AO公司,美国,型号:820型);Olmpus显微镜,CCD相机(奥林巴斯公司,日本,型号:BX53型,DP72型);生化培養箱(宁波江南仪器厂,型号:SPX型)。
1.2 方法
1.2.1 分组与模型制备
以大鼠为实验动物开展健脾祛湿示例中药菊苣降尿酸的作用研究,采用10%高果糖饮水塑造高尿酸血症大鼠模型[8]。以鹌鹑为实验动物开展健脾祛湿示例方药参苓白术散祛尿酸盐沉积的作用研究,在本实验室前期基础上[9],以常规饲料:酵母粉:骨粉=5∶2∶3制备造模食饵,结合控制日饮水量为15 mL/(只·d),连续40 d,诱导尿酸盐沉积鹌鹑模型。
1.2.2 给药方法
动物分组与给药如下:
根据体质量将SD大鼠随机分为正常组,高血尿酸模型组,苯溴马隆组,菊苣提取物大、小剂量组,每组10只。以预防性方式进行给药,正常组、高血尿酸模型组大鼠每日给予清水灌胃,苯溴马隆组给予20 mg/kg苯溴马隆,菊苣提取物大、小剂量组分别给予相应剂量的菊苣提取物灌胃(分别相当于生药量10 g/kg、7.5 g/kg)。
根据体质量将迪法克鹌鹑随机分为正常组、尿酸盐沉积模型组、参苓白术散组,每组10只。以治疗性方式进行给药,正常组、尿酸盐沉积模型组鹌鹑每日给予0.5%羧甲基纤维素钠溶液灌胃,参苓白术散组给予含2.1 g/kg参苓白术散的0.5%羧甲基纤维素钠溶液灌胃。
1.2.3 检测指标与方法
1)生化指标检测:分别于实验第20、40天对实验大鼠进行尾尖取血,取血前12 h禁食不禁水,以3 000 r/min离心10 min,离心半径8 cm,分离血清,根据尿酸检测试剂盒说明书检测血清尿酸水平(Serum Uric Acid,SUA)。取血前接取大鼠粪便,根据文献进行前处理[10-11],加入适当体积PBS混匀粪便,以4 000 r/min,离心10 min,离心半径13.5 cm,取上清,加入1/4体积的含碳酸锂的PBS,超声混匀后分别于100 ℃、37 ℃孵育30 min、2 h,以10 000 r/min在4 ℃条件下离心10 min,离心半径8 cm,取上清,生化检测粪便中尿酸水平,并根据公式(a)计算粪便尿酸含量(Fecal Uric Acid,FUA)。取血后采用代谢笼法收集24 h尿液,以4 000 r/min,离心半径8 cm,在4 ℃条件下离心10 min取上清,生化检测尿液中尿酸水平,根据公式(b)计算肾脏尿酸清除率(Renal Clearance Rate of Uric Acid,RCUA)。模拟大鼠代谢笼法收集尿液,对实验鹌鹑的6 h粪尿混合物进行收集,加入适量PBS混匀后,以4 000 r/min,离心10 min,离心半径13.5 cm,取上清,生化检测粪尿混合物中尿酸水平,并以血清尿酸水平进行校正,根据公式(c)计算尿酸清除量。
粪便尿酸含量(FUA,μmol/g)=尿酸水平×(PBS稀释倍数/粪便重量)×1.25。(a)
肾脏尿酸清除率(RCUA,mL/min)=尿液尿酸/血清尿酸×每分钟尿量。(b)
尿酸清除量=粪尿尿酸/血清尿酸。(c)
2)免疫组化染色与图片分析:实验结束后,断头处死实验动物(大鼠、鹌鹑),取小肠组织及肾脏组织,置于4%多聚甲醛溶液固定,用于制备组织石蜡切片。将组织石蜡切片于60 ℃烤片1 h,常规脱蜡复水,依次以0.01 mol/L柠檬酸钠缓冲溶液热修复30 min,3%H2O2避光孵育15 min,山羊血清封闭孵育10 min后滴加一抗(ABCG2:1∶200;URAT1:1∶100;OAT1:1∶1 000;Occludin:1∶1 000;p-p65:1∶1 000),置于湿盒内4 ℃孵育过夜。而后依次置于37 ℃复温孵育1 h,滴加聚合物辅助剂37 ℃湿温孵育1 h,滴加辣根酶标记抗兔IgG聚合物37 ℃湿温孵育1 h,DAB显色至染上棕色颗粒后终止,每步操作间均以PBS清洗3次×5 min。常规梯度乙醇脱水、二甲苯透明、中性树胶封片。
以Olmpus显微镜图像采集系统对每个组织3个不重叠的视野进行拍摄,Image J图像分析系统进行免疫组化染色结果分析,以阳性颗粒积分光密度IOD(Inergral Optical density)进行统计分析。
3)六胺银染色与与图片分析:实验结束后,断头处死实验鹌鹑,取肾脏组织置于无水乙醇固定,用于制备组织石蜡切片,采用六胺银特殊染色法对组织切片中的尿酸盐沉积进行染色。将组织切片依次用二甲苯、无水乙醇脱蜡后,浸入62 ℃预热的六胺银溶液中,以62 ℃恒温避光孵育50 min,纯水冲洗悬浮黑色物质,依次入氯化金溶液、海波溶液浸泡2 min、5 min,纯水冲洗后以伊红淡染,无水乙醇脱水2次×5 min,二甲苯透明2次×10 min,中性树胶封片。
以Olmpus显微镜图像采集系统对每个组织3个不重叠的视野进行拍摄,Image J图像分析系统进行尿酸盐染色结果分析,以阳性面积Area进行统计分析。
1.3 统计学方法
采用SAS 9.0统计软件统计分析,数据采用均数±标准差(±s)表示,多组间数据比较根据各组正态及方差齐与否选择单因素方差分析或是Kruskal-Wallis轶和检验,组间两两比较根据方差齐与否选择采用Dunnett-t检验或Dunnett′s T3检验,以P<0.05为差异有统计学意义。
2 结果
2.1 健脾祛湿示例中药调控“肠-肾”途径降尿酸作用观察
2.1.1 菊苣提取物对血清尿酸水平的影响
与正常组比较,实验第20、40天,高血尿酸模型组大鼠的SUA水平均显著升高(P<0.01)。与高血尿酸模型组比较,实验第20、40天,菊苣提取物大、小剂量组大鼠及本溴马隆组大鼠的SUA水平均显著降低(P<0.01或P<0.05)。见表1。
2.1.2 菊苣提取物对“肠-肾”尿酸排泄水平的影响 与正常组比较,高血尿酸模型組大鼠的FUA、RCUA水平均显著降低(P<0.01或P<0.05)。与高血尿酸模型组比较,菊苣提取物大剂量组大鼠的FUA、RCUA水平均显著升高(P<0.05);菊苣提取物小剂量组大鼠的FUA水平显著升高(P<0.05),RCUA水平有升高趋势(P=0.07);苯溴马隆组大鼠的FUA水平差异无统计学意义,RCUA水平有升高趋势(P<0.05)。见表2。
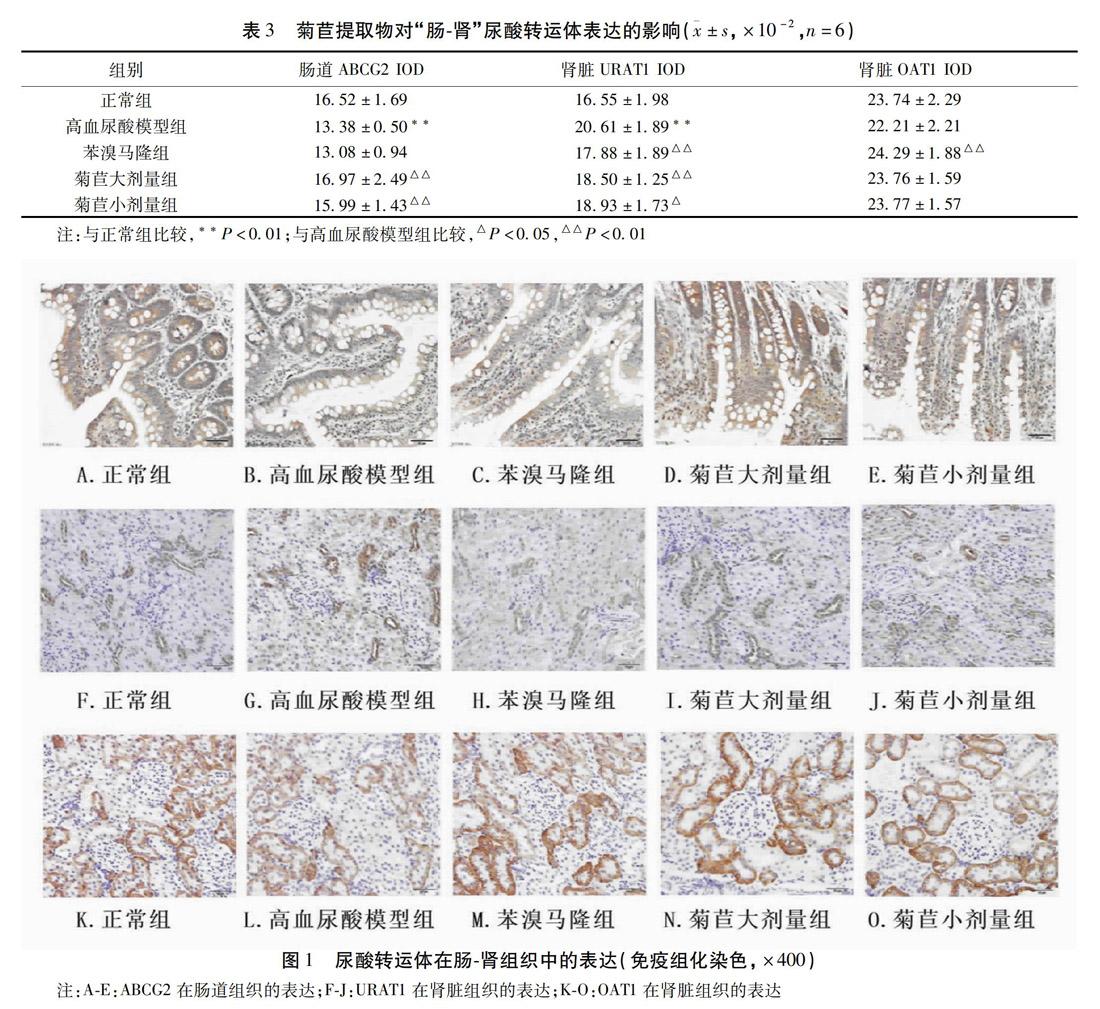
2.1.3 菊苣提取物对“肠-肾”尿酸转运体表达的影响
“肠-肾”尿酸转运体的免疫组化染色结果如图1所示,半定量分析结果显示:与正常组比较,高血尿酸模型组大鼠的肠道ABCG2表达显著减少(P<0.01),肾脏URAT1表达显著增加(P<0.01),肾脏OAT1表达有增加趋势(P=0.059)。与高血尿酸模型组比较,菊苣提取物大、小剂量组大鼠的肠道ABCG2表达显著增加(P<0.01)、肾脏URAT1表达均显著减少(P<0.01或P<0.05)、肾脏OAT1表达均有增加趋势(P=0.059或P=0.056);苯溴马隆组大鼠的肠道ABCG2表达差异无统计学意义,肾脏URAT1表达显著减少(P<0.01),肾脏OAT1表达显著增加(P<0.01)。见表3。
2.2 健脾祛湿示例方药调控“肠-肾”途径祛尿酸盐沉积作用观察
2.2.1 参苓白术散对尿酸盐沉积水平的影响
尿酸盐沉积的六胺银染色结果如图2所示,正常组鹌鹑肾脏中未见明显的黑色尿酸盐沉积,尿酸盐沉积模型组及参苓白术散组鹌鹑肾脏中可见明显的黑色尿酸盐沉积。半定量分析结果显示,与尿酸盐沉积模型组比较,参苓白术散组鹌鹑肾脏中尿酸盐沉积水平显著减少(P<0.01)。见表4。
2.2.2 参苓白术散对“肠-肾”尿酸清除量的影响
与正常组比较,尿酸盐沉积模型组鹌鹑的肠-肾尿酸清除率显著降低(P<0.01)。与尿酸盐沉积模型组比较,参苓白术散组鹌鹑的肠-肾尿酸清除率有升高趋势(P=0.064)。见表5。
2.2.3 参苓白术散对肠道屏障功能及肾脏炎性反应的影响
肠道屏障紧密结构的关键蛋白Occludin及肾脏炎性反应关键蛋白p-p65的免疫组化染色结果如图3所示,半定量分析结果显示:与正常组比较,尿酸盐沉积模型组鹌鹑的肠道Occludin表达显著减少(P<0.01),肾脏p-p65表达显著增加(P<0.01)。与尿酸盐沉积模型组比较,参苓白术散组鹌鹑肠道Occludin表达显著增加(P<0.05),肾脏p-p65表达显著减少(P<0.01)。见表6。
3 讨论
3.1 “肠-肾”途径在痛风病疾病进展中的作用
痛风病是指与高尿酸血症、尿酸盐沉积密切相关的进展性代谢性疾病。2020年《高尿酸血症/痛风患者实践指南》突破对关节痛风的局限认识,提出高血尿酸和痛风性关节炎是同一疾病的不同状态,并进一步根据其临床表现,将其分为了临床前阶段、临床阶段及病程阶段,3个阶段依次包括了无症状高尿酸血症、无症状尿酸盐沉积、无症状高尿酸血症伴尿酸盐沉积、痛风、痛风石性痛风、侵蚀性痛风、初次痛风发作、复发型痛风发作8个状态,且上述不同疾病状态可同时出现[1],充分体现了痛风病的进展性、反复性的临床特点。其中,高血尿酸及尿酸盐沉积贯穿了痛风病发生发展发作的始终,且二者在疾病进程中存在相互转化、促进,血尿酸的持续升高可促进尿酸盐饱和析出,尿酸盐结晶的聚集沉积可诱发组织损伤,使得血尿酸水平进一步升高。由此可见,高血尿酸及尿酸盐沉积的共性病理环节探讨将是痛风病防治的重要方向。
机体内的尿酸稳态取决于尿酸生成与排泄的动态平衡,尿酸生成增多和/或排泄减少均会引起血尿酸水平的异常升高。流行病学研究显示,90%的原发性血尿酸水平的升高与尿酸排泄障碍密切相关[11]。肠道与肾脏是尿酸排泄的主要器官,其中肾脏尿酸排泄量占机体尿酸排泄总量的66%,肠道尿酸排泄量占机体尿酸排泄总量的33%[12]。本研究在10%高果糖诱导的大鼠高血尿酸模型中观察到了粪便尿酸含量、肾脏尿酸清除率的显著降低,这与本组前期结果趋势一致[13-14],再次明确了“肠-肾”排泄途径对维持机体内尿酸稳态的关键作用。“肠-肾”尿酸的外排功能主要依赖于尿酸转运体来实现,主要包括介导肠道尿酸外排转运的腺苷三磷酸结合转运蛋白ABCG2(ATP-binding Cassette of Half-transporter Protein),介导肾脏尿酸重吸收转运的葡萄糖转运体9(Glucose Transporter 9,Glut9)、尿酸盐阴离子转运体1(Urate Anion Transporter,1URAT1)、有机阴离子转运体4(Organic Anion Transporter,4OAT4),介导肾脏尿酸分泌的有机阴离子转运体家族成员1(Organic Anion Transporter 1,OAT1)、成员3(Organic Anion Transporter 3,OAT3)、尿酸盐转运体(Urate Transporter,UAT)[15]。本研究分别选取“肠-肾”尿酸排泄途径中的关键转运蛋白,对高果糖诱导的高血尿酸大鼠肠、肾尿酸排泄的异常进行观察。结果显示,高血尿酸模型组大鼠的肠道ABCG2蛋白表达显著降低,肾脏URAT1蛋白表达显著增加,肾脏OAT1蛋白表达有降低趋势,这与现代研究发现具有一致性,同时提示高果糖诱导的高血尿酸大鼠模型可为作用于“肠-肾”途径的降尿酸药物研究提供动物模型载体。
尿酸盐沉积是血尿酸过饱和析出的直接结果,亦是诱发痛风病急性炎性反应的必要因素。由于关节痛风红肿热痛的显著临床表现,尿酸盐在关节腔及其周围组织的沉积受到学者的广泛研究,而对于其在肾脏组织中的沉积往往是进展到痛风石形成后才受到关注,这可能与内脏组织痛觉神经不敏感,以及尿酸盐内脏沉积临床诊疗手段不足有关。目前尿酸盐沉积研究亦受到动物模型的局限,由于常用于实验研究的啮齿类动物存在可迅速分解尿酸的尿酸酶,与人类尿酸代谢途径存在较大差异,其尿酸水平的升高往往难以实现内源性尿酸盐沉积。鉴于此,本研究选取与人类尿酸代谢途径相似的禽类动物鹌鹑,在前期高嘌呤饮食诱导高尿酸血症鹌鹑模型的基础上,结合高钙及限水饮食进一步促进血尿酸水平的升高,观察到了尿酸盐在鹌鹑肾脏组织中的首要沉积。结合尿酸盐的致炎作用[16],本研究对痛风病相关的NF-κB炎症信号通路中的关键蛋白即p65的磷酸化水平进行了检测,免疫组化染色结果显示,尿酸盐沉积模型组鹌鹑的肾脏组织中p-p65蛋白表达显著增加。此外,我们亦对肠道组织中尿酸盐沉积进行了考察,然而并未发现尿酸盐的沉积,这可能与肠道管腔性结构及肠道菌群对尿酸的分解作用有关[17],但显著观察到了肠道组织中Occludin蛋白表达的降低。Occludin蛋白是组成肠道屏障紧密连接结构的代表性咬合蛋白之一,肠道屏障紧密连接结构的完整是实现肠道正常生理功能的重要基础,其结构的异常会导致肠上皮细胞通透性的增加,使得细菌、内毒素及大分子有害物质进入血液循环,诱发疾病[18]。有研究发现高血尿酸状态下,肠道菌群及肠道机械屏障发生病理改变,革兰氏阴性菌细的代谢产物内毒素入血增加[19],而内毒素水平的升高正是肾脏损伤的重要诱导因素[20]。由此提示,痛风病尿酸盐沉积阶段存在独立于血尿酸之外的“肠-肾”途径病理改变,这可能与肠道通透性增加,肠源性毒素入血增加,干扰肾脏生理功能,诱导组织炎性反应有关,其具体机制有待于深入研究。
3.2 健脾祛湿中药干预“肠-肾”途径防治痛风病作用
中医认为血尿酸的升高及其沉积多由饮食不节,过食肥甘,阻碍脾运化功能,酿生湿浊痰饮而致[21]。现代医学对肠道的功能认识,与中医理论中“脾”的功能类似,并且肠道不仅有消化、吸收功能,还具排泄功能,这与中医理论中的小肠“泌别清浊”、大肠“主津”理论相一致。同时,肾主调节一身水液之代谢,脾主运化功能又有赖于肾阳的温煦和气化,肾不主水亦是湿浊为患的重要因素。因此,本研究结合健脾祛湿药物在临床及实验中降尿酸的优势作用,切入“肠-肾”途径,分别以健脾祛湿药菊苣、参苓白术散为示例藥物,对其降尿酸、祛沉积的防治痛风病作用进行系统观察。
菊苣是菊科植物毛菊苣或菊苣的干燥地上部分或根,功效清肝利胆、健胃消食、利尿消肿,归肝、胆、胃经。以菊苣提取物干预高血尿酸大鼠模型,结果显示,菊苣提取物可显著降低模型大鼠的血尿酸水平,并增加其粪便尿酸含量及促进肾脏尿酸清除,提示菊苣提取物对肠、肾尿酸排泄均有促进作用。同时,本研究亦观察到菊苣提取物可显著增加肠道ABCG2表达,减少肾脏URAT1表达,对肾脏OAT1亦有增加趋势,结合上述蛋白的生理功能,提示菊苣提取物可通过调控“肠-肾”尿酸转运体促进“肠-肾”尿酸排泄,发挥降尿酸作用。参苓白术散首载于《太平惠民和剂局方》[22],由人参、茯苓、白术、白扁豆等10味中药组成,具健脾益气、渗湿止泻之效用。以参苓白术散干预尿酸盐沉积鹌鹑模型,结果显示,参苓白术散可显著减少模型鹌鹑肾脏组织中的尿酸盐沉积,对粪尿尿酸排泄量的增加亦有促进趋势。同时,本研究亦观察到参苓白术散可显著增加肠道Occludin表达,并减少肾脏组织中p-p65表达,结合肠、肾组织在痛风病进展中的重要作用,提示参苓白术散可通过改善肠道屏障,减少有害物质进入血循环,并抑制肾脏炎性反应,从而发挥祛除尿酸盐沉积的作用。
综上所述,本研究分别从痛风病高血尿酸阶段、痛风病尿酸盐沉积阶段着手,明确了在痛风病发生发展中存在“肠-肾”途径的病理改变,并进一步以健脾祛湿示例药物进行干预,切入“肠-肾”途径,明确了健脾祛湿中药通过调节“肠-肾”尿酸转运促尿酸排泄、改善肠道屏障功能及肾脏炎症状态祛除尿酸盐沉积,从而实现防治痛风病的作用。
参考文献
[1]黄叶飞,杨克虎,陈澍洪,等.高尿酸血症/痛风患者实践指南[J].中华内科杂志,2020,59(7):519-527.
[2]李秀峰,董霞,魏淑凤.健脾化湿、泄浊活血法治疗脾虚湿阻型高尿酸血症的临床疗效观察[J].中国临床医生杂志,2018,46(12):1505-1507.
[3]王雨,林志健,张冰.中药菊苣改善氧化应激性炎症介导的“肠-肾”尿酸排泄研究[J].中华中医药杂志,2020,35(5):2552-2557.
[4]朱春胜,张冰,林志健,等.菊苣降尿酸药效验证[J].中华中医药杂志,2018,33(11):4933-4936.
[5]Brenner BM,Rector FC.Brenner & Rector′s the kidney[M].10th Edition.Saunders:Elsevier,2004:360-362.
[6]王雨,林志健,边猛,等.维药菊苣提取物对高尿酸血症状态下肠道屏障的影响[J].中华中医药杂志,2018,33(5):1718-1723.
[7]闵柳畅,安梦丽,何平.高尿酸血症与各种肾脏疾病关系的研究进展[J].中国临床研究,2018,31(11):1589-1591.
[8]李丽玉,林志健,张冰,等.连续高果糖饮水对大鼠尿酸水平的影响及其病理机制[J].中华临床营养杂志,2014,22(6):368-374.
[9]王海鸽,林志健,张冰,等.高蛋白高钙饮食合并限制饮水建立鹌鹑痛风模型初探[J].中国比较医学杂志,2019,29(4):15-22.
[10]王玲,李群.冠心病患者肠道菌群分布及其与尿酸代谢的关系分析[J].现代消化及介入诊疗,2012,17(6):327-330.
[11]Dincer HE,Dincer AP,Levinson DJ.Asymptomatic hyperuricemia:to treat or not to treat[J].Cleve Clin J Med,2002,69(8):594-597.
[12]何青,刘德平.高尿酸血症[M].2版.北京:人民卫生出版社,2016:90.
[13]王雨,林志健,聂安政,等.Glut9在果糖诱导大鼠高尿酸血症中的作用[J].中国病理生理杂志,2016,32(12):2287-2290.
[14]王雨,林志健,张冰.高尿酸血症大鼠的肠道尿酸排泄研究[J].北京中医药大学学报,2018,41(2):110-117.
[15]Yano H,Tamura Y,Kobayashi K,et al.Uric acid transporter ABCG2 is increased in the intestine of the 5/6 nephrectomy rat model of chronic kidney disease[J].Clin Exp Nephrol,2014,18(1):50-55.
[16]Shi Y,Mucsi AD,Ng G.Monosodium urate crystals in inflammation and immunity[J].Immunol Rev,2010,233(1):203-217.
[17]周蓓蓓,魏华.高尿酸血症与肠道菌群的相关性[J].中华临床免疫和变态反应杂志,2020,14(1):76-80.
[18]Turner JR.Intestinal mucosal barrier function in health and disease[J].Nat Rev Immunol,2009,9(11):799-809.
[19]黄胜男,林志健,张冰,等.肠道菌群结构变化与高尿酸血症发生的关系[J].北京中医药大学学报,2015,38(7):452-456.
[20]王小琪,李忠心.肠道微生物菌群与慢性肾脏病的研究进展[J].中国血液净化,2019,18(9):646-649.
[21]赵智强.略论痛风、高尿酸血症的中医病因病机与治疗[J].中医药学报,2009,37(5):46-47.
[22]北京中医药学会脾胃病专业委员会,张声生,周强.参苓白术散和补中益气方临床应用专家共识意见[J].北京中医药,2018,37(7):590-597.
(2020-12-10收稿 责任编辑:徐颖)
基金项目:国家自然科学基金项目(81673618);北京市自然科学基金项目(7162117)
作者简介:王雨(1991.06—),女,博士,研究方向:中药防治代谢性疾病研究,E-mail:wangyuxh@163.com
通信作者:张冰(1959.08—),女,博士,教授,主任医师,博士研究生導师,研究方向:中药防治代谢性疾病研究,E-mail:zhangbing6@263.net
