‘中山杉302’×墨西哥落羽杉回交子代叶片光合性状和叶绿素含量的QTL定位
2021-07-01郭金博华建峰殷云龙
郭金博, 华建峰, 殷云龙, 杨 颖,①
〔1. 江苏省中国科学院植物研究所(南京中山植物园) 江苏省落羽杉属树木种质创新与繁育工程研究中心, 江苏 南京 210014;2. 南京林业大学生物与环境学院, 江苏 南京 210037〕
杉科(Taxodiaceae)落羽杉属(TaxodiumRich.)植物为落叶或半常绿乔木,原产于北美及墨西哥。落羽杉属共3种,分别为池杉(T.ascendensBrongn.)、落羽杉〔T.distichum(Linn.) Rich.〕和墨西哥落羽杉(T.mucronatumTenore),均为二倍体植物,单倍体细胞染色体数为11(2n=22)[1]。江苏省中国科学院植物研究所从1973年起开展落羽杉属种间杂交试验,已选育出10多个优良无性系,定名为‘中山杉’(T.‘Zhongshanshan’)[2-7]。提高‘中山杉’的生长量是其育种工作的主要目标之一[8-9],其生物量与叶片积累的光合作用产物密切相关,因此,提高叶片光合效率可获得高光效速生‘中山杉’[10]。
植物叶片的叶绿素含量、净光合速率、气孔导度、胞间CO2浓度和蒸腾速率均属于微效多基因控制的数量性状,遗传规律复杂[11]。分子标记技术可快速、准确地改良植物的这些数量性状,目前已应用于水稻(OryzasativaLinn.)[12]、大豆〔Glycinemax(Linn.) Merr.〕[13]和玉米(ZeamaysLinn.)[14]等农作物的高光效育种研究,但在林木高光效育种研究中却应用较少[15]。迄今为止,‘中山杉’育种仍以传统杂交方式为主,育种周期较长,获得的具优良性状的杂交后代较少,因此,将分子标记技术应用于‘中山杉’育种工作十分必要。
SNP标记为第3代分子标记,具有分布丰度高、稳定性高、全自动化操作等优势,为高密度遗传图谱构建的理想工具[16]。然而,SNP标记的传统开发过程耗时费钱,获得的标记数量偏少[17]。虽然二代测序技术的发展使得在全基因组范围内查找SNP分子标记成为可能[18],但多数林木的全基因组测序成本较高,为此,人们开发了简化基因组测序技术(SLAF)。该方法先用限制性内切酶降低基因组复杂程度,再用二代测序技术对酶切位点附近片段进行测序,大大地降低了SNP标记开发和基因分型的成本。
Yang等[19]利用SLAF测序技术在落羽杉属植物指纹图谱的基础上构建了一张更高密度的遗传图谱,该图谱平均图距0.18 cM,包含11条连锁群10 710个SNP标记,是目前落羽杉属植物密度最高的遗传图谱。本研究以‘中山杉302’(T.‘Zhongshanshan 302’)×墨西哥落羽杉回交子代BC1群体为研究对象,对现存的111株植株叶片的光合性状(包括净光合速率、气孔导度、胞间CO2浓度和蒸腾速率)和叶绿素含量(包括叶绿素a、叶绿素b和总叶绿素含量)进行统计和相关性分析,并利用本课题组前期构建的落羽杉属高密度遗传图谱[19]对这7个目标性状进行QTL定位,以期找到调控落羽杉属植物相关光合性状和叶绿素含量的主效基因,阐明这些性状的分子遗传机制,为开展高光效落羽杉属植物分子辅助育种研究奠定基础。
1 材料和方法
1.1 材料
以栽种在江苏省镇江市丹阳市233国道与312国道交叉口(地理坐标为东经119°34′、北纬31°55′)的‘中山杉302’×墨西哥落羽杉回交子代BC1群体[19]为研究对象,现存植株共111株。‘中山杉302’为1988年江苏省中国科学院植物研究所在落羽杉(母本)和墨西哥落羽杉(父本)的种间杂交子代(F1)中筛选出的优良无性系。
1.2 方法
1.2.1 光合性状测定 于2017年7月26日(天气晴朗)的8:00—11:00及13:00—16:00,以及7月27日(天气晴朗)的8:00—11:00及13:00—14:40,使用LI-6400便携式光合测定仪(美国LI-COR公司)测定所有植株距地面约1.5 m处的健康叶片的光合性状,测定指标包括净光合速率、气孔导度、胞间CO2浓度和蒸腾速率。每株选取3枚不同方向的叶片,每枚叶片重复检测3次,结果取平均值。测定时,以红蓝光为光源,光照强度为1 200 μmol·m-2·s-1,叶室CO2浓度为380 μmol·mol-1。
1.2.2 叶面积测定 由于叶室内的叶片不能占满整个叶室,因此,待光合性状测定完毕后,需要准确测量被测叶片的面积,再根据被测叶片面积与叶室面积的比值以及各光合性状指标的测定值计算各指标的实际值。测定时,将小叶摘下,重新摆放,使叶片完全展开且互不遮挡,用Epson Perfection V700扫描仪(日本Epson公司)扫描,并用WinRHIZO 软件计算被测叶片面积。
1.2.3 叶绿素含量测定 将扫描后叶片清洗干净、晾干并剪碎;称取3份碎叶,每份0.2 g;加入体积分数95%乙醇25 mL,避光浸提24 h。以体积分数95%乙醇为空白对照,在波长665、649和470 nm下分别测定提取液的吸光度。根据测定结果计算叶绿素a、叶绿素b及总叶绿素含量[20]。
1.3 数据处理
采用R/QTL V3.1.1软件的复合区间作图法对各性状进行QTL分析,通过PT检验1 000次设定阈值,首先考虑0.99置信度对应的似然函数比值对数值(logarithm of odds,LOD)阈值,若没有定位区间则考虑0.95和0.90置信度对应的LOD阈值。参照杨柳等[21]的标准,将LOD值大于2.0作为判定主效QTL存在的阈值,并将同一连锁群上重叠的或遗传距离小于5 cM的QTL归为一个基因座。同时,统计各主效QTL的加性效应值(additive effect value,ADD)和解释表型变异率(rate of explaining phenotypic variation,EXP)。
利用EXCEL 2007软件记录各指标的原始数据并计算各指标的最大值、最小值、平均值、标准差和变异系数;利用SPSS 19.0软件对各指标数据进行正态分布分析。
2 结果和分析
2.1 ‘中山杉302’×墨西哥落羽杉回交子代叶片光合性状和叶绿素含量统计分析
从供试‘中山杉302’×墨西哥落羽杉回交子代叶片光合性状和叶绿素含量的频率分布图(图1)看,供试7个性状的频率均呈现明显的正态分布。

图1 ‘中山杉302’×墨西哥落羽杉回交子代叶片光合性状和叶绿素含量的频率分布
供试植株叶片光合性状和叶绿素含量的统计结果(表1)表明:供试植株的净光合速率、气孔导度、胞间CO2浓度和蒸腾速率的变幅分别为0.50~7.98 μmol·m-2·s-1、0.06~0.52 mmol·m-2·s-1、150.60~216.01 μmol·mol-1和1.62~10.92 mmol·m-2·s-1,均值分别为3.91 μmol·m-2·s-1、0.23 mmol·m-2·s-1、190.94 μmol·mol-1和5.17 mmol·m-2·s-1。4个光合性状中,胞间CO2浓度的变异系数最小,为7.39%,而净光合速率、气孔导度和蒸腾速率的变异系数则较大,均高于30%。其中,气孔导度的变异系数为43.48%,净光合速率的变异系数为40.15%,蒸腾速率的变异系数为33.27%。
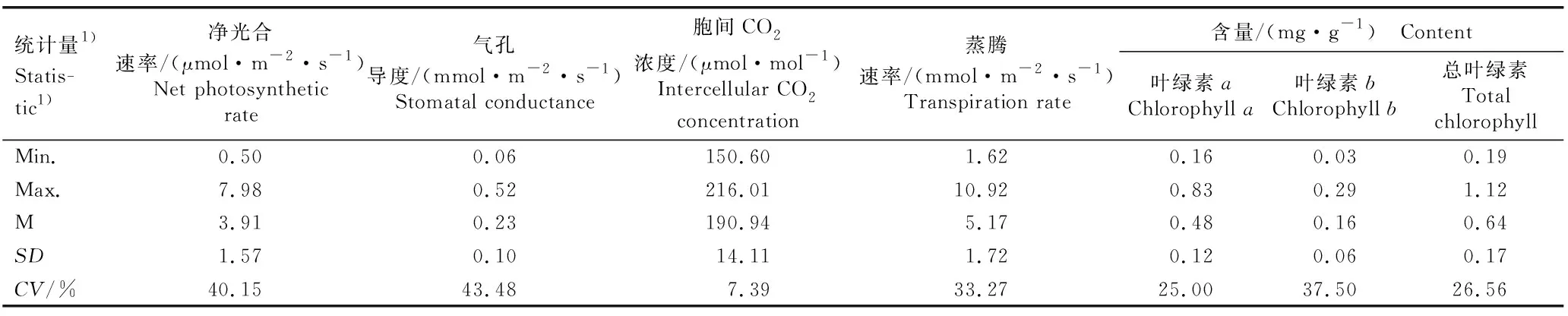
表1 ‘中山杉302’×墨西哥落羽杉回交子代叶片光合性状和叶绿素含量的统计
由表1还可见:叶绿素a含量、叶绿素b含量和总叶绿素含量的变幅分别为0.16~0.83、0.03~0.29和0.19~1.12 mg·g-1,均值分别为0.48、0.16和0.64 mg·g-1。3个指标中,叶绿素b含量的变异系数最大(37.50%),叶绿素a含量和总叶绿素含量的变异系数也较大,分别为25.00%和26.56%。
2.2 ‘中山杉302’×墨西哥落羽杉回交子代叶片光合性状和叶绿素含量的QTL定位分析
QTL定位结果表明:‘中山杉302’×墨西哥落羽杉回交子代叶片的蒸腾速率和叶绿素b含量未定位到QTL,而净光合速率、气孔导度、胞间CO2浓度、叶绿素a含量和总叶绿素含量均定位到主效QTL,且叶绿素a含量和总叶绿素含量的似然函数比值对数值(LOD)和加性效应值(ADD)轮廓图相似(图2)。

LOD: 似然函数比值对数值Logarithm of odds; ADD: 加性效应值Additive effect value.
LOD值大于2.0的主效QTLs共8个,详细特征见表2。由表2可见:这8个主效QTLs分别位于1号连锁群(LG1)、6号连锁群(LG6)和11号连锁群(LG11),其中,LG1和LG6各有2个主效QTLs,LG11有4个主效QTLs,共包含98个SLAF标记。并且,这些主效QTLs的置信区间不同。
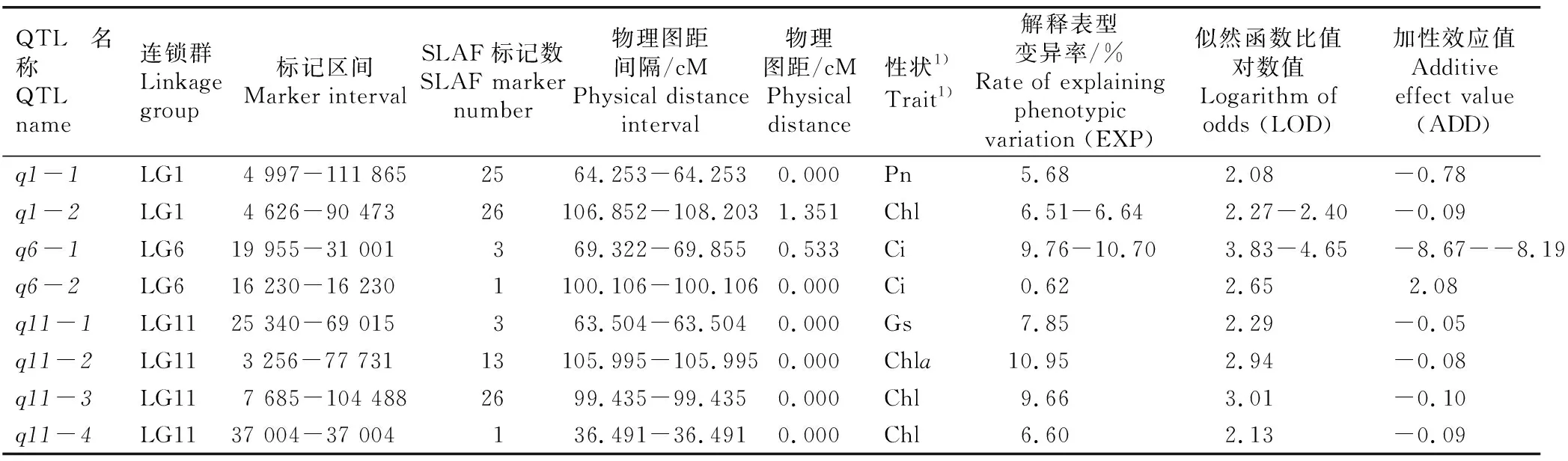
表2 ‘中山杉302’×墨西哥落羽杉回交子代叶片光合性状和叶绿素含量的主效QTLs特征
由表2还可见:净光合速率仅定位到1个主效QTL(q1-1),位于LG1,q1-1包含25个SLAF标记,解释表型变异率为5.68%,LOD值为2.08,ADD值为-0.78,说明该QTL区间基因参与净光合速率负调控。气孔导度也只定位到1个主效QTL(q11-1),位于LG11,q11-1包含3个SLAF标记,解释表型变异率为7.85%,LOD值为2.29,ADD值为-0.05,说明该QTL区间基因参与气孔导度负调控。胞间CO2浓度定位到2个主效QTLs,均位于LG6,分别为q6-1和q6-2。其中,q6-1包含3个SLAF标记,解释表型变异率为9.76%~10.70%,LOD值为3.83~4.65,ADD值为-8.67~-8.19,说明该QTL区间基因参与胞间CO2浓度负调控;q6-2只包含1个SLAF标记,解释表型变异率为0.62%,LOD值为2.65,ADD值为2.08,说明该QTL区间基因参与胞间CO2浓度正调控。
由表2还可见:叶绿素a含量仅定位到1个主效QTL(q11-2),位于LG1,q11-2包含13个SLAF标记,解释表型变异率为10.95%,LOD值为2.94,ADD值为-0.08,说明该QTL区间基因参与叶绿素a含量负调控。总叶绿素含量在LG1上定位到1个主效QTL(q1-2),在LG11上定位到2个主效QTLs,分别为q11-3和q11-4。其中,q1-2包含26个SLAF标记,解释表型变异率为6.51%~6.64%,LOD值为2.27~2.40,ADD值为-0.09,说明该QTL区间基因参与总叶绿素含量负调控;q11-3包含26个SLAF标记,解释表型变异率为9.66%,LOD值为3.01,ADD值为-0.10,说明该QTL区间基因参与总叶绿素含量负调控;q11-4仅包含1个SLAF标记,解释表型变异率为6.60%,LOD值为2.13,ADD值为-0.09,说明该QTL区间基因参与总叶绿素含量负调控。
3 讨 论
相关研究结果表明:从基因组差异较大的亲本杂交后代中能获得更多的多态性标记[22]。但是,当双亲基因组差异较大时,其染色体的非同源区段也可能增多,致使连锁分析难度增大[23];同时,双亲基因组差异较大还会造成染色体结构不稳定,致使同源染色体在配对时更易发生交叉互换[24],严重破坏标记和性状间的稳定性。本研究从‘中山杉302’×墨西哥落羽杉回交子代中共定位到8个主效QTLs,LOD值为2.08~4.65,解释表型变异率为0.62%~10.95%,上述原因可能是导致获得的主效QTLs较少、LOD值偏低及解释表型贡献率较低的主要原因。
本研究定位到的8个主效QTLs分别位于LG1、LG6和LG11连锁群上,其中,LG1和LG6各有2个主效QTLs,LG11有4个主效QTLs,且各主效QTLs的置信区间不同,说明这8个主效QTLs不存在“一因多效”现象。值得注意的是,仅q6-2位点基因参与胞间CO2浓度正调控,其余7个主效QTLs区间基因均参与相应性状的负调控。植物光合作用是一系列复杂的代谢反应的总和,极易受环境因子的影响[25-26]。本研究实验期间正处于当地最热阶段,供试植株在高温条件下会闭合气孔以减少水分蒸发,必然导致光合作用下降,这可能是本研究定位到的主效QTL区间基因主要参与光合性状负调控的重要原因。另外,供试植株在7月份已度过快速生长期,此时参与光合性状负调控的基因可能较参与光合性状正调控的基因更多、更活跃。
本研究获得的8个主效QTLs主要参与光合性状和叶绿素含量负调控,结合相关研究结果[19],认为这些主效QTLs与‘中山杉302’×墨西哥落羽杉回交子代的相关生长性状呈不同程度负相关,在速生和高光效‘中山杉’育种工作中,可选择沉默或敲除这些主效QTL区间基因的方式达到育种目标。此外,调控‘中山杉302’×墨西哥落羽杉回交子代生根性状的q11-1(标记区间为7 574~55 445)[27]与本研究获得的调控总叶绿素含量的q11-3(标记区间为7 685~104 488)部分重合,且完全位于本研究获得的调控叶绿素a含量的q11-2(标记区间为3 256~77 731)内,说明‘中山杉302’×墨西哥落羽杉回交子代的光合、生长和生根性状间存在密切关系。
