不同细胞来源外泌体在骨质疏松小鼠体内的骨靶向性比较
2021-07-01尹鹏滨张里程唐佩福解放军医学院北京00853解放军总医院第一医学中心骨科北京00853
顾 亚,李 毅,陈 铭,尹鹏滨,张里程,唐佩福解放军医学院,北京 00853; 解放军总医院第一医学中心 骨科,北京 00853
外泌体是一种天然的脂质体,在调控骨代谢过程中发挥重要作用。外泌体可以通过传递蛋白、核酸发挥细胞间通讯的作用。其还是一种比较理想的药物载体,凭借归巢能力,可被靶细胞特异性吸收。已有研究利用外泌体进行骨组织修复,治疗骨折、骨缺损和骨质疏松等[1-4]。骨修复过程涉及骨微环境中的多种细胞,如树突状细胞、间充质干细胞(mesenchymal stem cell,MSC)、成骨细胞和内皮细胞等,这些细胞相互影响、相互调节,进而促使骨修复重建[5]。研究证明骨组织来源相关细胞分泌的外泌体中包含对骨重塑有重要作用的关键因子,如蛋白质、miRNA、各种活性因子等[6]。在骨组织工程中,越来越多的研究开始用外泌体代替MSC进行骨修复[7]。外泌体作用于靶向细胞的方式主要有三种:1)直接与靶细胞的胞膜融合,同时释放mRNA、miRNA进入细胞质;2)通过内吞作用被靶细胞摄取;3)识别细胞表面的特异性受体[8]。不同细胞来源外泌体对骨组织的靶向性目前研究较少。本研究拟提取不同细胞来源的外泌体,通过在体、离体外泌体分布比较不同外泌体对骨组织的靶向性,筛选出具有高度骨靶向性的外泌体,为构建外泌体靶向递送系统提供参考,以期为临床治疗提供新思路。
材料和方法
1 实验动物 36只8周龄C57BL/6雌性小鼠(由解放军总医院国家二级动物实验中心提供),小鼠体质量(20±1) g,适应性饲养4周。动物实验获解放军总医院医学伦理委员会批准(编号:HP2021-50-80403),并按照《NIH实验动物使用指南》(第4版,2008)进行。
2 细胞、试剂和药品 DMEM培养液、α-MEM培养液、青霉素/链霉素双抗液、胎牛血清(Gibco公司);胰蛋白酶 (Sigma公司);MSC、乳腺癌细胞(4T1)、成骨前体细胞(MC-3T3-E1)细胞株、肾上皮细胞(293T)细胞株(均由解放军总医院骨科研究所提供);细胞外囊泡 (外泌体) 分离柱(Izon公司);超滤管 (Millipore公司);异氟烷(瑞沃德);DiR荧光染料,DiD荧光染料(北京泛博生物化学有限公司);外泌体洗脱柱(Invitrogen);小动物活体成像系统(美国Kodak公司)。
3 细胞培养 1) MC-3T3-E1:将MC-3T3-E1细胞株复苏后置于含10%无外泌体胎牛血清、青链霉素双抗的α-MEM培养基;2) MSC、4T1和293T:细胞株复苏后均置于含10%无外泌体胎牛血清、青链霉素双抗的DMEM培养基;3)以上4种细胞均置于37℃、5% CO2环境进行培养,每48 h换液1次,每天观察细胞生长情况,待细胞增殖到培养皿面积80%时可进行传代。
4 外泌体提取 将收集的细胞上清液进行浓缩,4 000 g 4℃离心1 h,采用凝胶排阻法对浓缩后的上清液进行外泌体提取。收集提取后的外泌体于-80℃保存。
5 外泌体荧光染色 制备荧光标记外泌体需全程避光。将制备好的外泌体从-80℃冰箱取出,用DiR荧光染料以1∶100体积比加入外泌体,放入37℃摇床1 h,使其染色充分。利用外泌体洗脱柱,800 g室温离心3 min,收集离心后液体,铝箔纸包裹,避光保存。
6 骨质疏松模型制作及分组 待C57雌性小鼠到达12周龄后进行去卵巢手术,术后8周行micro-CT确认骨量降低,开始做小动物活体成像实验,根据四种不同细胞来源外泌体将小鼠分为4组,每组9只小鼠,其中每组小鼠平均分为3小组,分别进行小鼠动态活体成像、解剖后股骨活体成像和股骨病理切片观测。
7 在体观察外泌体分布 将不同细胞来源外泌体通过尾静脉分别注射至4组骨质疏松小鼠中,每组3只小鼠,在注入荧光外泌体后的1 h、6 h、12 h、1 d、2 d、3 d、5 d和7 d,用小动物活体成像系统进行活体成像,观测不同细胞来源外泌体在骨质疏松小鼠体内的分布。
8 离体观察外泌体分布 活体观察发现在第3天时小鼠下肢骨组织荧光聚集最明显,于是重新用DiR染色外泌体,分别尾静脉注射至4组骨质疏松小鼠体内,每组3只小鼠。待第3天处死小鼠,取小鼠心脏、肝、脾、肺、肾与双下肢骨组织于10 cm2培养皿中,再次用活体成像机器进行图像采集,用于比较各脏器内外泌体含量。
9 股骨病理观察 大体观察结束后,用DiD染色外泌体,分别尾静脉注射至4组骨质疏松小鼠,每组3只。待第3天处死小鼠,将股骨标本置于100 g/L多聚甲醛4℃固定48 h后,放入10% EDTA液于4℃冰箱内脱钙24 h。常规沉糖脱水、OCT包埋,沿股骨冠状位进行切片,切取10 μm厚的病理切片,并利用DAPI染色,封片,观察股骨内荧光外泌体分布。
10 统计学分析 统计学分析应用SPSS19.0软件、GraphPad Prism 8软件和Carestream MI SE完成,计量数据以表示,多组间比较采用方差分析(两两比较采用t检验);计数资料以例数和百分比表示。P<0.05为差异有统计学意义。
结 果
1 不同来源外泌体骨靶向性在体观察 从图1中可以看出MSC来源外泌体、MC-3T3-E1来源外泌体均具有骨靶向性,能够在骨质疏松严重的部位聚集且在第3天达到最高峰,随时间延长荧光逐渐消失。293T和4T1来源外泌体在骨质疏松严重部位有微量荧光且不随时间变化而改变,说明其随着血液循环在骨组织处停留。提示MSC来源外泌体、MC-3T3-E1来源外泌体具有骨靶向性,而293T、4T1来源外泌体无骨靶向性。
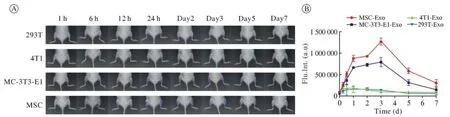
图1 不同细胞来源外泌体在体荧光动态观察A:活体成像观察注入荧光外泌体后的体内分布情况;B:荧光定量Fig.1 In vivo fluorescence dynamic observation of exosomes from different cell sourcesA: Observation of the distribution of fluorescent exosomes after injection by in vivo imaging; B: Fluorescence quantification
2 不同来源外泌体骨靶向性离体观察 在外泌体骨聚集最强时间点解剖,进行不同器官的离体荧光成像。离体荧光成像显示四种外泌体均在肝处聚集最强,说明外泌体代谢途径为肝代谢。其中MSC来源外泌体骨靶向性最好,MC-3T3-E1来源外泌体骨靶向性次之。图2B为骨组织绝对荧光强度分析,其中MSC来源外泌体荧光强度最强(P<0.05),293T与4T1无统计学差异。图2C为骨组织占总体荧光强度的百分比,其结果与图2B趋势一致。
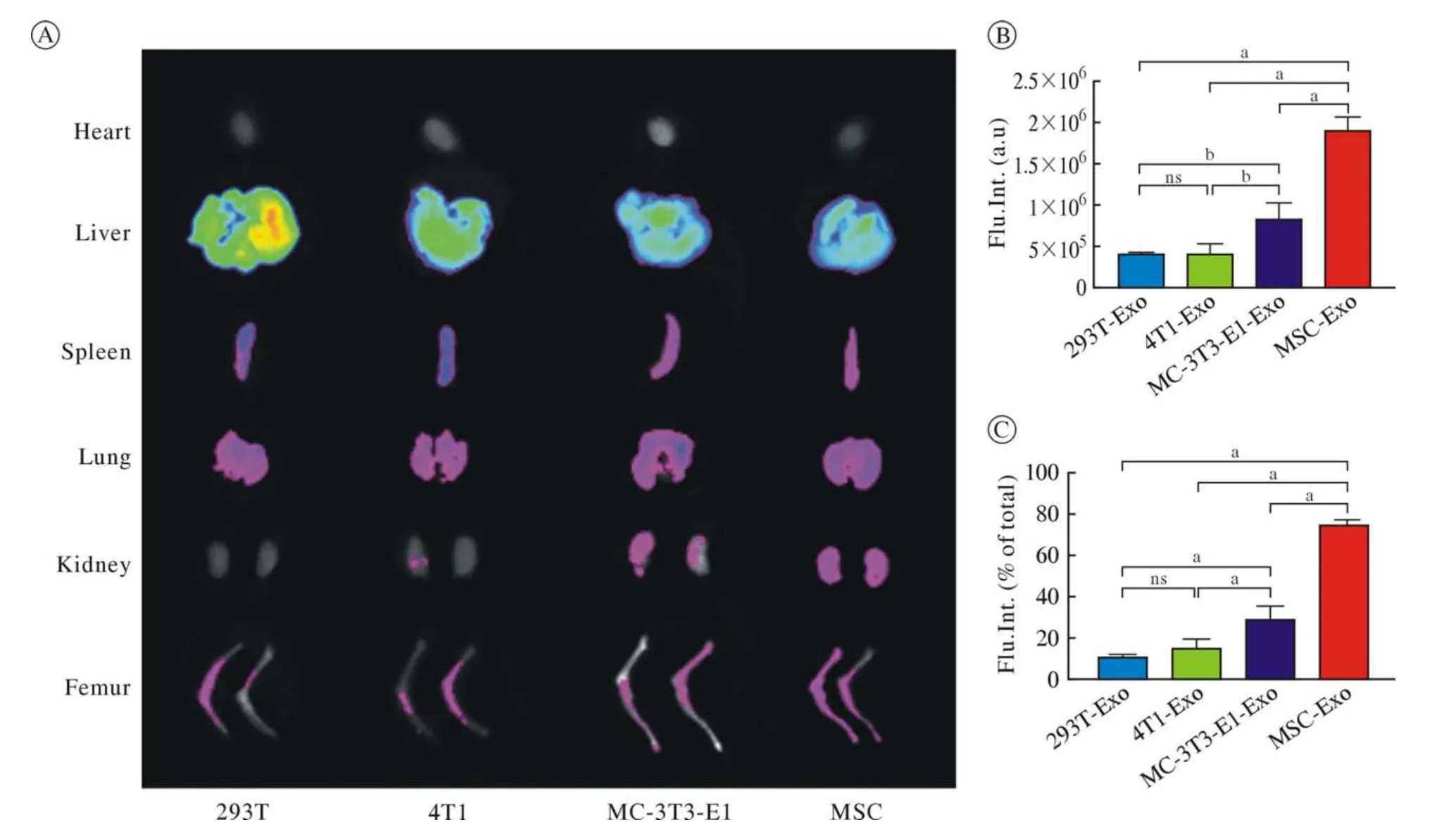
图2 不同细胞来源外泌体离体荧光观察(aP < 0.01;bP < 0.05;ns:not significant)A:荧光最强时间点各组织的分布情况;B:骨组织绝对荧光强度分析;C:骨组织占总体荧光强度的百分比Fig.2 In vitro fluorescence observation of exosomes from different cell sources (aP < 0.01; bP < 0.05; ns: not significant)A: The distribution of each tissue at the time point of the strongest fluorescence; B: Analysis of absolute fluorescence intensity of bone tissue; C: Percentage of bone tissue to overall fluorescence intensity
3 不同来源外泌体骨靶向性免疫荧光染色 股骨组织切片(图3A)显示不同来源外泌体均能够通过血液进入骨组织,而进一步观察骨小梁部位,MSC来源外泌体、MC-3T3-E1来源外泌体能够显著聚集在骨小梁周围,293T、4T1来源外泌体在骨小梁聚集较少。骨组织病理切片荧光定量显示,MSC来源外泌体骨组织内荧光强度最高,且与其他三组有统计学差异(P<0.05),见图3B。
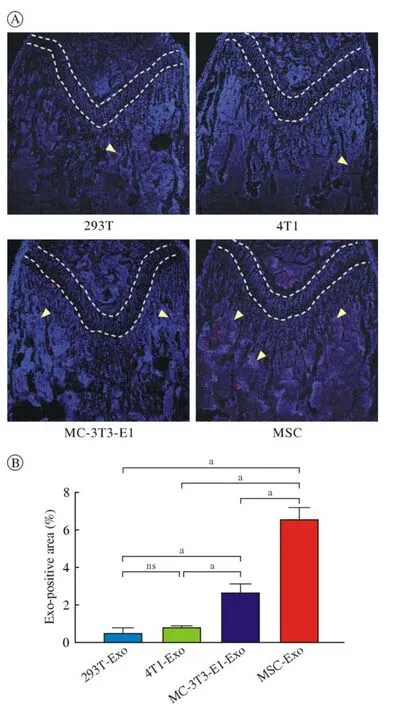
图3 股骨组织切片观察骨小梁部位不同细胞来源外泌体聚集情况(aP < 0.01;ns:not significant)A:免疫荧光染色股骨组织切片观察(黄色箭头:外泌体);B:荧光定量Fig.3 Femoral tissue section to observe the accumulation of exosomes from different cells in the trabecular bone (aP < 0.01;ns: not significant)A: Observation of femoral tissue sections by immunofluorescence staining (yellow arrows: exosomes); B: Fluorescence quantification
讨 论
近年来,外泌体在骨科疾病中的作用被人们广泛关注,目前多种细胞来源外泌体已被证实参与骨代谢过程[9-10]。供体MSC来源的外泌体可通过转运miR-26a恢复宿主MSC功能并缓解骨质疏松[11]。Cui等[12]研究发现,MC-3T3-E1分泌的外泌体能够进一步促进成骨细胞的矿化,且miRNA表达谱发生显著改变,进一步研究提示成骨前体细胞来源外泌体可能募集骨髓基质细胞进行成骨分化。Vracar等[13]研究发现抗肿瘤药物依诺沙星能够通过刺激4T1细胞分泌外泌体进而抑制破骨细胞形成。以上研究表明外泌体能够广泛参与骨调控,并能够修复骨组织,促进骨再生。
既往研究表明干细胞来源外泌体具有良好的促组织修复能力,因此被广泛用于多种类型的组织修复[14]。Qi等[15]研究发现人诱导的多能干细胞衍生的间充质干细胞可通过促进骨再生和血管产生进而促进大鼠临界颅骨缺损的愈合。Furuta等[16]发现CD9-/-小鼠由于分泌外泌体量少,骨折愈合速度显著低于野生型小鼠,而外源性给予间充质干细胞来源外泌体能够加速骨折愈合,而Liu等[17]研究发现低氧状态下的间充质干细胞能够通过外泌体运输miR-126促进骨折愈合。有研究表明间充质干细胞来源外泌体能够激活MAPK通路进而改善骨质疏松症状。以上研究表明干细胞来源外泌体在促骨组织修复领域具有良好前景。
外泌体具有良好的生物活性,得益于外泌体表面的CD47,它能够阻止外泌体在血液循环系统中被单核细胞清除,因此外泌体具有足够时长的循环半衰期和免疫逃逸能力,且能够加载多种不同的药物[18]。目前已有多项研究通过对外泌体进行工程化改造进而治疗骨科领域疾病。Song等[19]研究发现内皮细胞来源外泌体能够显著靶向骨组织,并能够通过抑制破骨细胞活性进而改善骨质疏松症状。后续研究者通过对外泌体进行工程化改造以提高其靶向性和促再生能力,进而提升修复效果。Luo等[20]将间充质干细胞来源外泌体结合干细胞特异性适配体,进而增强其对骨髓间充质干细胞的亲和力。研究显示经过适配体修饰后的外泌体具有更好的促骨折愈合能力。以上研究提示我们不同来源的外泌体对骨组织靶向性有显著差异,挑选合适来源的外泌体对构建促组织修复载体具有重要意义。
为进一步探索外泌体对骨的靶向性,本研究选取间充质干细胞来源外泌体、成骨前体细胞来源外泌体、肾上皮细胞来源外泌体、乳腺癌细胞来源外泌体进行探索。我们推测干细胞来源、骨细胞来源以及具有高骨转移性肿瘤细胞来源的外泌体均可能具有骨靶向性,而肾上皮细胞系是研究中常用的惰性细胞系,可能不具有骨靶向性。本研究结果显示干细胞、骨细胞来源的外泌体骨靶向性好,这与我们的预期一致。然而肿瘤细胞与肾上皮细胞细胞系来源外泌体均未观察到骨靶向性。研究结果提示干细胞来源外泌体以及成骨前体细胞来源外泌体可能是构建骨靶向性载体的理想选择。后续研究需进一步探索外泌体骨靶向性的分子机制,以期为构建骨组织药物递送载体提供新思路。
