高粱种质资源出苗相关性状与SSR标记的关联分析
2021-06-30刘秀慧邹桂花翟国伟刘合芹郑学强陈合云
刘秀慧,邹桂花,翟国伟,刘合芹,郑学强,陈合云
(浙江省农业科学院 作物与核技术利用研究所,浙江 杭州 310021)
高粱[Sorghumbicolor(L.) Moench]是人类栽培的最古老作物之一,同时也是较早受到人工选择进化影响的作物之一。在全世界分布范围广,具有食用、酿酒、饲用、能源、青贮用等多种用途。由于栽培区的气候、土瓖、栽培制度的不同,在长期的种植过程中,经过自然和人工选择,在农艺性状、生理生化特性等方面形成了丰富的变异类型[1]。高粱播种深浅对出苗速度和出苗率的影响十分明显。农业生产中,高粱的播种深度一般为3~5 cm。过深(7 cm)或过浅(不覆土),均能引起发芽势的显著降低[2]。播种深度通过不同因子的作用影响出苗。在播种至苗期遇到干旱,种子缺水是出苗率降低的主要原因。播种过深,覆土加厚,增加了幼苗穿出土层的厚度和出土阻力,并由于土壤氧气不足,易造成种子活力丧失[1-2]。不同种质资源对播种深度的耐受度不同。耐深播种质资源的发掘利用可保证深播下种子发芽率,还可以通过增加作物深层土壤中根密度,增强抗旱和抗倒伏能力,提高干旱半干旱地区高粱产量[3-4]。
不同研究表明,玉米、水稻中胚轴的伸长可以提高深播条件下出苗率,中胚轴长度与出苗速度、出苗率相关[5-6]。与其他禾本科作物一样,高粱胚轴可分为上胚轴、中胚轴和下胚轴,但高粱上胚轴极短,下胚轴不明显[7]。在高粱种子萌发过程中,中胚轴伸长将胚芽送至土表,中胚轴与其出苗顶土能力有关。研究表明,高粱中胚轴的伸长能力是决定深播条件下出苗率的重要因素[8]。可见,高粱中胚轴的伸长能力与深播条件下出苗率密切相关,但与高粱中胚轴特性等出苗相关性状的分子标记研究鲜见报道。关联分析是以连锁不平衡为基础,将目标性状与等位基因(位点)联系起来的分析方法,曾在人类遗传学中广泛应用;近年来,在植物不同性状遗传定位中广泛应用[9]。前人利用关联分析对高粱的不同农艺性状以及抗病性进行了关联分析[10-12],但尚无中胚轴等出苗相关性状的研究报道。本研究以110份不同地理来源的高粱种质资源为材料,调查其中胚轴长、百粒重、根长和胚芽鞘长,利用55对SSR标记进行关联分析,旨在挖掘与中胚轴长等出苗相关性状的SSR标记位点,为高粱耐深播的分子育种奠定基础。
1 材料与方法
1.1 试验材料
以110份高粱种质资源为供试材料,其中:80份为来自全国各地的国内资源,包括山西25份、辽宁21份、北京10份、内蒙古5份、河北5份、四川3份、山东2份、黑龙江1份、吉林1份、陕西1份、江苏1份、安徽1份、浙江1份、贵州1份、广西1份、香港1份;30份为国外资源,包括苏丹1份、日本6份、美国23份。表1为详细资料。
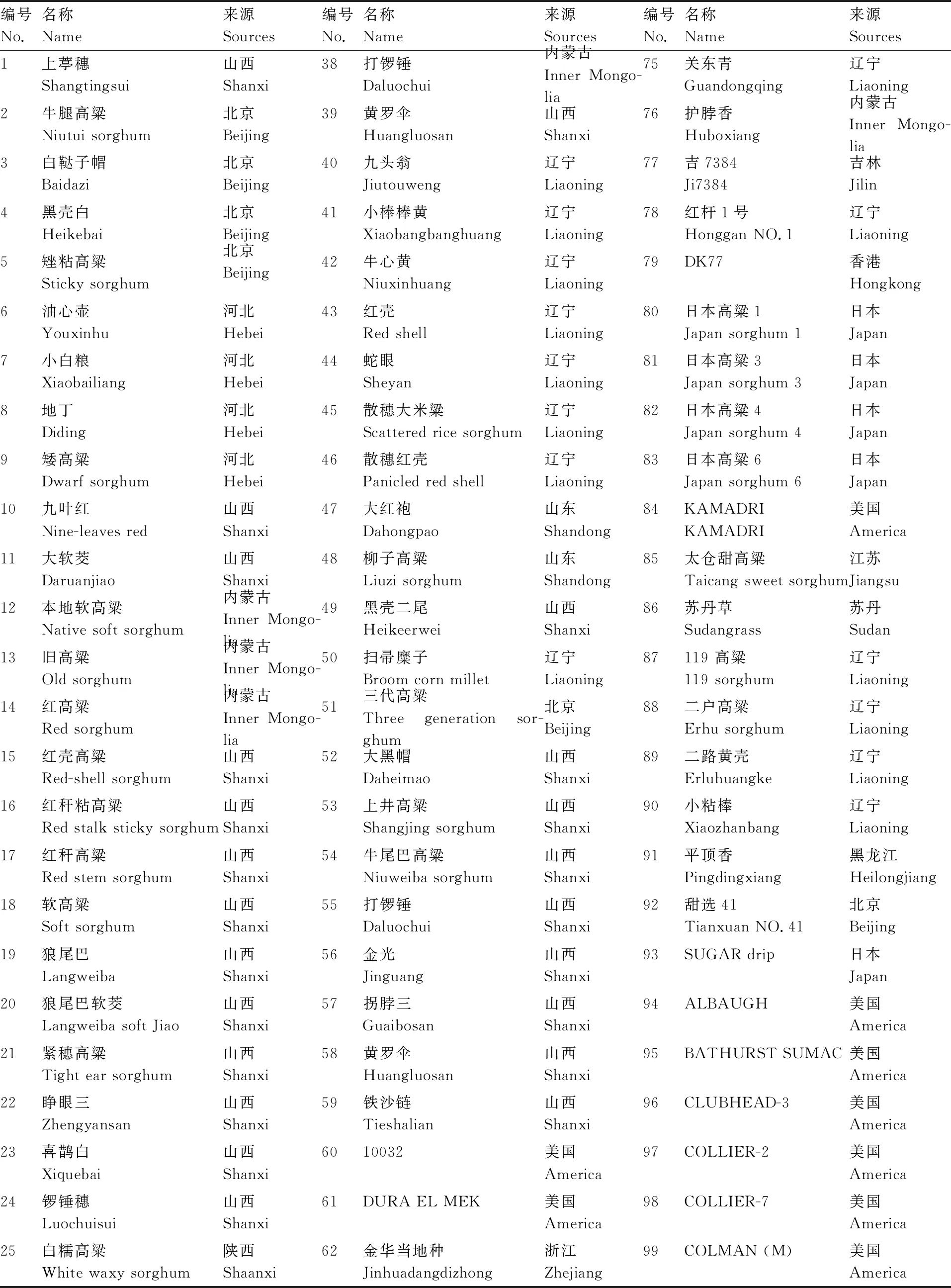
表1 参试高粱种质名称及来源信息
1.2 百粒重、中胚轴长、根长与胚芽鞘长度的测定
使用千分位天平称量100粒高粱种子质量,3次重复均值为百粒重。按照邹桂花等[3]利用水培方法测定中胚轴长、根长与胚芽鞘长度。每个品种选择饱满,无破损的种子90粒,分成3等份,作为3次重复。各品种播好后,设置人工气候室的温度28 ℃,黑暗培养,让其自然萌发出苗。一周后,取样测定中胚轴长度,每个品种每个重复选择10株。
1.3 DNA提取与SSR分子标记检测
采用CTAB法[13]提取各高粱叶片总DNA。选取均匀分布在高粱全基因组的55对SSR引物对110份高粱种质资源进行PCR扩增,并进行琼脂糖凝胶电泳检测[14]。SSR引物由上海生工生物工程有限公司合成。
1.4 数据统计与分析
统计SSR引物扩增条带,有带记为“1”,无带记为“0”。根据不同软件要求转换原始数据。使用SPSS软件进行表型的相关性分析,应用Popgene32软件计算遗传多样性指数。使用Structure 2.2软件[15]分析群体结构,采用混合模型和等位变异发生频率非相关模型进行分析,亚群数设为2~8,不作数迭代和重复次数均设置为50 000。每个参数运行5次,以最大似然值K为标准选取最佳的亚群数。
使用Tassel 5.0软件(http://www.maizegenetics.net/tassel/)进行关联分析,以Structure2.2软件[15]计算的后验概率作为协变量,将等位基因频率小于0.05的稀有等位基因作为缺失处理,采用广义线性模型(generalized linear model,GLM)和混合线性模型(mixed linear model,MLM)模型分别计算。以Bonferroni多重校验矫正之后的0.05值,即9.259×10-4(0.05/54)为阈值,认为P值小于阈值的SSR标记与表型的关联性显著。
2 结果与分析
2.1 高粱百粒重、中胚轴长、根长与胚芽鞘长度的相关性分析
由表2可以看出,高粱中胚轴长与根长呈显著(P≤0.05)负相关,与胚芽鞘长均呈极显著(P≤0.01)正相关。百粒重与根长、胚芽鞘长均呈极显著(P≤0.01)正相关,胚芽鞘长与根长呈极显著(P≤0.01)正相关。其中,百粒重和胚芽鞘长相关系数最高,为0.602。
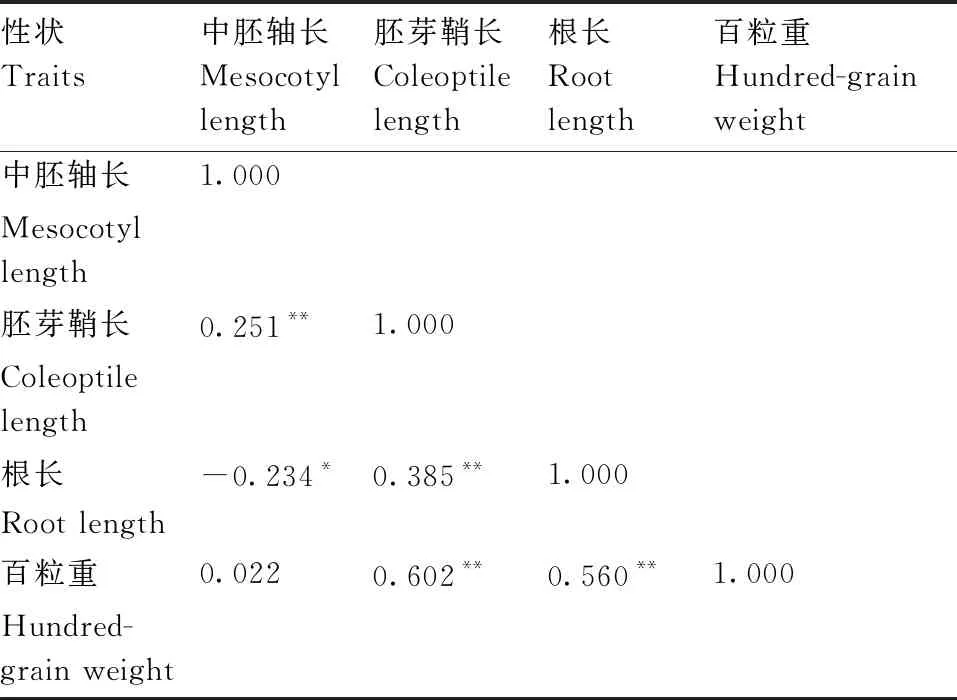
表2 高粱4个出苗性状间的相关性
2.2 高粱种质资源 SSR标记遗传多样性分析
利用54对均匀分布在高粱全基因组且多态性好的SSR引物对110份高粱种质资源进行遗传多样性分析(表3)发现,共检测到339个等位基因,其中有效等位基因有144个,所占比例为42.55%;各位点的等位基因数介于2~14个,平均每个位点检测到6.28个等位基因,有效等位基因数介于1.21~5.35,平均有效等位基因数为2.67个;Shannon’s 信息指数介于0.380 1~1.989 0,平均值为1.129 9。
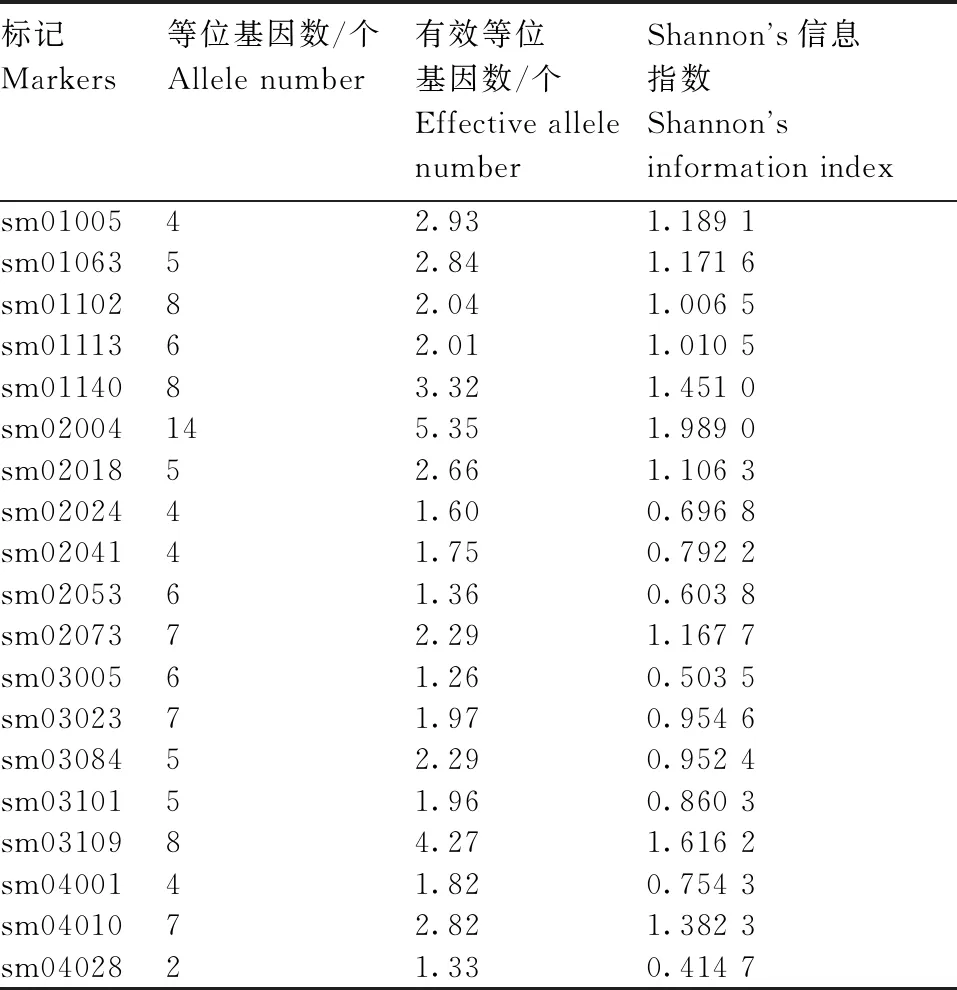
表3 SSR引物在参试高粱材料中的多态性
SSR标记中sm02004多态性最好,其有效等位基因数为5.35个,Shannon’s 信息指数为1.989 0;sm06130的多态性最差,其有效等位基因数仅为1.21个,Shannon’s 信息指数也最低。综上可知,110份高粱种质资源的遗传差异较大。
2.3 高粱种质资源群体结构分析
由图1可知,高粱种质资源亚群数为3时,ΔK达到最高值,参试的高粱种质资源分布于稳定的类群中。将比例超过后验概率大于或等于0.7的高粱种质主要分为3个亚群(图2)。红色区域为第一亚群,包括7份,来自辽宁及日本和苏丹等地。绿色区域为第2亚群,包括42份种质,主要来源于山西、内蒙、河北、北京、辽宁等地;蓝色区域为第3亚群,包括15份种质,主要来源于美国8份及北京2份、河北1份、浙江1份、辽宁2份、山西1份。其余46份全属于混合亚群。
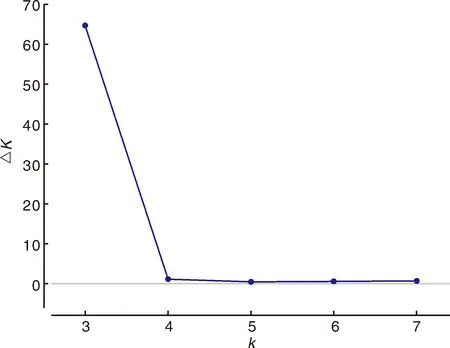
图1 ΔK值随亚群数的变化Fig.1 Change of ΔK value with the number of subgroups
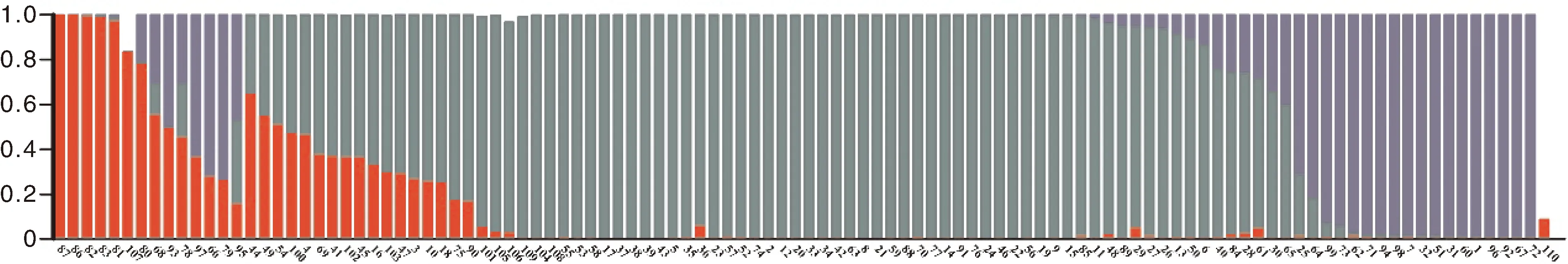
图2 一百一十份高粱种质资源的群体结构Fig.2 Population structure of 110 sorghum germplasm resources
2.4 四个出苗性状的关联分析
通过GLM模型定位发现,与中胚轴长显著(P≤0.05)关联的标记最多,共有9个,在2~9号染色体上均有分布,贡献率介于11.18%~28.05%,位于4号染色体上的sm04028标记贡献率最高,此外,sm08075、sm09061和sm05088贡献率超过了20%。利用MLM模型仅检测到1个显著关联的标记sm05088。与高粱胚芽鞘长显著(P≤0.05)关联的SSR位点有5个,位于1号、9号和10号染色体上,贡献率范围为11.22%~18.12%;与根长显著关联的标记仅1个,为sm10097,贡献率为28.03%;与百粒重显著(P≤0.05)关联的SSR位点有2个,为sm09094和sm01113,这两个标记与胚芽鞘长也显著关联,贡献率分别为17.11%和12.15%。
对检测到的与中胚轴长等4个性状显著关联的标记进一步挖掘优异等位基因,因为等位变异表型值为正数时才对各性状有促进作用,因此将表4中表型效应为正值的等位变异标记整理,并列出携带该等位变异的5个最佳材料(表5)。由表5可知,与胚芽鞘长、百粒重、中胚轴长和根长关联的优异等位位点分别有5、2、9和1个。其中与中胚轴长关联的优异等位位点表型效应值介于4.17~9.12。CLUBHEAD-3、BATHURST SUMAC、EARLY FOLGER、253、平顶香这5份材料中胚轴较长且含有8个以上的优异变异位点。
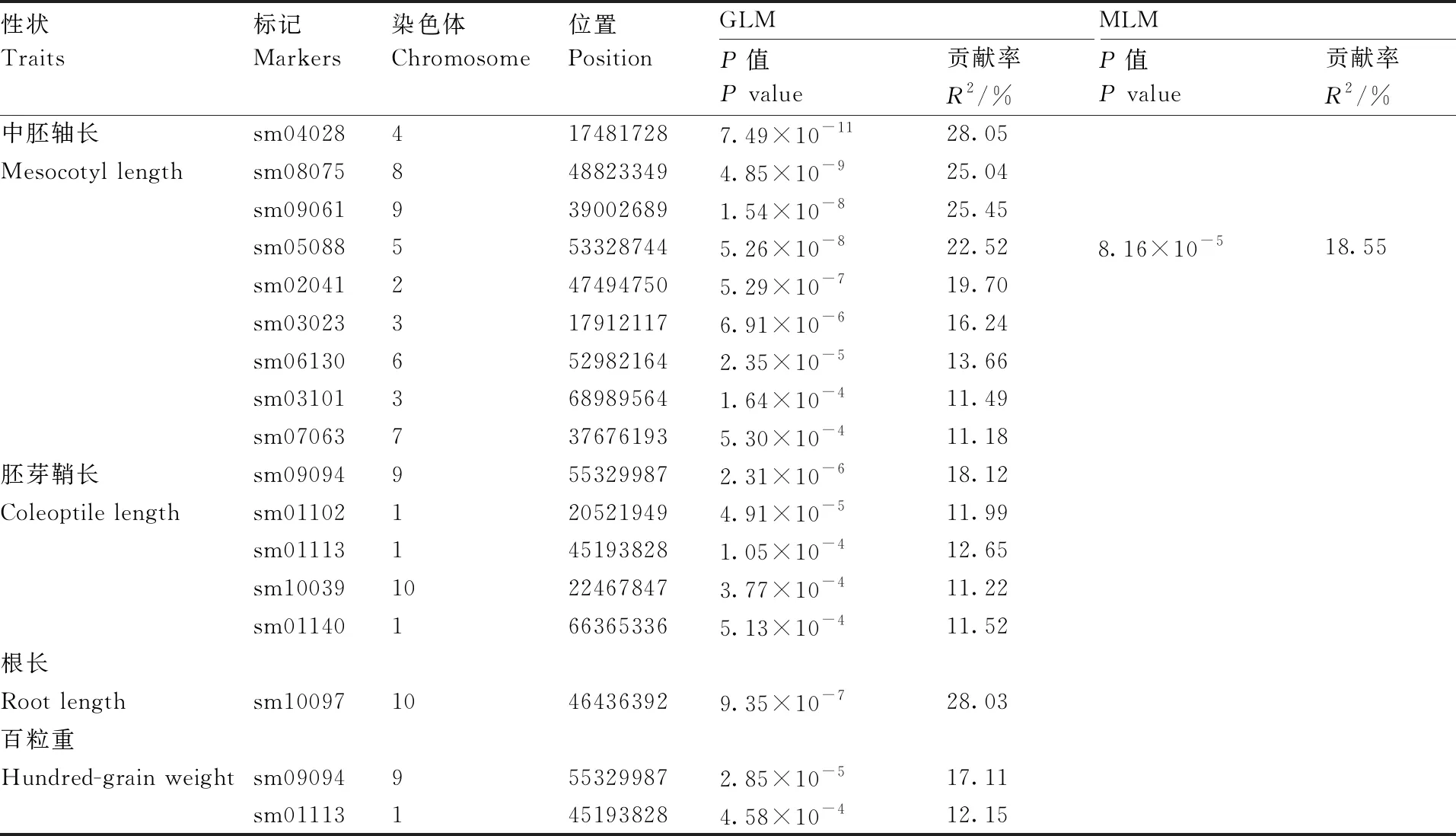
表4 四个出苗性状的关联标记
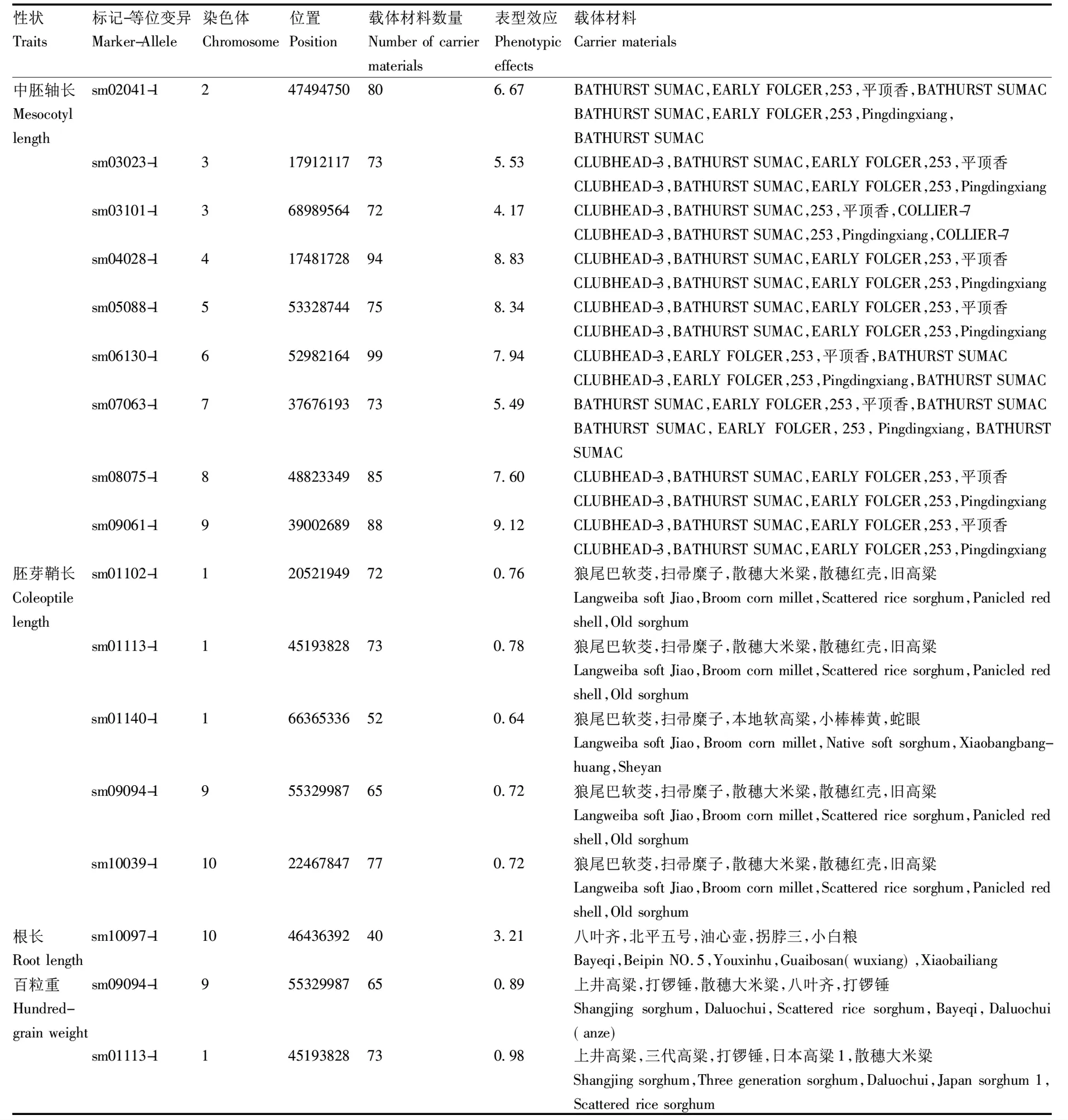
表5 与四个出苗性状相关的优异等位变异及载体材料
3 讨论
分析种质资源的遗传多样性对育种材料创新和品种选育尤其重要,利用SSR标记分析高粱遗传多样性和群体结构的报道较多[16-20]。本研究选用的54对SSR标记Shannon’s 信息指数平均值为1.129 9,田承华等[21]选用的10对SSR标记Shannon’s 信息指数平均值为1.195 8,二者研究结果接近。本研究将110份高粱材料聚为三亚群,通过与材料来源比较来看,相同区域的资源并不能很好的聚在一起,这说明育种家对种质材料的选择过程中,在不同方向上的选择压力使得相同来源的材料表现出较大的基因型差异。田承华等[21]、吕芃[22]也利用SSR标记将高粱种质资源分为三个亚群。而赵香娜等[20]将甜高粱种质资源分为了两个亚群,倪先林等[18]将糯高粱种质资源也分为了两个亚群,这可能是由于倪先林等[18]、赵香娜等[20]的研究仅针对糯或甜种质资源。
关联分析是解析复杂性状遗传机制的重要方法,群体结构分析可减少群体分类对关联分析中亚群的划分的影响。采用GLM和MLM两种模型检测位点可提高结果准确性和稳定性。本研究采用GLM检测到的与高粱胚芽鞘长、百粒重、根长、中胚轴长显著关联的SSR位点分别有5、2、1、9个,采用MLM模型仅检测到1个与中胚轴长显著关联的位点,这与本研究中采用的显著性检验阈值较为严格有关。
本研究发现,百粒重和胚芽鞘长表型数据极显著相关,相关系数为0.602,与百粒重显著关联的2个SSR位点也与胚芽鞘长显著关联,这与相关性分析结果相符合。本研究在多个染色体不同位置上检测到了与中胚轴长显著关联的位点,说明中胚轴长由微效多基因控制的数量性状。有研究表明,多个位点可与作物同一性状相关联,同一位点也可与作物多个性状同时关联[22],本研究也证实了这一结果。本研究发现的与中胚轴长显著关联且表型效应值较高的sm02041-1、sm03023-1、sm03101-1、sm04028-1、sm05088-1、sm06130-1、sm07063-1、sm08075-1和sm09061-1优异等位变异可在基因聚合分子育种中作为选择标记,指导亲本组合选配,用于长中胚轴后代材料的选择。进一步挖掘出有较长中胚轴且聚合了8个及以上优异等位变异的载体材料5份,可作为优异资源用于耐深播品种的分子辅助育种。
参考文献(References):
[1] 邹剑秋,王艳秋,柯福来. 高粱产业发展现状及前景展望[J]. 山西农业大学学报(自然科学版),2020,40(3): 2-8.
ZOU J Q,WANG Y Q,KE F L. Development status and prospect ofSorghumindustry in China[J].JournalofShanxiAgriculturalUniversity(NaturalScienceEdition),2020,40(3): 2-8.(in Chinese with English abstract)
[2] 杨赞林. 高粱不同播种深度试验[J].作物学报,1963(2): 217-219.
YANG Z L. Different sowing depth tests of sorghum[J].ActaAgronomicaSinica,1963(2): 217-219.(in Chinese)
[3] 邹桂花,翟国伟,陶跃之,等. 高通量筛选适合深播高粱品种的方法:CN105993878B[P]. 2019-02-19.
[4] 钟改荣,白永新,孟俊文. 浅谈抗旱耐深播高产玉米新品种的利用与开发[J]. 玉米科学,1998,6(1): 29-31.
施工中的注浆量主要由泵机实际排量进行控制。为了避免注浆泵快速升压,对注浆效果造成影响,对于注浆速度,必须保持在50L/min以内,并实行双孔注浆。单个注浆孔的施工注浆量必须比理论值稍大,并且必须达到设计要求的终压数值,采用双重指标对实际注浆量进行控制。
ZHONG G R,BAI Y X,MENG J W. Application and development of new maize varieties with drought resistance,deep-sowing tolerance and higher yield[J].MaizeSciences,1998,6(1): 29-31.(in Chinese with English abstract)
[5] 董存吉,王早荣,孟俊文,等.玉米高产原理及增产途径[J]. 山西农业科学,1990(1): 21-23.
DONG C J,WANG Z R,MENG J W,et al. High yield principle and ways of increasing yield of maize[J].JournalofShanxiAgriculturalScience,1990(1): 21-23. (in Chinese)
[6] 张光恒,林建荣,吴明国,等. 水稻出苗顶土动力源研究[J]. 中国水稻科学,2005,19(1): 59-62.
ZHANG G H,LIN J R,WU M G,et al. Analysis on germinating dynamic source of rice (Oryzasativa)[J].ChineseJournalofRiceScience,2005,19(1): 59-62.(in Chinese with English abstract)
[7] 杜金友,张桂荣,蔡爱军,等. 玉米中胚轴长度与内源激素关系的研究[J]. 玉米科学,2008,16 (3): 70-73.
DU J Y,ZHANG G R,CAI A J,et al. Relationship between the mesocotyl elongation and hormones in maize (ZeamaysL.)[J].JournalofMaizeSciences,2008,16(3): 70-73.(in Chinese with English abstract)
[8] 周德超. 种子萌发出苗过程中胚轴的伸长和胚根的发展[J]. 生物学通报,1985,20(7): 3-4.
[9] 闫凤霞,常建忠,梁笃,等. 不同高粱种质幼苗器官形态与出苗能力关系的研究[J]. 作物杂志,2015(1): 49-52.
YAN F X,CHANG J Z,LIANG D,et al. Study on relationship between seedling morphology and emerging ability of differentSorghumgermplasm[J].Crops,2015(1): 49-52.(in Chinese with English abstract)
[10] 王荣焕,王天宇,黎裕. 关联分析在作物种质资源分子评价中的应用[J]. 植物遗传资源学报,2007,8 (3): 366-372.
WANG R H,WANG T Y,LI Y. Application of association analysis in molecular evaluation of crop germplasm resources[J].JournalofPlantGeneticResources,2007,8(3): 366-372.(in Chinese with English abstract)
[11] AHN E,HU Z B,PERUMAL R,et al. Genome wide association analysis ofSorghummini core lines regarding anthracnose,downy mildew,and head smut[J].PLoSOne,2019,14(5): e0216671.
[12] BOYLES R E,COOPER E A,MYERS M T,et al. Genome-wide association studies of grain yield components in diverseSorghumgermplasm[J].ThePlantGenome,2016,9(2): plantgenome2015.09.0091.
[13] UPADHYAYA H D,WANG Y H,SHARMA R,et al. Identification of genetic markers linked to anthracnose resistance inSorghumusing association analysis[J].TheoreticalandAppliedGenetics,2013,126(6): 1649-1657.
[14] DOYLE J J T,DOYLE J L . Isolation of Plant DNA from fresh tissue[J].Focus,1990,12(1):13-15.
[15] 高东,李锐,杨木青,等.元阳箐口村哈尼梯田水稻品种SSR遗传多样性分析[J].分子植物育种,2011,9(1):1857-1863.
GAO D,LI R,YANG M Q,et al. Rice landraces’genetic diversity of Hani terrace wetland in Qingkou village of Yuanyang county [J].MolecularPlantBreeding,2011,9(1):1857-1863. (in Chinese with English abstract)
[16] PRITCHARD J K,STEPHENS M,DONNELLY P. Inference of population structure using multilocus genotype data[J].Genetics,2000,155(2): 945-959.
[17] 冯国郡,叶凯,李桂英,等. 新疆甜高粱种质资源遗传多样性的SSR分析[J]. 植物遗传资源学报,2012,13(4): 549-554,561.
FENG G J,YE K,LI G Y,et al. Simple sequence repeats polymorphism analysis of sweetSorghumgermplasm in Xinjiang[J].JournalofPlantGeneticResources,2012,13(4): 549-554,561.(in Chinese with English abstract)
[18] 倪先林,赵甘霖,刘天朋,等. SSR分子标记在糯高粱种质资源遗传多样性分析中的应用[J]. 江苏农业学报,2015,31(1): 16-22.
NI X L,ZHAO G L,LIU T P,et al. Genetic diversity analysis of glutinousSorghumgermplasm by simple sequence repeat[J].JiangsuJournalofAgriculturalSciences,2015,31(1): 16-22.(in Chinese with English abstract)
[19] 李萌,秦慧彬,王宇楠,等. 基于SSR标记的山西高粱地方品种遗传多样性和遗传结构分析[J]. 分子植物育种,2020,18(18): 6068-6076.
LI M,QIN H B,WANG Y N,et al. Genetic diversity and structure ofSorghumLandrace germplasm in Shanxi based on SSR markers[J].MolecularPlantBreeding,2020,18(18): 6068-6076.(in Chinese with English abstract)
[20] 赵香娜,岳美琪,刘洋,等. 国内外甜高粱种质遗传多样性的SSR分析[J]. 植物遗传资源学报,2010,11(4): 407-412.
ZHAO X N,YUE M Q,LIU Y,et al. Genetic diversity of domestic and foreign sweetSorghumgermplasm revealed by SSR markers[J].JournalofPlantGeneticResources,2010,11(4): 407-412.(in Chinese with English abstract)
[21] 田承华,程庆军,高海燕,等. 高粱种质资源SSR标记遗传多样性与农艺性状关联分析[J]. 安徽农业科学,2018,46(32): 26-32.
TIAN C H,CHENG Q J,GAO H Y,et al. Genetic diversity and association analysis using SSR markers and agronomic traits inSorghum[J].JournalofAnhuiAgriculturalSciences,2018,46(32): 26-32.(in Chinese with English abstract)
[22] 吕芃. 高粱资源材料茎秆含糖量等相关性状的关联定位分析[D]. 北京: 中国农业科学院,2014.
LÜ P. Association mapping analysis of sugar-related traits inSorghum[Sorghumbicolor(L.)][D]. Beijing: Chinese Academy of Agricultural Sciences,2014. (in Chinese with English abstract)
[23] 李伟忠. 玉米自交系遗传多样性与表型性状关联分析及分子ID构建[D].哈尔滨: 东北农业大学,2011.
LI W Z. Genetic diversity evaluation,association analysis of phenotypic traits and molecular ID construction in maize[D]. Harbin: Northeast Agricultural University,2011. (in Chinese with English abstract)
