水稻稻瘟病抗病基因挖掘及育种研究进展
2021-06-30燕孟娇贾晓清郝丽芬宋培玲皇甫海燕郭晨皇甫九茹杨永青史志丹李子钦
燕孟娇,贾晓清,郝丽芬,宋培玲,皇甫海燕,郭晨,皇甫九茹,杨永青,史志丹,李子钦
(内蒙古自治区农牧业科学院植物保护研究所,内蒙古呼和浩特010031)
水稻是最重要的粮食作物之一,全球有一半以上的人口以稻米为主食。面对世界人口的逐年快速增长,提高水稻产量仍是至关重要的研究课题。稻瘟病由稻瘟病菌(Magnaporthe oryzae)引起,是世界范围内水稻最严重的真菌病害,严重限制了水稻的生产,每年造成约1.57亿t稻米的产量损失[1]。目前,防治稻瘟病的方法主要有使用杀菌剂、田间管理和培育抗病品种。杀菌剂的过度使用及残留对食品安全和环境造成威胁。利用宿主自身抗病基因,培育稳定、有效、广谱、持久的抗病品种是控制稻瘟病最安全有效和经济的方法[2-3]。真菌群体中的致病性变异和不断进化对携带单个抗病基因的抗性品种造成新的威胁,通常在3~5年内突破单基因产生的抗病性,有必要聚合多个优良、广谱抗病基因创造持久抗病的新品种。无论是短期还是长期抗病育种,都需要考虑基因、基因型和群体水平产生的影响。通过基因定位能鉴定产生抗病性的基因或者基因组位点,并评估效果的强度、种族特异性和对持久性的潜在贡献。在基因型水平上,抗性表现受宿主中抗性基因数量及其特异性组合的影响。在育种计划中,需要考虑抗性基因对其他有价值性状(例如品质、环境适应性等)的直接或间接影响[4]。
1 抗稻瘟病抗病基因的克隆进展
抗病性一般不是质量性状就是数量性状,质量抗病性状在识别和应答病原菌的过程中已有较清晰的认识,大部分的抗病(resistance,R)基因编码与病原菌识别有关的蛋白。R基因多为显性基因型,也存在一些隐性抗病基因,可能是易感病基因发生变异缺失引起的[4]。数量抗病性状由多个位点共同产生抗病效应,多表现为不完全抗病。随着高通量测序、分子标记、全基因组关联分析(GWAS)等技术的发展,鉴定得到越来越多的QTLs,大多数主效QTLs的功能与R抗病基因相同或相似。CHAIPANYA等[5]在广谱抗病品种Jao Hom Nin中检测到的两个QTLs:QTL1具有部分抗性,QTL11具有完全抗性。通过基因克隆和序列分析发现,QTL1和QTL11分别编码了Pish和Pi7的等位基因。FANG等[6]利用抗病品种Bodao和感病品种Suyuuo杂交得到的212个RILs,定位到两个抗稻瘟病的QTLs:主效QTL qPb11-1和次要QTL qPb6-1。主效QTL qPb11-1(Pb-bd1)有6个候选基因等待验证。
水稻全基因组序列的发布与生物信息学技术的发展,为水稻抗稻瘟病基因的定位和克隆提供了新思路。到目前为止,已经鉴定出102个R基因和350多个QTLs参与稻瘟病菌的防御过程[7-10]。其中,39个R基因(表1)已被克隆,这些基因均是通过传统的图位克隆获得的[3,7,9,11-14]。除了pi21、Pid2、Ptr、bsr-d1和CDS1基因,大部分R基因编码NBS-LRR(Nucleotide-binding domain leucine-rich repeat)类蛋白。其中Pita、Pi2、Pi9、Pigm、Pb1和Pi67具有广谱抗性,其余NBS-LRR类R基因的抗谱较窄。Pb1编码一个缺失P-loop结构域的CC-NBS-LRR蛋白,是一个具有广谱抗性且抗性持久的R基因。PB1蛋白能够保护水杨酸途径的关键转录因子WRKY45不被降解,从而提高水稻的稻瘟病抗性。Pigm编码2个受体蛋白PigmR和PigmS。PigmR具有广谱抗病性,但会使水稻种子变小,产量降低。PigmS不产生抗病性,但可以竞争性地结合PigmR形成异源二聚体,抑制PigmR的抗病功能,同时提高结实率。经过长期进化和人工选择,PigmS基因受表观遗传调控,在叶片、茎秆等病原菌侵染的组织部位表达量很低,对PigmR的功能影响较小,为病原菌提供一个“避难所”,可能延缓病原菌的进化。Pigm使水稻既不影响产量又能具有广谱、持久的抗性[15]。在抗病品种Tetep中已鉴定得到3个R基因,Pi-l、Pi-kh和Pi-ta。JOSHI等[16]利用BSA技术和精细定位在Tetep的后代品系TDH251得到新的抗稻瘟病基因Pi67,编码NBS-LRR蛋白。
Pid2基因编码含825个氨基酸的跨膜受体蛋白激酶(receptor-like kinase,RLK),其氨基端含有疏水信号肽、PAN结构域和跨膜结构域(TM),羧基端是典型的丝氨酸/苏氨酸激酶结构域(STK)。与其他R基因不同的是含有一个特异的B-lectin结构域。Pid2第441个氨基酸发生突变,导致TM域结构中IIE-rich motif的缺失,不能激活下游防御系统,改变了该基因的抗感特性[17]。
pi21基因编码一个富含脯氨酸的蛋白质,包含互作结构与重金属结合域,重金属结合域可能与植物防御反应有关。对Pi21基因单倍型分析发现,Pi21编码脯氨酸富集序列的区域缺失18 bp和48 bp两端序列能增强抗病性[12]。
LI等[13]通过GWAS分析66份非广谱抗病水稻,发现Bsr-d1启动子区域SNP33位置发生单碱基突变后对稻瘟病产生持久的抗性。bsr-d1基因编码一个含有C2H2型锌指结构的转录因子,直接受MYB转录因子家族调控。发生碱基变异的bsr-d1与MYBS1转录因子紧密结合,抑制了等位基因Bsr-d1的表达并影响下游两个过氧化物酶的表达,使H2O2降解减弱,细胞内H2O2富集,提高了水稻的免疫反应和抗病性。
在美国广泛种植的水稻品种Katy中检测到一个Pi-ta的抗病位点,包含Pi-ta、Pi-ta2和Ptr 3个R基因。用3个只含有Ptr基因,但缺乏Pi-ta和Pi-ta2的重组自交系(RILs)S/C272,S/C324,和S/C353检测抗病性,发现Ptr基因具有广谱且独立于Pi-ta的稻瘟病抗性。但是基于目前的数据,还不能完全区分Ptr和Pi-ta2。Ptr编码一个AMR结构域,E3连接酶也存在该结构域,可能与R基因介导的防御反应有关。对Ptr突变体的序列分析发现,在第4个外显子中有一段12 bp序列的缺失与抗病相关[18]。
WANG等[14]通过图位克隆得到CDS1基因,它编码环核苷酸门控离子通道蛋白OsCNGC9,该蛋白通过介导PAMP诱导的钙离子流,与抗性机制相关的类受体激酶OsRLCK185互作,通过磷酸化修饰改变其通道活性,过表达OsCNGC9可触发水稻ROS爆发和诱导PTI相关防御基因的表达,从而提高水稻苗期稻瘟病抗性。
章孟臣[19]利用全基因组关联分析,分离到抗稻瘟病新基因BRG8,定位于细胞质中。BRG8在籼稻群体中有3种单倍型:Hap1,Hap2,Hap3。它正调控病程相关基因PAL,PBZ/PR10和转录因子WRKY45、WRKY53的表达量,从而增强水稻抗病性。
马世伟[20]利用基因组重测序的SNP分析克隆了两个抗稻瘟病新基因,BRG1和BRW1。BRG1编码859个氨基酸的NBS-LRR蛋白,定位在细胞质,OsBRG1蛋白的抗性与抗稻瘟病蛋白Os07g0105900的相互作用有关。同时OsBRG1能够通过GL7基因调控籽粒形状。OsBRW1基因编码1203个氨基酸的NBS-ARC蛋白,具有保守结构域NBS(P-Loop、GLPL、Kinase-2a和RNBS-D)和CC,但不具有典型的WRKY结构域。OsBRW1介导的稻瘟病抗性可能与MAPK6/12、WRKY45和PRs基因的协同表达有关。
随着分子生物学的快速发展,一大批参与稻瘟病抗性反应的基因(如类NPR1基因,WRKY转录因子基因等)通过突变体或其他途径分离得到,具有免疫应答功能,但这些功能与品种间的遗传变异不一定相关。这类参与稻瘟病抗性的基因功能已基本明确,未来可以挖掘这些基因的潜力用于作物品种改良(表1)[2,7,13-16,18,21-53]。
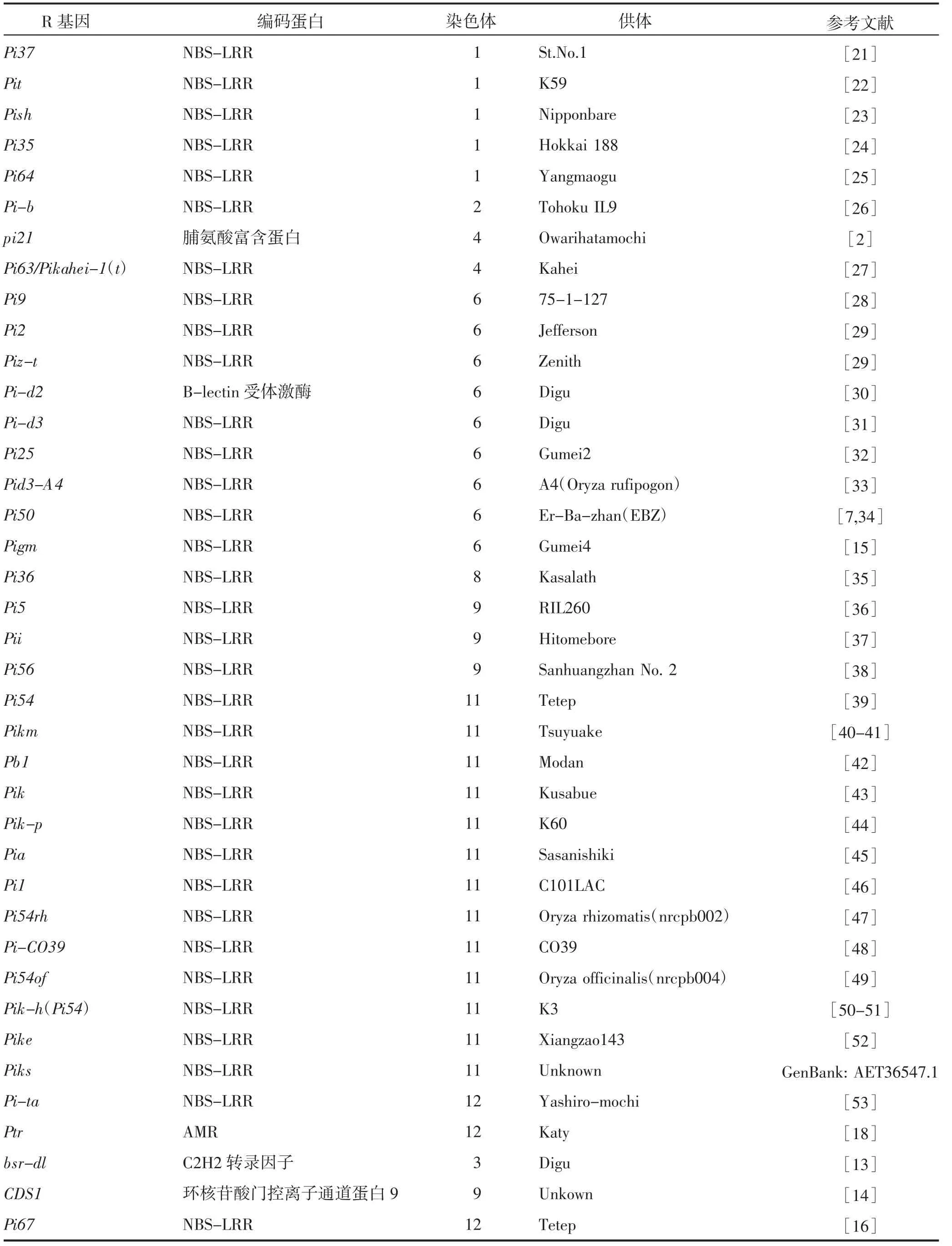
表1 已克隆的39个稻瘟病R基因
2 抗病基因的育种应用进展
2.1 分子标记选择辅助育种
利用分子标记辅助选择(marker assisted selection,MAS)技术,通过精确转移感兴趣的基因区域和加快轮回亲本基因组的恢复,缩短育种时间,是目前可用于所需组合将所需基因转移到所需水稻品种中的最先进方法[54]。许多抗病基因与分子标记例如限制性片段长度多态性(RFLP),简单序列重复(SSR)和单核苷酸多态性(SNP)紧密连锁,以及密集的分子遗传图谱开发与利用,为MAS应用挖掘目标性状主要基因和QTLs奠定了基础。ZHENG等利用SNPs和Indels分子标记定位到抗稻瘟病新基因Pi65(t)[9]。
国内外一直很注重抗稻瘟病种质资源的发掘,利用已有R基因/QTLs连锁的标记,有利于种质资源的分类和基因型的确定,筛选广谱、持久的抗性材料进行育种。KUROKAWA等通过与Nipponbare基因组序列进行比较分析,已在水稻中鉴定出170万个SNPs[55-56]。
ELLUR等[57]通过分子辅助回交育种(MABB)技术将两个携带抗稻瘟病的显性抗病基因Pi2和P54的品种与印度广泛种植的Basmati品种PB1121和PB6回交,利用分子标记SSRs和SNPs进行前景目标基因选择和背景选择后杂交,使这两个抗性基因聚合于PB1121和PB6的近等基因系(NILs),加快育种进程。同时发现在背景恢复的估算上,SSR对背景恢复的估算高于SNP,可能是由于多态性SSR标记不如SNP标记广泛,使用SNP标记能更准确地分析检测背景恢复程度和NILs中的目标基因。MIAH等[58]利用两个标记RM6836和RM8225将Piz、Pi2和Pi9 3个显性的抗病新基因转入品种MR219,使用SSRs标记检测背景恢复,最终得到的13个基因导入系的背景恢复平均为95.98%。DAS等[59]成功地利用最接近的标记RG64和P28,将两个广谱水稻抗稻瘟病基因Pi2和Pi9转入改良品种Tapaswini。
TIAN等[60]开发特异性标记Pi9/2,能有效检测出群体中含抗性基因的后代。HUANG等[61]利用群体中存在的SNP多态性,建立基因组筛选(GS)模型用于有效分析抗稻瘟病基因的遗传变异。FANG等利用MAS方法和抗病QTL qPb11-1(Pb-bd1)的标记,从商品品种NJ46(易感)中开发了3个能显著增强穗稻瘟病抗性的Pb-bd1基因渗入系[6]。裘烨[62]以Tetep、地谷B作为抗稻瘟病基因供体,应用分子标记辅助选择育种技术,改良5份稻瘟病抗性较差的受体恢复系亲本。最后筛选出6个改良恢复系:具有Pi-kh基因的2个抗病纯系TR2、TR4和具有Pi-d1(t)抗病基因的4个抗病纯系DR3、DR4-1、DR4-2、DR1。田间稻瘟病抗性较高,农艺性状优良,在配组时能获得较好的组合。
MAS加快了当前的水稻育种进程,目前利用的MAS辅助育种主要基于已有的标记开展育种工作:(1)收集和鉴定种质资源遗传和表型多样性;(2)评估这些种质资源;(3)将已有的R基因/QTLs转入广泛种植的品种。未来的研究中,我们可以充分利用基因组数据,打破只能使用已有分子标记设计新品种的局限性。
2.2 多基因的分子聚合育种
抗稻瘟病育种的主要难题是遗传抗性的持久性。由于新的强毒种的出现,随着时间的流逝,仅含有特定病原体中的单个R基因的水稻品种经常变成易感。将多个重要农艺性状关键基因聚合在单一品种是一种有效的育种策略。
FUKUOKA等[24]在广谱持久抗稻瘟病的品种Owarihatamochi中发现1种系的抗病类型,由4个QTLs控制:pi21、Pi34、qBR4-2和qBR12-1。其中,pi21、Pi34是已经克隆的抗稻瘟病基因,qBR4-2和qBR12-1定位在染色体的R基因簇上。随后他们将这4个位点的等位基因转入易感品种Aichiasahi,田间检测所有含单个等位基因的均表现不完全抗性,受环境影响较大。聚合4个位点的NIL材料对稻瘟病抗性完全且稳定。ELLUR等[57]也在田间诱发病害检测中发现,携带Pi2+Pi54聚合基因的NILs比携带单抗病基因具有广谱抗稻瘟病性,这些开发的NILs材料在2015年已经进入印度品种测试的最后阶段。
KUMARI等[63]首次利用共转化技术将两个抗稻瘟病基因Pi54和Pi54rh转入易感病的材料,获得两个抗性基因叠加,具有广谱抗性转基因品系。该方法可以在短时间内完成多个抗病基因的共转化,且不存在连锁阻力。随后选用广谱、强力的M.oryzae菌株Mo-ei-ger1对转基因材料进行毒力检测。Mo-ei-ger1能敲除大部分抗性基因,包括Pi54。与非转基因品系相比,堆叠型转基因IET17021品系(Pi54+Pi54rh)对Mo-ei-ger1品系表现出完全抗性。这两个R基因叠加的籼稻转基因品系可作为水稻抗稻瘟病育种的新种质资源[64]。XIAO等[3]利用具有良好农艺性状的粳稻07GY31开发了携带广谱抗病基因Pi9,Pizt和Pi54的单基因NILs:NILPi9,NILPizt和NILPi54,以及相应NILs杂交产生的PPLs(polygene pyramid lines):PPLPi9+Pi54和PPLPizt+Pi54,结果显示所有NILs和PPLs抗病频率均显著高于亲本07GY31;聚合多基因PPLs的抗病频率在叶片中均高于NILs;在稻穗中,PPLPizt+Pi54的抗病频率高于单基因的NILPizt和NILPi54,呈现出简单的基因叠加效应;而稻穗中PPLPi9+Pi54显著低于NILPi9的抗病频率,可能是由于OsRac1与Pi9的NB-AC区域相互作用后启动免疫反应而未能与Pizt结合,表明主要抗稻瘟病的R基因之间存在更加复杂的互作方式[3]。因此,在多R基因的聚合育种中,应考虑不同的主要抗病基因会产生不同的分子免疫反应,选择合适的主要抗病基因进行聚合育种。
水稻中的多基因聚合育种通常只涉及1~2个性状的基因或QTLs,DAS等[59]尝试在改良品种Tapaswini(已含有4个抗白叶枯病的基因,Xa4+Xa5+Xa13+Xa21)中聚合10个基因/QTLs,包括抗稻瘟病基因Pi2和Pi9,抗五倍子蝇基因Gm1和Gm4,耐淹基因Sub1以及耐盐基因Saltol。利用常规方法(农艺方法、籽粒质量方法)和SSR标记,最大限度地恢复轮回亲本基因组。筛选出10个存在或不存在不同基因组合的目标基因或QTLs的品系,4个基因聚合品系(ITGP1、ITGP2、ITGP4和ITGP5)拥有全部10个基因,对常见的生物和非生物胁迫具有较高的抗性/耐受性,产量仅略低于轮回亲本,展示了基因聚合在水稻育种中的巨大潜力[59]。
2.3 基因组编辑育种
基因组编辑是一种精准和高效的基因工程方法,其中CIRISPR/Cas9系统利用简单的核苷酸互补配对方式结合在基因组靶位点,构建简单、高效,在植物中广泛用于基因功能的鉴定、优良品质的培育和种质资源挖掘等方面。利用CRISPR/Cas9系统对一些已知R基因的进行编辑,不仅能获得具有抗性或优质的育种材料,而且在育种周期上节约了大量的时间。CRISPR/Cas9系统在水稻的品质改良、抗除草剂、抗白叶枯病、创建不育系等方面均有应用[65-70],但在稻瘟病抗病育种上的研究较少。XIE等[71]在位点Pizh检测到两个候选基因,利用CRISPR/Cas9编辑Pizh-1和Pizh-2基因,发现这两个基因同时被编辑的突变体丧失抗性,表明二者是协同产生稻瘟病抗性。TGMS系在两系杂交育种体系中起着重要的作用。Pinzhan材料是一种三系育种的中间材料,具有良好的农艺性状和外观。它由于缺乏强恢复基因,Rf4保持力较弱,恢复力也较差,不能直接用于三系育种。LI等[70]利用CRISPR/Cas9系统创建tms5/pi21/xa13突变体,两年内成功地将Pinzhan转化为新的TGMS品系(PinzhanS),同时增强抗病性。靶向基因TMS5突变存在于大多数商品化的TGMS系中,Pi21的隐性等位基因pi21广谱抗稻瘟病,以及Xa13的隐性等位基因xa13抗白叶枯病。本研究为中间育种材料转化为TGMS系提供了一种方便、有效的方法,加快不育系的选育。
3 展望
目前在抗病基因、防御反应以及导致水稻防御反应激活的信号转导方面已经取得了长足的进步,但整个抗稻瘟病的防御机制还不是很清楚。了解稻瘟病菌的遗传特性以及水稻抗病性分子生物学的研究,有助于改良水稻品种,提高产量。传统育种方法有许多种,如回交育种、重复选择育种、突变育种等,在保存野生种质、对比亲本间的有性杂交、新的遗传变异和突变等方面仍然发挥重要作用。但传统育种在筛选、去除不需要的基因上存在局限性,利用新的分子技术(转基因、分子标记、基因编辑等)、功能基因组学和DNA芯片等方法作为传统育种的补充,比表型筛选更简单,节约时间、精力和资源,还可以快速消除不良的植物基因型,改进育种程序[56,72]。
目前抗性基因/QTLs在育种中的应用主要集中在几个持久广谱抗性的基因上,如pi21、Pi2、Pi9、Pigm、Pb1和Pi34等。抗病基因的研究可以充分利用重测序、GWAS、SNPs分子标记等技术,鉴定更多广谱、持久的抗性基因/QTLs。稻瘟病菌的遗传变异和不断进化很容易打破单基因抗性,具有多抗性基因/QTLs的品种具有更加持久的抗性。开发抗性基因/QTLs的分子标记,通过MAS、共转化以及基因编辑等技术将它们聚合在品质优良的品种中。XIAO的研究表明,聚合抗性基因并不是简单的基因叠加效应,抗性基因的不同组合可能直接导致不同的抗性水平。在抗稻瘟病育种过程中,寄主植物中不同的稻瘟病抗性基因的组合,可以考虑靶基因的优良等位基因。虽然持久抗病性是一个重要的育种目标,但不能简单地把持久抗病性问题当作植物育种问题处理。利用异质(包括间作和类似的)群体可以有效地减少病原体的进化。因此,促使遗传和育种技术进步的同时,还要加强遗传资源管理、杂交项目、多环境试验和育种过程中的其他必要阶段,尽可能降低作物改良的潜在威胁。
