胶质细胞源性神经营养因子在大鼠神经病理性疼痛模型中的作用及机制研究*
2021-06-28金学廷邱正红刘向国
金学廷,邱正红,刘向国
(1.安徽医科大学附属巢湖医院疼痛科,安徽合肥238000;2.安徽中医药大学中西医结合学院,安徽合肥230012)
神经病理性疼痛主要是由于躯体的感觉神经受到一定的损伤所致,神经病理性疼痛的发病时间一般很长,有的患者会持续数月或数年,其特征主要为自发性的疼痛、痛觉过敏和超敏等[1]。神经病理性疼痛对人类的健康产生严重的威胁,严重患者会失去自主行动的能力,该疾病在全国范围内困扰着数百万的患者,因此神经病理性疼痛成为神经科学者们首要关注的疾病[2]。神经病理性疼痛的发病机制非常复杂,神经元、免疫细胞和胶质细胞激活等都参与其发生和发展[3]。目前临床上对于该疾病的治疗一般会采用药物治疗,例如阿片类、抗惊厥类和抗抑郁类等,但由于参与的病理和生理机制较多,以上药物的疗效都不理想,成为治疗神经病病理性疼痛领域中的难题。胶质细胞源性神经营养因子(glial cell derived neurotrophic factor,GDNF)是近些年发现的一种新型的营养因子[4]。早期研究发现[5],GDNF 不仅能提高培养的多巴胺神经元细胞的存活率,还能为已经发育好和成熟的神经元提供相应的营养,使神经元细胞更好地分化。有学者发现[6],GDNF 和神经病理性疼痛有着很大的关系,其对损伤的轴突再生有一定的促进作用,进而恢复损伤。研究显示[7],GDNF 不仅能保护神经损伤,还为治疗神经损伤开辟新的治疗途径。PINK1 是一个具有丝氨酸/苏氨酸蛋白激活性的线粒体外膜蛋白,其在受损伤的线粒体中起到分子感受器的作用。Parkin 是一种具有E3泛素蛋白连接酶的蛋白,并且具有其活性,同时也可以调节不同蛋白的降解,从而起到转导信号的作用。PINK1和Parkin基因在很多组织和器官中都有显著表达,特别是在高耗能的器官中表达最为明显[8]。帕金森病患者体内的呼吸链复合物1 功能会受到一定损伤,这让帕金森病患者体内的应激反应不断加重,从而激活PINK1/Parkin 通路介导的线粒体自噬[9]。此外,PINK1/Parkin 通路的基因发生改变,线粒体的自噬因此出现异常,从而不同程度地损伤线粒体的聚集,导致神经元发生萎缩甚至完全死亡,这也是导致神经系统发生病变的主要机制之一[10]。但目前关于GDNF 对PINK1 和Parkin 影响的相关性研究较少,所以本文探究GDNF 通过PINK1/Parkin 信号通路对大鼠神经病理性疼痛的作用及其机制。
1 材料与方法
1.1 实验动物
SPF 级SD 大鼠购自北京维通利华实验动物技术有限公司[实验动物使用许可证号:SYXK(京)2018-0012],共计30 只。体重200~220 g,适应性饲养7 d后用于实验。
1.2 试剂和仪器
GDNF(美国Pepro Tech 公司),PINK1 抗体、Parkin 抗体(美国CST 公司),日立HT7800 型透射电镜(日本日立公司),测痛仪(美国North Coast 公司),贝克曼高速冷冻离心机XPN100(美国Beckman 公司),超低温冰箱(日本Sanyo 公司)。
1.3 鞘内置管
大鼠均腹腔注射10%水合氯醛(350 mg/kg)进行麻醉,经枕骨大孔进行鞘内置管。置管后2 d未出现神经系统异常表现的大鼠经导管注入2%利多卡因20 μl,注射药物后大鼠出现双后肢麻痹并于0.5 h 内恢复即为置管成功,将置管成功的大鼠分笼单独饲养,用于后续实验。
1.4 模型复制及鞘内给药
将30 只大鼠按随机数字表法分为Sham 组(假手术组)、NP 组(神经病理性疼痛模型组)、GDNF组(治疗组),每组10 只。采用坐骨神经压榨性损伤(chronic constrictioninjury,CCI)法复制单侧神经病理性疼痛大鼠模型。麻醉大鼠后,切开大鼠皮肤,分离大鼠的肌肉组织,使坐骨神经的主干全部暴露在外,并对其进行结扎,4 个小结的间隔距离为1 mm。最合适的力度是让神经外膜有轻微的压迫感,部分血管受到阻断,大鼠的肢体出现稍微的冲动。当大鼠伤口全部缝合后,所有实验大鼠全部注射青霉素,以防止感染。Sham 组大鼠除不结扎外,其他手术步骤同模型组。Sham 组和NP 组大鼠鞘内注射10 μl 生理盐水,隔日1 次;GNDF 组大鼠鞘内注射用生理盐水稀释为10 μl 的GDNF 2 μg,隔日1 次。3 组大鼠均连续给药14 d。
1.5 标本采集
1.5.1 蛋白标本收集麻醉大鼠后,将大鼠的背部皮肤全部剪开,使大鼠的脊柱节段全部暴露出来,逐层分离脊柱表面和脊柱两侧的肌肉,将两侧的肋骨全部剪断。取CCI 模型大鼠同侧脊髓灰质前角,找到大鼠头端的追关口,用注射器将磷酸盐缓冲液(PBS)注入椎管内,借助液体压力将脊髓完整吹出。用无菌手术刀片取出脊髓腰膨大部位,即L4~L6节段脊髓组织,立刻放入液氮中速冻2 h,存储于-80℃的冰箱中。
1.5.2 透射电镜标本收集取L4~L6脊髓组织迅速置于2.5%戊二醛和1.0%锇酸中双重固定,待作透射电镜切片。
1.6 大鼠一般情况观察及行为学测定
手术及给药后,观察3 组大鼠的存活、伤口感染、肢体出现瘫痪及导管脱落等情况。
1.6.1 机械缩足反射阈值(MWT)的测定分别于CCI 前,CCI 后第3 天、第7 天、第14 天测定3 组大鼠的MWT 值,并计算大鼠的缩足阈值。在金属的筛网上放置一个透明的玻璃箱,让大鼠在玻璃箱中适应新环境15 min。用纤维丝从大鼠后足的中间位置进行直接刺激,刺激的时间为6 s,大鼠阳性反应为抬足或添足。测定大鼠的力度从2 g 开始,最大力度为26 g,当力度超过26 g 时也计为26 g。对大鼠进行刺激而没出现任何阳性反应时,应该用相邻高的力度再次刺激;对大鼠进行刺激后很快地出现炎症反应时,应该用相邻低的力度再次进行刺激。连续刺激所有大鼠,记录大鼠第一次出现阳性反应的情况,再连续测定5 次,每次刺激间隔10 min。计算50%阳性反应刺激力度,即为大鼠的MWT。
1.6.2 热痛阈值(TWL)的测定分别于CCI 前、CCI 后第3 天、第7 天和第14 天测定3 组大鼠TWL值。把大鼠放置在玻璃板上,让其适应新环境15 min,对大鼠的足底部进行热痛敏刺激。照射过程中,将大鼠第1 次出现抬腿的时间记为TWL。大鼠足部照射时间一次不能超过30 s,防止大鼠的足底部受到损伤。测定1 次TWL,共测定5 次,分别取后3 次的平均值。
1.7 透射电镜观察大鼠脊髓L4~L6 节段自噬小体数量和线粒体形态
将固定后的脊髓组织常规树脂包埋,制成厚度为80 nm 的超薄切片,裱贴于铜网上,3%醋酸铀-枸橼酸铅双重染色,透射电镜观察大鼠脊髓L4~L6节段自噬小体数量和线粒体形态。每张切片取10 个视野进行观察。
1.8 Western blotting 检测大鼠脊髓组织中PINK1 和Parkin 蛋白表达
将解冻的50 mg 脊髓组织取出,裂解细胞并提取核蛋白,并对核蛋白的浓度进行测量,分装后,保存在-20℃的冰箱中。提取的蛋白溶液和缓冲溶液按照4∶1 的比例混匀,蛋白溶液全部进行煮沸处置。将50 μg 的蛋白样品注入电泳板。将电泳板的蛋白样品全部转到PVDF 膜,脱脂奶粉封闭1 h。加入一抗前,用TTBS 溶液洗涤,每次漂洗10 min,一共漂洗3 次,漂洗后再加入二抗,稀释后封闭1 h。最后取出PVDF膜,用TTBS 溶液再次漂洗,DAB 溶液显影后观察。
1.9 统计学方法
数据分析采用SPSS 19.0 统计软件。计量资料以均数±标准差(±s)表示,比较采用重复测量设计的方差分析。P<0.05 为差异有统计学意义。
2 结果
2.1 3组大鼠一般情况比较
3 组大鼠手术后恢复良好,均无感染、死亡及肢体瘫痪的情况出现。Sham 组大鼠的情况良好;NP 组大鼠手术侧肢体后爪有内收的现象,偶有大鼠跛行;与NP 组大鼠比较,GDNF 组大鼠的情况明显好转。
2.2 3组大鼠行为学特点比较
Sham 组、NP 组及GDNF 组大鼠术前及术后3 d、7 d、14 d 的MWT 和TWL 比较,采用重复测量设计的方差分析,结果:①不同时间点的MWT 值及TWL 值有差异(FMWT=220.200,PMWT=0.000;FTWL=48.040,PTWL=0.000)。②Sham 组、NP 组及GDNF 组大鼠MWT 值及TWL 值比较有差异(FMWT=122.700,PMWT=0.000;FTWL=121.100,PTWL=0.000)。③Sham组、NP 组及GDNF 组大鼠MWT 值及TWL 值变化趋势有差异(FMWT=24.39,PMWT=0.000;FTWL=15.82,PTWL=0.000)。见表1、图1 和表2、图2。
表1 3组大鼠MWT比较 (n=10,g,±s)
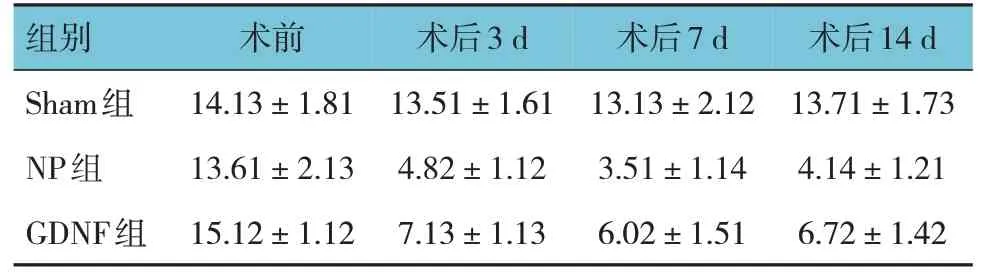
表1 3组大鼠MWT比较 (n=10,g,±s)
组别Sham组NP组GDNF组术前14.13±1.81 13.61±2.13 15.12±1.12术后3 d 13.51±1.61 4.82±1.12 7.13±1.13术后7 d 13.13±2.12 3.51±1.14 6.02±1.51术后14 d 13.71±1.73 4.14±1.21 6.72±1.42
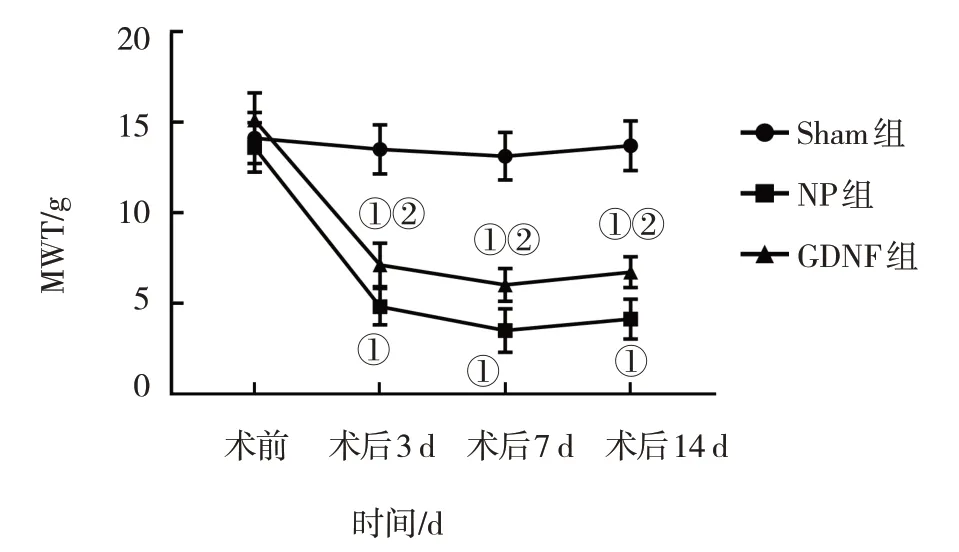
图1 3组大鼠MWT比较
表2 3组大鼠TWL比较 (n=10,s,±s)
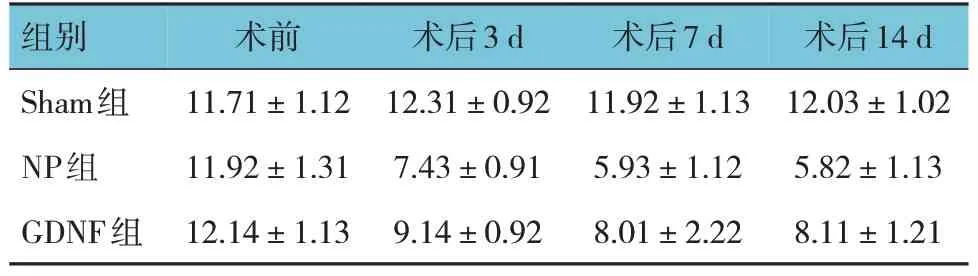
表2 3组大鼠TWL比较 (n=10,s,±s)
组别Sham组NP组GDNF组术前11.71±1.12 11.92±1.31 12.14±1.13术后3 d 12.31±0.92 7.43±0.91 9.14±0.92术后7 d 11.92±1.13 5.93±1.12 8.01±2.22术后14 d 12.03±1.02 5.82±1.13 8.11±1.21
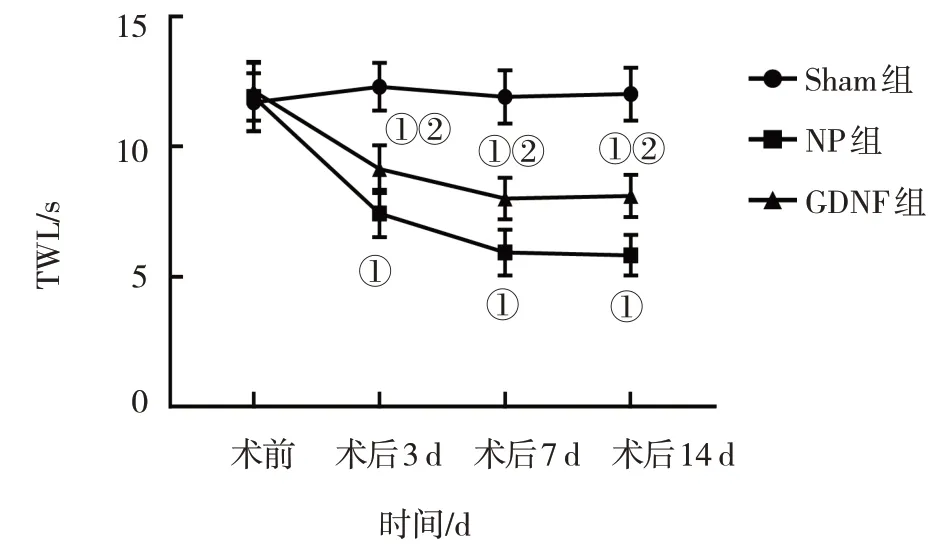
图2 3组大鼠TWL比较
2.3 3组大鼠线粒体形态和自噬小体数量比较
Sham 组大鼠脊髓组织细胞结构完整,线粒体的结构相对完好,线粒体未见肿胀或空泡、小室的现象;与Sham组比较,NP组大鼠脊髓组织中完整自噬小体双膜结构较少,线粒体分别出现肿胀甚至空泡变性,还有一部分线粒体会和溶酶体相互融合;GDNF组大鼠脊髓组织的情况明显好于NP组。见图3。
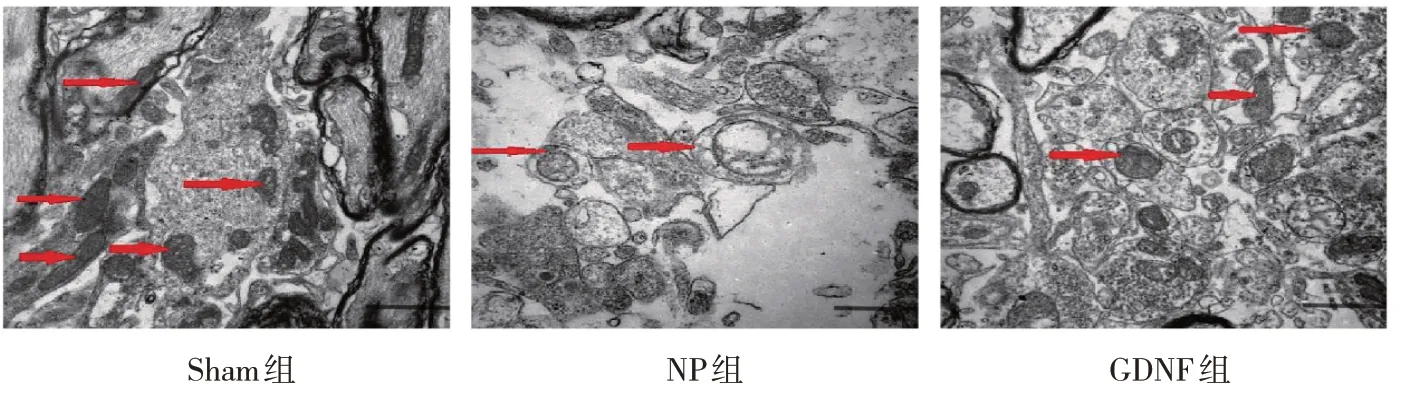
图3 3组大鼠脊髓组织中的线粒体和自噬小体 (透射电镜×25 000)
2.4 大鼠脊髓组织中PINK1和Parkin蛋白表达
3 组大鼠各10 只,与Sham 组PINK1 和Parkin 蛋白比较显示,NP 组大鼠脊髓组织中的蛋白升高(P<0.05);经过GDNF 干预治疗后发现,GDNF 组大鼠脊髓组织中PINK1 和Parkin 蛋白降低(P<0.05)。见图4 和图5。
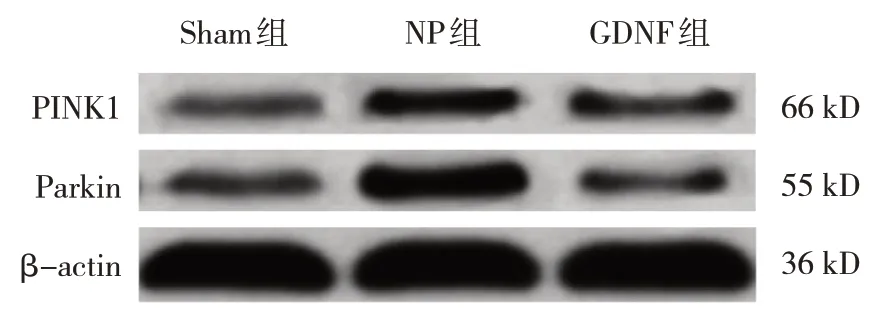
图4 3组大鼠脊髓组织中PINK1和Parkin蛋白表达
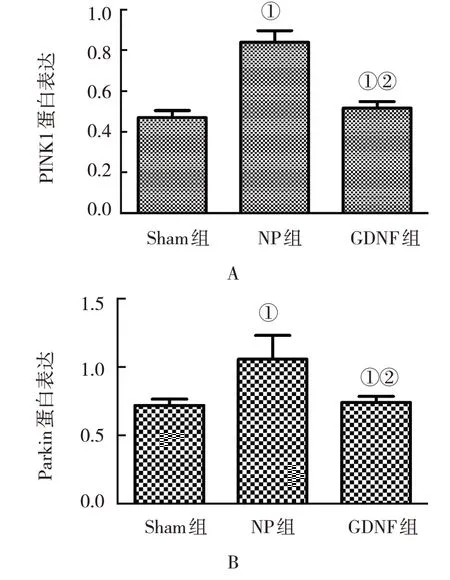
图5 3组大鼠脊髓组织中PINK1和Parkin蛋白表达
3 讨论
神经病理性疼痛是最为常见的一种慢性疾病,其与受损神经部位神经元正常生理活动发生改变有关[11-12]。神经元通过异常放电向脊髓神经元发放异常冲动,强化脊髓兴奋性,同时让感觉功能出现异常。有研究发现,神经病理性疼痛在动物实验中存在自噬现象[13]。金桂林等[14]研究发现,当外周神经受到损伤后,其中的GABA神经元和星形胶质细胞的自噬功能会受到损伤,这很可能是神经病理性疼痛对其的诱导。线粒体自噬在自噬过程中具有一定的选择性,介导受损细胞的清除。线粒体自噬功能紊乱可能会导致许多系统功能紊乱,如肿瘤、心血管、肌肉等相关疾病[15]。PINK1/Parkin 作为主要的信号转导通路,参与细胞调控线粒体自噬。既往认为,Parkin在细胞线粒体自噬中扮演主要角色。但最新研究显示,在线粒体损伤中,PINK1不仅是主要的标志,也能有效地清除细胞中失去功能的线粒体。自噬这一生理过程普遍存在于真核生物细胞内,将细胞可利用成分进行分解回收,同时清除无用细胞成分,包括细胞质、蛋白和细胞器等。生理情况下,神经细胞会通过线粒体的自噬作用对线粒体的质量进行调控,让受到损伤的线粒体全部清除,从而发挥神经细胞的保护作用。到目前为止,还没发现彻底治疗神经病理性疼痛的方法,并且对其发病机制也不是十分清楚。GDNF是近些年新发现的一种神经营养因子,在所有的运动神经元营养因子中也是最活跃的[16]。因此本文用GDNF对神经病理性疼痛大鼠进行干预,研究其对脊髓组织中PINK1蛋白和Parkin蛋白的影响。
本实验复制CCI模型,通过对大鼠行为学的观察比较发现,3 组大鼠MWT 和TWL 在CCI 前的阀值均没有明显变化,与Sham组大鼠的术后3 d、7 d和14 d的MWT 和TWL 比较,NP 组大鼠明显降低;经过GDNF 干预后,GDNF 组大鼠在各个时间的MWT 和TWL比NP组大鼠明显增加。可见GDNF对NP模型大鼠发挥了镇痛作用。同时,与NP组大鼠相比,GDNF组大鼠脊髓组织一般情况明显好转,并且线粒体的数目也显著增多,提示GDNF 可抑制NP 模型大鼠脊髓组织细胞自噬活性,同时对线粒体损伤具有改善作用。在本研究中,经过GDNF 干预后NP 模型大鼠脊髓组织细胞自噬活性改变与大鼠疼痛行为学改变呈相反趋势,同时伴有线粒体数目和形态的改变,由此可认为,GDNF 可能通过调控脊髓组织线粒体自噬活性,改善线粒体损伤,从而参与对NP 大鼠模型镇痛作用的机制。陈贵军等[17]通过对脑卒中大鼠的研究发现,脑卒中大鼠神经肝细胞移植治疗时,神经干细胞经GDNF修饰后,可有效提升治疗效果,同时减轻神经损伤的程度。李真真等[18]通过对神经病理性疼痛大鼠的研究发现,雷帕霉素可不同程度地提高大鼠的机械痛阀值和热刺激痛阀值。
目前,Parkin和PINK1信号是线粒体自噬的主要途径,其对线粒体功能的维持和代谢都起重要作用[19]。目前,在线粒体的自噬障碍中,Parkin和PINK1信号起着重要的介导作用,同时对退行性疾病也有严重影响。在正常的线粒体外膜中PINK1呈低表达,几乎检测不到,只有当内源性PINK1的表达升高才会检测到其存在。聚集在线粒体外膜的PINK1具有募集Parkin的作用。PINK1与Parkin会相互作用,从而对线粒体自噬的活性进行调节,以此对线粒体的数量和功能进行有效维持。有研究证实,GDNF 能有效地保护神经损伤,进而抑制神经病理性疼痛,DRG 神经元中和伤害性有关的物质、P 物质和VRI 的表达均可通过GDNF 上调[20]。A 类纤维物质会直接影响神经损伤而造成的神经痛,同时NGF 也会对A 类纤维物质进行调节,所以GDNF 在不表达NGF 的DRG 神经元中就显得特别重要,并且极有可能在神经病理性疼痛中起重要作用。本研究通过大鼠PINK1 和Parkin 蛋白的表达发现,NP 组大鼠的PINK1 和Parkin 蛋白表达升高;当NP 模型大鼠经过GDNF 干预后,大鼠脊髓组织中PINK1 和Parkin 蛋白显著降低。因此可以推测,PINK1 和Parkin 通路活性降低,介导脊髓组织细胞线粒体自噬水平的改变,进而发挥其对NP模型大鼠的镇痛作用,其可能是GDNF 对NP 模型大鼠发挥治疗作用的机制之一。MEKA 等[21]发现,GDNF 可降低大鼠Parkin 蛋白的表达,从而预防多巴胺能神经元变性。CHOONG 等[22]通过对帕金森病的研究证实,新型神经营养因子GDNF 能有效地抑制PINK1 蛋白的表达,从而有效地减轻帕金森病的严重程度。
综上所述,GDNF 的作用机制可能是通过抑制PINK1 蛋白和Parkin 蛋白的表达,从而有效地减轻神经病理性疼痛。
