白细胞介素-37在结肠癌组织中的表达及其对结肠癌细胞增殖、侵袭的作用*
2021-06-28刘月红赵家宁王科任博王文帅
刘月红,赵家宁,王科,任博,王文帅
(西安市第四医院1.临床检验中心,2.输血科,陕西西安710004;3.重庆市永川区人民医院检验科,陕西西安412060;4.沣东新城公共卫生管理中心,陕西西安710086)
结肠癌是我国常见的消化道恶性肿瘤之一,发病率及病死率呈逐年升高趋势[1-2]。手术切除、辅助化疗、靶向治疗是临床治疗结肠癌的主要手段,但治疗过程中的复发率、转移率较高,整体预后并不理想。癌细胞过度增殖及侵袭是与结肠癌复发、转移直接相关的恶性生物学行为,针对癌细胞的增殖、侵袭进行干预也是结肠癌新治疗手段的靶点。
白细胞介素-37(Interleukin-37,IL-37)是近年来新发现的白细胞介素-1 家族的抑炎细胞因子,在固有免疫应答及适应性免疫应答中均发挥重要作用[3]。近年来,炎症微环境与恶性肿瘤发生的关系受到了越来越多的关注[4-5],具有抑炎作用的IL-37也被证实能够在宫颈癌、膀胱癌、肺癌等恶性肿瘤中发挥抑癌作用[6-8]。但IL-37 是否参与结肠癌细胞恶性生物学行为的调控仍未明确。为探讨IL-37在结肠癌发生、发展中的作用,探究未来使用IL-37治疗结肠癌的可能性,本研究检测IL-37 在结肠癌组织中表达的变化,并通过体外实验探讨其对结肠癌细胞增殖、侵袭的作用。
1 材料与方法
1.1 临床标本
收集2017年4月—2019年4月在西安市第四医院手术切除的结肠癌组织及其癌旁组织,共42 例。均取得患者的知情同意及医院伦理委员会的批准。
1.2 细胞
结肠癌HT29 细胞购自中国科学院上海生命科学研究院细胞资源中心,液氮中冷冻保存。
1.3 试剂与仪器
空白pcDNA3.1 质粒、表达IL-37 的pcDNA3.1 重组质粒由生工生物工程(上海)股份有限公司设计并合
成,质粒浓度2.0 mg/ml;转染试剂LipofectamineTM2000购自美国Invitrogen 公司,MTS 细胞增殖检测试剂盒购自美国Promega 公司,IL-37、信号转导及转录活化因子3(STAT3)、磷酸化信号转导及转录活化因子3(p-STAT3)、蛋白激酶B(Akt)、磷酸化蛋白激酶B(p-Akt)的单克隆一抗购自英国Abcam公司,DP430总RNA 提取试剂盒、KR118 cDNA 第一链合成预混试剂盒、FP209 Talent 荧光定量检测试剂盒(SYBR Green)购自北京天根公司。
1.4 方法
1.4.1 细胞培养及分组HT29 细胞用含有10%胎牛血清的RPMI 1640 在培养瓶中贴壁培养,0.25%胰蛋白酶常规消化并传代继续培养。取传代后对数生长期的细胞,分为对照组、空白质粒组、IL-37 质粒组。对照组用不含转染试剂、质粒的RPMI 1640 处理;空白质粒组用LipofectamineTM2000 转染空白pcDNA3.1 质粒,质粒终浓度为1.0 μg/ml;IL-37质粒组用LipofectamineTM2000 转染表达IL-37 的pcDNA3.1重组质粒,质粒终浓度为1.0 μg/ml。每个处理条件设置6 个复孔,连续处理24 h。
1.4.2 MTS 检测细胞增殖能力传代细胞接种于96 孔板中,分组处理24 h 后,采用MTS 细胞增殖检测试剂盒检测细胞的增殖能力,按照试剂盒说明书进行操作,染色后在酶标仪490 nm 波长处检测光密度(OD)值,OD 值越高表示细胞增殖能力越强。
1.4.3 Transwell 实验检测细胞侵袭活力在Transwell 的上室预涂基质胶,而后传代细胞接种在Transwell 的上室并分组处理;向下室加入含有10%胎牛血清的RPMI 1640,趋化上室内的细胞进行侵袭。24 h 后,取下小室膜,结晶紫染色后在显微镜下观察,随机取5 个视野进行细胞计数。
1.4.4 Western blotting 检测IL-37、p-STAT3、p-Akt蛋白表达取结肠癌组织、癌旁组织和分组处理后的HT29 细胞,采用RIPA 裂解液提取组织及细胞中的蛋白,测定蛋白含量后取30 μg 蛋白进行Western blotting 检测。将蛋白样本加入聚丙烯酰胺凝胶中电泳,而后电转移至NC膜,用5%脱脂牛奶封闭NC膜2 h,用1∶1 000 稀释的IL-37、STAT3、p-STAT3、Akt、p-Akt 一抗4℃孵育过夜;次日,用1∶1 000 稀释的HPR 二抗孵育NC 膜1 h,显影后得到蛋白条带,根据条带灰度值计算IL-37、p-STAT3、p-Akt 蛋白相对表达量,β-actin为阴性对照。
1.4.5 qRT-PCR 检测细胞周期蛋白D1(Cyclin D1)、B 淋巴细胞瘤-2(Bcl-2)、基质金属蛋白酶2(MMP-2)、基质金属蛋白酶9(MMP-9)mRNA 相对表达量取分组处理后的HT29 细胞,采用总RNA提取试剂盒分离细胞中的RNA,采用cDNA 第一链合成预混试剂盒将RNA 逆转录为cDNA,最后采用Talent 荧光定量检测试剂盒配置PCR 体系对cDNA进行扩增,反应条件:95℃预变性3 min,95℃变性15 s、60℃退火25 s,重复40 个循环。β-actin 为阴性对照。Cyclin D1、Bcl-2、MMP-2、MMP-9 正反向引物序列见表1。自动生成循环阈值(Ct),2-△△Ct法计算Cyclin D1、Bcl-2、MMP-2、MMP-9 mRNA 相对表达量。

表1 引物序列
1.5 统计学方法
数据分析采用SPSS 20.0 统计软件,计量资料以均数±标准差(±s)表示,比较采用t检验或方差分析,进一步两两比较用LSD-t检验,P<0.05 为差异有统计学意义。
2 结果
2.1 结肠癌组织与癌旁组织中IL-37 蛋白相对表达量的比较
结肠癌组织和癌旁组织中IL-37 蛋白相对表达量为(0.31±0.07)和(0.92±0.16)。两者比较,经t检验,差异有统计学意义(t=19.393,P=0.000),结肠癌组织中IL-37 蛋白相对表达量降低。见图1。
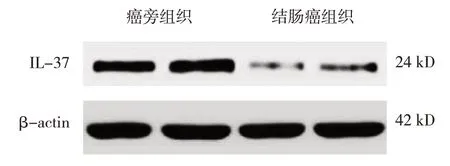
图1 结肠癌组织与癌旁组织中IL-37蛋白相对表达量
2.2 3 组结肠癌HT29 细胞中IL-37 蛋白相对表达量的比较
结肠癌HT29 细胞中,对照组、空白质粒组和IL-37 质粒组的IL-37 蛋白相对表达量分别为(0.20±0.06)、(0.22±0.08)和(0.98±0.21),3 组比较,经方差分析,差异有统计学意义(F=11.384,P=0.000);进一步两两比较,IL-37 质粒组IL-37 的蛋白相对表达量高于对照组及空白质粒组(P<0.05)。见图2。
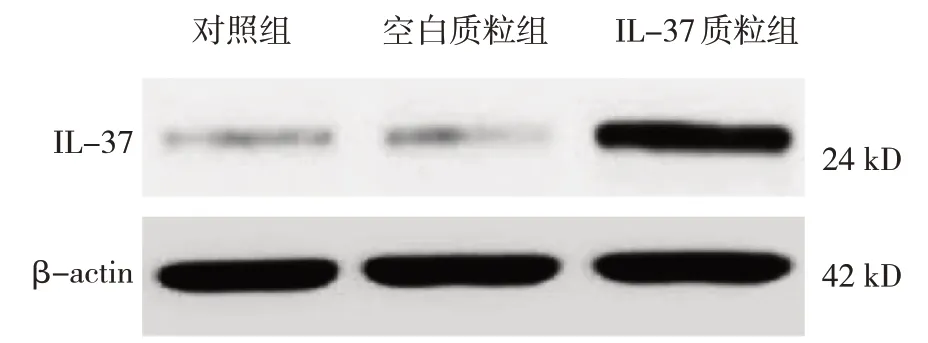
图2 3组HT29细胞中IL-37蛋白相对表达量
2.2 3 组结肠癌HT29 细胞的OD 值和穿膜细胞数比较
3 组结肠癌HT29 细胞的OD 值和穿膜细胞数比较,经方差分析,差异有统计学意义(P<0.05);进一步两两比较,IL-37 质粒组的OD 值、穿膜细胞数较对照组及空白质粒组降低。见图3 和表1。
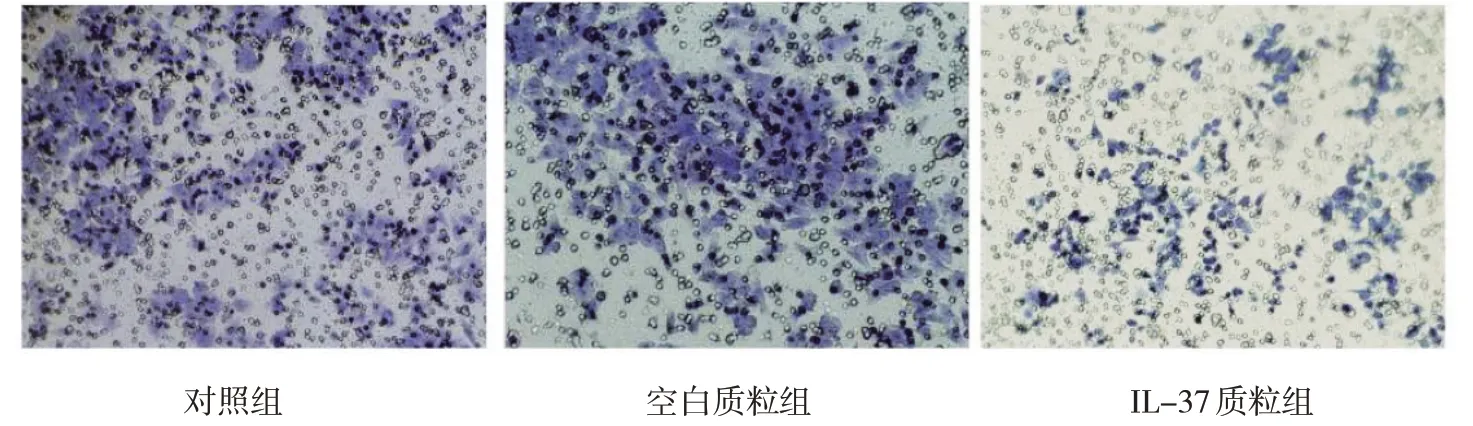
图3 3组结肠癌HT29细胞侵袭能力比较 (结晶紫染色×400)
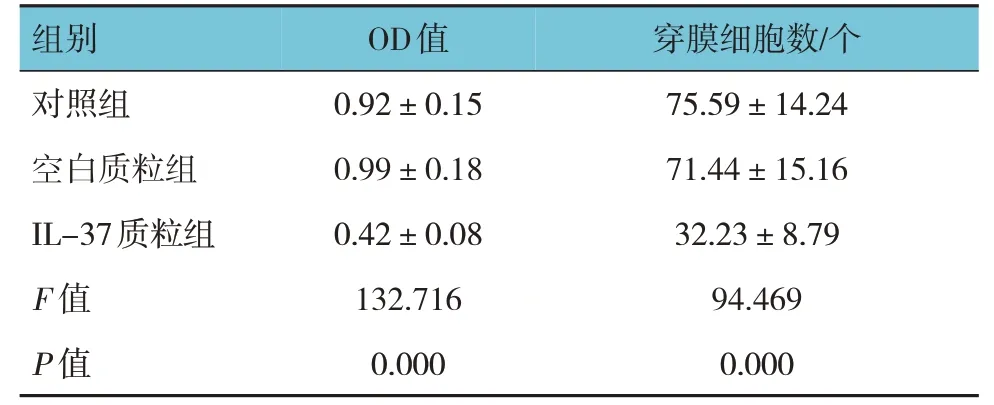
表1 3组HT29细胞的OD值和穿膜细胞数的比较(x±s)
2.3 3 组结肠癌HT29 细胞的Cyclin D1、Bcl-2、MMP-2、MMP-9 mRNA相对表达量比较
3 组结肠癌HT29 细胞的Cyclin D1、Bcl-2、MMP-2、MMP-9 mRNA 相对表达量比较,差异有统计学意义(P<0.05);进一步两两比较,IL-37 质粒组CyclinD1、Bcl-2、MMP-2、MMP-9 mRNA 相对表达量较对照组及空白质粒组降低(P<0.05)。见表2。
表2 3组结肠癌HT29细胞的Cyclin D1、Bcl-2、MMP-2、MMP-9 mRNA相对表达量的比较 (±s)
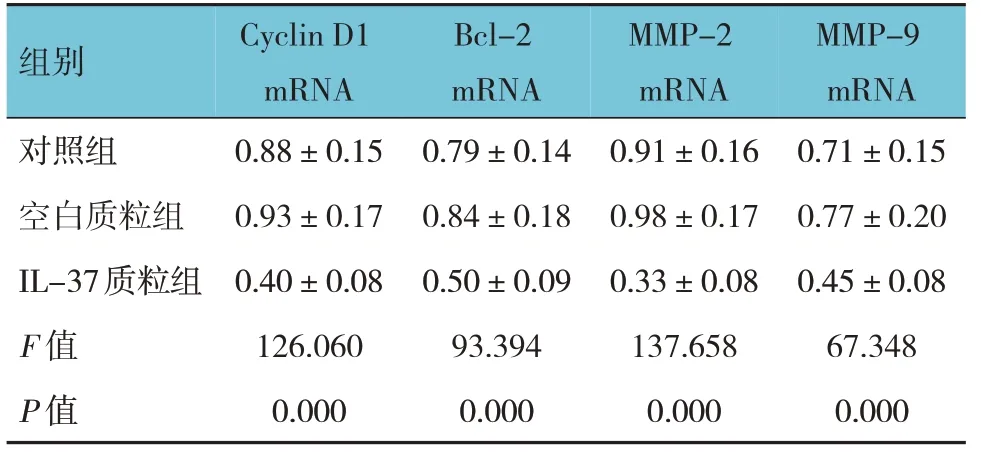
表2 3组结肠癌HT29细胞的Cyclin D1、Bcl-2、MMP-2、MMP-9 mRNA相对表达量的比较 (±s)
组别Cyclin D1 mRNA Bcl-2 mRNA MMP-2 mRNA MMP-9 mRNA对照组空白质粒组IL-37质粒组F 值P 值0.88±0.15 0.93±0.17 0.40±0.08 126.060 0.000 0.79±0.14 0.84±0.18 0.50±0.09 93.394 0.000 0.91±0.16 0.98±0.17 0.33±0.08 137.658 0.000 0.71±0.15 0.77±0.20 0.45±0.08 67.348 0.000
2.4 3 组结肠癌HT29 细胞中p-STAT3、p-Akt 蛋白相对表达量的比较
3 组结肠癌HT29 细胞中p-STAT3、p-Akt 蛋白相对表达量的比较,经方差分析,差异有统计学意义(P<0.05),进一步两两比较,IL-37 质粒组较对照组及空白质粒组p-STAT3、p-Akt 的蛋白相对表达量降低(P<0.05)。见表3 和图4。
表3 3组结肠癌HT29细胞中p-STAT3、p-Akt蛋白相对表达量的比较 (±s)
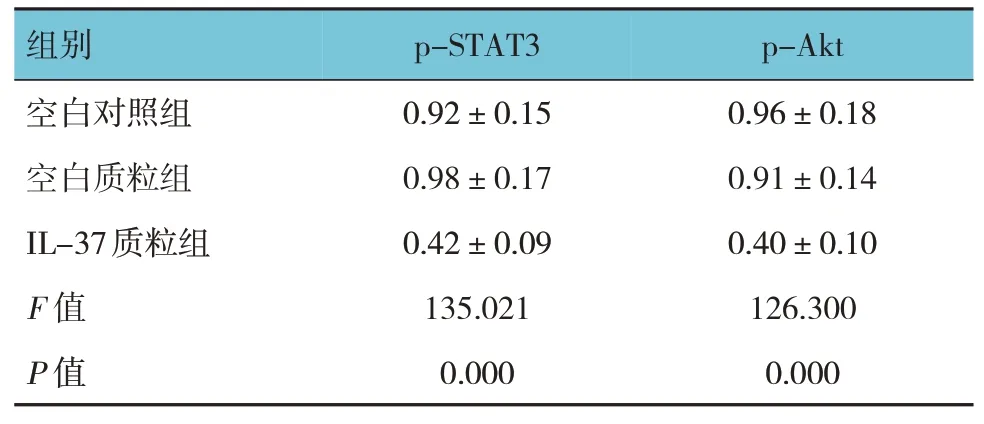
表3 3组结肠癌HT29细胞中p-STAT3、p-Akt蛋白相对表达量的比较 (±s)
组别p-STAT3 p-Akt空白对照组空白质粒组IL-37质粒组F 值P 值0.92±0.15 0.98±0.17 0.42±0.09 135.021 0.000 0.96±0.18 0.91±0.14 0.40±0.10 126.300 0.000
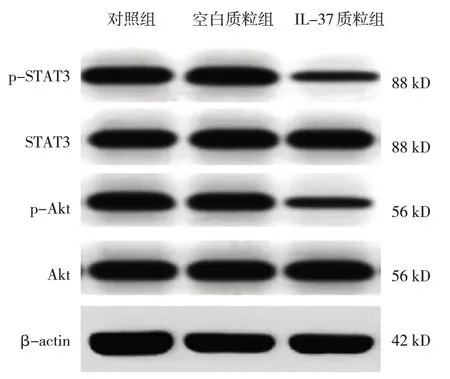
图4 3组结肠癌HT29细胞中p-STAT3、p-Akt蛋白的表达
3 讨论
结肠癌的发生涉及多因素、多环节,其中炎症微环境与结肠癌发生的关系近年来受到越来越多的关注[9]。在肿瘤的炎症微环境中,多种促炎因子、趋化因子、血管新生因子表达增多,进而促进肿瘤细胞的增殖、迁移、侵袭及肿瘤新生血管的形成[10-12]。IL-37是新型的抑炎细胞因子,对多种促炎因子、趋化因子的生成具有抑制作用。已有报道,结肠癌IL-37低表达患者的无进展生存期较IL-37 高表达患者明显缩短[13-14]。本研究所检测的结肠癌组织及癌旁组织中,结肠癌组织中IL-37 蛋白相对表达量低于癌旁组织。以上结果提示IL-37 表达减少与结肠癌的发生、发展及预后转归均密切相关,IL-37可能具有抑癌作用,本研究进一步通过体外细胞实验来验证IL-37的抑癌作用。
有研究报道,IL-37 对宫颈癌、膀胱癌、肺癌等恶性肿瘤细胞的增殖、侵袭具有抑制作用[6-8]。本研究在体外实验中观察IL-37 对结肠癌细胞增殖、侵袭的抑制作用。已培养的结肠癌HT29 细胞用LipofectamineTM2000 转染表达IL-37 的pcDNA3.1 重组质粒,可以观察到结肠癌HT29 细胞中IL-37 蛋白相对表达量增多,说明转染表达IL-37 的重组质粒能够引起结肠癌HT29 细胞中IL-37 的过表达。在过表达IL-37 后分别通过MTS 细胞增殖试剂盒和Transwell 实验检测细胞增殖及侵袭可知,细胞的OD 值及侵袭能力均降低,说明过表达IL-37 能够显著抑制结肠癌HT29 细胞的增殖和侵袭,与既往关于IL-37 在其他恶性肿瘤中的抑癌作用吻合[15-16]。
在结肠癌发生发展过程中,结肠癌细胞的增殖和侵袭受到相应基因的调控,Cyclin D1和Bcl-2是促进细胞增殖的基因,MMP-2和MMP-9是促进细胞侵袭的基因。已有研究报道,结肠癌组织中上述增殖和侵袭基因的表达均明显增多[17-20]。Cyclin D1能够使细胞周期加速并促进细胞有丝分裂,Bcl-2能够拮抗线粒体途径凋亡并促进细胞异常增殖,MMP-2和MMP-9能够水解细胞外基质及基底膜并促进细胞向邻近组织侵袭[21]。在本研究中,转染质粒过表达IL-37 后,结肠癌HT29 细胞中Cyclin D1、Bcl-2、MMP-2 和MMP-9 mRNA 相对表达量均降低,说明IL-37 对结肠癌细胞中促增殖及促侵袭基因的表达具有抑制作用,这与IL-37 抑制结肠癌细胞增殖、侵袭的作用吻合。
在明确IL-37 能够抑制结肠癌细胞增殖、侵袭并调节相应基因的表达后,本研究还对IL-37 发挥上述作用的分子机制进行了初步的探索。宫颈癌、肺癌的相关研究证实,IL-37 能够通过抑制STAT3的激活来发挥抑癌作用[8,21];肝癌的相关研究证实,IL-37 能够通过抑制Akt 的激活来发挥抑癌作用[22]。在结肠癌中,STAT3 和Akt 的表达均明显增多[23-24],且阻断STAT3/Akt 通路能够抑制离体培养结肠癌细胞的增殖,增强顺铂化疗的敏感性[25]。本研究在转染质粒过表达IL-37 后,IL-37 质粒组细胞中的p-STAT3、p-Akt 蛋白相对表达量降低,说明IL-37 对结肠癌细胞中STAT3/AKT 通路的激活具有抑制作用,这也可能是IL-37 在结肠癌中发挥抑癌作用的分子机制。
综上所述,IL-37 在结肠癌组织中表达减少;在体外实验中,增加IL-37 的表达能够抑制结肠癌细胞的增殖、侵袭,且该抑制作用可能与抑制STAT3/Akt 通路有关,今后IL-37 有望成为治疗结肠癌的新靶点,但本研究未能得到IL-37 直接通过STAT3/Akt 通路抑制结肠癌细胞增殖、侵袭的证据。今后应进一步使用STAT3/Akt 通路抑制剂或设计STAT3、Akt 的siRNA,在过表达IL-37 的同时联用STAT3/Akt 通路抑制剂或siRNA,以此来验证IL-37通过STAT3/Akt 通路抑制结肠癌细胞增殖、侵袭的作用。
