‘红阳’猕猴桃褐斑病病原菌分离鉴定及防治药剂毒力测定*
2021-06-27张荣全马继玲尹显慧李文志吴小毛龙友华
冉 飞,张荣全,袁 腾,马继玲,尹显慧,李文志,樊 荣,吴小毛,龙友华
(1 贵州大学农学院,贵阳 550025)(2 贵州大学猕猴桃工程技术研究中心)(3 水城县东部农业产业园区管理委员会)
猕猴桃属猕猴桃科(Actinidiaceae)猕猴桃属(Actinidia),在我国资源极为丰富,有中华猕猴桃(Actinidia chinensis)、美味猕猴桃(Actinidia deliciosa)、毛花猕猴桃(Actinidia eriantha)、软枣猕猴桃(Actinidia arguta)等62 个种,其中美味猕猴桃和中华猕猴桃栽培利用最为广泛[1-3]。‘红阳’(Actinidia chinensis cv.Hongyang)属中华猕猴桃系列,是一个早熟品种,原产于四川省苍溪县,其果实皮薄肉多,香甜可口,果肉颜色鲜美,营养价值丰富[4],现已列入“国家级品种保护资源”[5]。随着市场需求的扩大,‘红阳’猕猴桃在贵州省六盘水地区发展迅速,品质优良,果大端正,为当地经济特色水果[6]。但近几年来,该地区‘红阳’猕猴桃受褐斑病危害极为严重,叶片常干枯卷曲,严重时可致落叶落果,甚至整株枯死,对‘红阳’猕猴桃优质高产造成严重影响。
植物褐斑病为一种真菌性病害,关于其病原菌的研究主要有危害白及叶片的燕麦镰刀菌(Fusarium avenaceum)[7]、危害冬瓜叶片的多主棒孢[Corynespora cassiicola(Berk&Curt)Wei][8]、危害核桃果实的链格孢菌(Alternaria alternate)[9]、危害茶叶的格孢腔菌属真菌(Pleospora camelliae Dippen )[10]、危害葡萄的葡萄拟尾孢菌(Pseudocercospora vitis)[11]、危害地锦叶片的地锦叶点霉(Phyllosticta partricuspidatae)[12]等。目前关于贵州省‘红阳’猕猴桃病原菌的研究,有雷霁卿等[13]报道了危害六盘水地区‘红阳’猕猴桃果实软腐病的病原菌有葡萄座腔菌(Botryosphaeria sp.)、交链孢菌(Alternaria sp.)、拟茎点霉菌(Phomopsis sp.)、小新壳梭孢菌(Neofusicoccum sp.)及间座壳菌(Diaporthe sp.),Li 等[14]虽将六盘水地区‘红阳’猕猴桃叶片上的褐斑病菌鉴定为 Alternaria tenuissima,但尚未对该病菌开展室内毒力试验。鉴于此,筛选出高效、低毒的化学药剂防治‘红阳’猕猴桃褐斑病至关重要。本研究采取形态学结合分子生物学的方法对贵州省六盘水地区‘红阳’猕猴桃褐斑病菌进行系统鉴定,并采用菌丝生长速率法研究6 种药剂对病原菌的抑菌作用,以期为更好地防控‘红阳’猕猴桃褐斑病提供科学依据。
1 材料与方法
1.1 试验材料
1.1.1 供试病样
于2019 年7—10 月,多次在贵州省六盘水地区采集典型病叶,带回实验室置于4 ℃保存,并于24 h 内进行病原菌分离。
1.1.2 供试培养基
马铃薯葡萄糖琼脂培养基(PDA)[15],用于病原菌的分离、纯化培养及室内毒力试验。
1.1.3 主要试剂
CTAB 提取液,Taq DNA 聚合酶,引物ITS1(TC CGTAGGTGAACCTGCGG)、ITS4(TCCTCCGCTTAT TGATATGC)、EF1-728F(CATCGAGAAGTTCGAGA AGG)、EF1-986R(TACTTGAAGGAACCCTTACC)、H31-a(ACTAAGCAGACCGCCCGCAGG)和H31-b(GCGGGCGAGCTGGATGTCCTT)等均购自上海生工生物工程技术服务公司。
1.1.4 供试药剂
97%戊唑醇、96%吡唑醚菌酯、95%苯醚甲环唑、97%咪鲜胺、96%肟菌酯和96%异菌脲,以上原药均购自湖北正兴源精细化工有限公司。
1.2 试验方法
1.2.1 猕猴桃褐斑病病原菌分离、纯化及致病力测试
选取典型病害症状叶片,用灭菌过的剪刀取其病健交界处4 mm×4 mm 大小的组织块,先用75%酒精浸泡10~20 s,去除表面张力,随后放入10%次氯酸钠消毒1~2 min,再用无菌水清洗3 次,最后用无菌滤纸吸干水分并移入PDA 培养基上,置于28 ℃恒温培养箱中暗培养。培养3 d 后,挑取典型单菌落边缘菌丝于PDA 平板上进行多次纯化培养,待菌落为纯种后,采用30%甘油进行冷冻保存。选取健康猕猴桃叶片,标记接种点,用灭过菌的小刀在接种点轻轻刮伤,再将已培养好的菌株用灭过菌的7 mm 打孔器打成菌饼,用接种针挑取菌饼菌丝面紧贴于叶片,叶柄用无菌水浸湿的棉花包裹,置于28 ℃恒温培养箱中培养,定期观察叶片生长情况。待叶片发病后,对发病组织进行再次分离纯化,并与原接种菌进行比对。
1.2.2 病原菌培养特征和显微结构观察
将已纯化菌株转接于PDA 平板上,置于28 ℃恒温培养箱中暗培养,参照《真菌鉴定手册》[16]观察菌落形态、颜色及生长速度等特征,并在显微镜下观察菌丝、孢子形态和产孢情况。
1.2.3 病原菌总DNA 的提取
采用改良 CTAB 法提取病原菌的基因组DNA[17]。
1.2.4 PCR 序列扩增
采用上海生工生物工程技术服务公司合成的ITS1 和ITS4、EF1-728F 和EF1-986R、H31-a 和H31-b 3 对引物分别对病原真菌的rDNA-ITS、TEF1-α 和Histone 3 基因进行PCR 扩增。扩增产物送至上海生工生物工程技术服务公司进行测序工作。
40 μL PCR 反应体系:2×Taq PCR StarMix 20 μL,正反向引物(10 μmol/L)各2 μL,DNA 模板2 μL,ddH2O 14 μL。
PCR 扩增程序:94 ℃预变性2 min;94 ℃变性30 s,退火30 s(rDNA-ITS:58 ℃,TEF1-α:56 ℃,Histone 3:55 ℃),72 ℃延伸60 s,共32个循环;72 ℃修复延伸10 min,4 ℃保存。
1.2.5 PCR 扩增产物序列分析
将获得的各基因序列提交至 NCBI 网站GenBank 数据库中进行BLAST 比对分析,使用PAUP 软件建立系统发育树。
1.2.6 病原菌防治药剂室内筛选
根据预期试验结果,利用母液稀释法将各供试原药配成5 个有效浓度,戊唑醇终浓度为3.233 3、1.077 8、0.359 3、0.119 8、0.039 9 mg/L,吡唑醚菌酯终浓度为3.200 0、1.066 7、0.355 6、0.118 5、0.039 5 mg/L,苯醚甲环唑终浓度为9.500 0、1.055 6、0.117 3、0.013 0、0.001 4 mg/L,咪鲜胺终浓度为0.692 9、0.099 0、0.014 1、0.002 0、0.000 3 mg/L,肟菌酯终浓度为19.200 0、1.476 9、0.113 6、0.008 7、0.000 7 mg/L,异菌脲终浓度为0.640 0、0.320 0、0.160 0、0.080 0、0.040 0 mg/L,备用。将PDA 培养基加热熔解,待冷却至手可以触碰时,将PDA 培养基与药剂以9∶1 的比例混合,并倒于培养皿中冷却凝固。用接种针挑取7 mm 已活化菌饼的菌丝面紧贴于含药平板中央,密封。以不加药剂但含等量溶剂的PDA 平板为对照,每处理4 次重复。将接种好的含药平板倒置于28 ℃恒温培养箱中暗培养,待对照组菌落生长至整个培养皿的2/3 时,采用十字交叉法测量各处理的菌落直径,计算平均值和抑菌率。

根据各药剂浓度和抑菌率在DPS 7.05 统计软件中求出各药剂的毒力回归方程(y=ax+b)、相关系数(r)和EC50值。
2 结果与分析
2.1 猕猴桃褐斑病症状特征和分离结果
田间调查发现,褐斑病主要危害‘红阳’猕猴桃的叶片,通常从叶片的边缘开始侵染,初期为淡褐色斑点,中期病斑逐渐扩大为近圆形或不规则形病斑,病斑中部灰褐色,外围褐色或深褐色,后期多个病斑融合成大片不规则形,并从叶片边缘逐渐干枯卷曲,最终脱落(图版3-A)。通过传统的组织分离法从病叶典型病斑处分离获得2 株真菌,分别标记为HBB-5、HBB-8。
2.2 病原菌致病性验证
根据柯赫氏法则将HBB-5 和HBB-8 2 株真菌分别刺伤接种于离体叶片上,通过观察可知仅有HBB-8 能使叶片发病,而HBB-5 和对照组在整个培养过程中均不发病。HBB-8 接种于叶片上7 d 后出现可见症状(图版3-B),其发病特征与田间症状特征一致,并对叶片发病部位进行了再次分离纯化培养。通过形态特征和显微结构观察,分离出的菌株与原接种的菌株HBB-8 一致,符合柯赫氏法则,由此表明HBB-8 为引起‘红阳’猕猴桃褐斑病的致病菌。
2.3 病原菌形态观察
菌株在PDA 培养基上暗培养,菌落初期为白色,圆形生长,边缘整齐,2 d 后菌落内围颜色逐渐加深,后期变为灰色至黑褐色,而外围仍为白色,培养7 d 后菌落平均直径为6.53 cm,其气生菌丝茂密,呈绒状(图版3-C-a、b);分生孢子卵形或倒棍棒形,黄褐色至褐色,具1~4 个横隔膜,0~2个纵(斜)隔膜,大小为10.02~23.14 μm×4.32~11.25 μm(图版3-C-c、d);分生孢子梗直立或稍弯曲,暗色,单支,顶生分生孢子(图版3-C-e、f)。根据菌株HBB-8 的形态特征观察,初步鉴定该致病菌为链格孢属真菌[18-20]。
2.4 病原菌分子生物学鉴定
使用真菌通用引物ITS1、ITS4 扩增菌株HBB-8的rDNA-ITS 区域,获得539 bp 大小的DNA 片段,序列提交至GenBank 数据库中进行BLAST 比对分析(ITS:GenBank 登录号为MT358396),发现菌株属于链格孢菌(Alternaria spp.),再通过系统发育树构建,菌株与细极链格孢 A.tenuissima(MN658846、MN685225)和链格孢A.alternata(MN659182、MN653245)2 个种以100%的自展支持率聚在同一分支,其他不同属种则聚在各自的分支上,由此表明,使用rDNA-ITS 基因鉴定不能将A.tenuissima 和A.alternata 2 个种区分开来(图1)。采用链格孢属真菌常用基因TEF1-α 进行PCR 扩增并比对,HBB-8(TEF1-α:GenBank 登录号为MW419902)与细极链格孢菌株 A.tenuissima(LC136865、LC136863、LC136862 等)的同源性均达到100%,在构建的系统发育树中也与 A.tenuissima 聚在同一分支(图2)。再利用另一对引物H31-a 和H31-b 对Histone 3 保守基因进行扩增,由系统发育树显示,菌株HBB-8(Histone 3:GenBank 登录号为MT361348)与A.tenuissima 以很高的支持率聚在一起,而A.alternata 则聚在另一分支上(图3)。
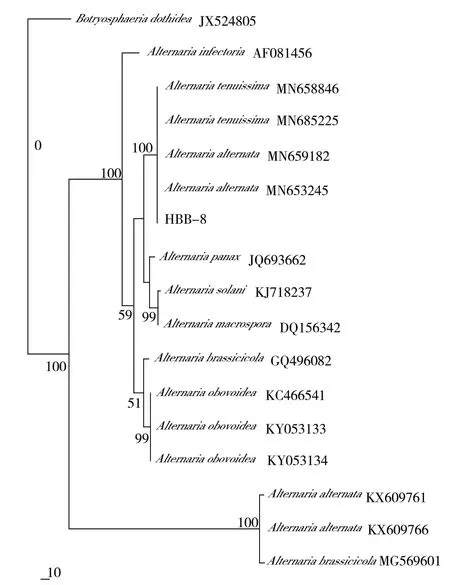
图1 菌株HBB-8 基于rDNA-ITS 序列的系统发育树

图2 菌株HBB-8 基于TEF1-α序列的系统发育树
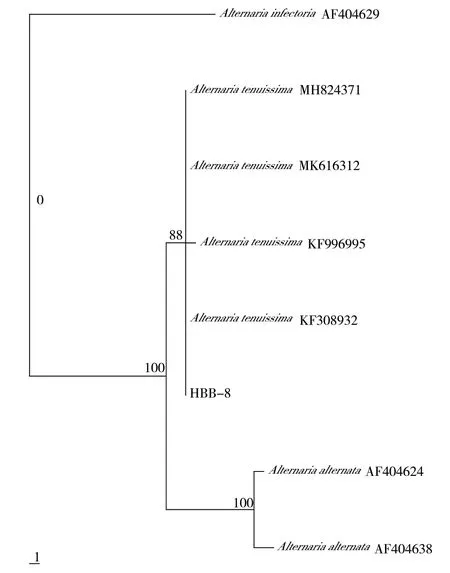
图3 菌株HBB-8 基于Histone 3 序列的系统发育树
结合形态学和分子生物学鉴定,最终明确危害‘红阳’猕猴桃褐斑病的病原为细极链格孢(A.tenuissima)。
2.5 6 种药剂对病原菌菌丝生长的抑制效果
离体抑菌活性测定结果表明,6 种不同药剂均能有效抑制猕猴桃褐斑病菌菌丝的生长,其抑菌活性由强至弱依次为咪鲜胺>苯醚甲环唑>戊唑醇>异菌脲>肟菌酯>吡唑醚菌酯,见表1。咪鲜胺在供试6 种药剂中对褐斑病菌的抑菌活性最强,EC50为0.008 4 mg/L,其次为苯醚甲环唑,EC50为0.055 3 mg/L。戊唑醇、异菌脲和肟菌酯3 种药剂对褐斑病菌菌丝生长具有较好的抑制作用,EC50分别为0.163 6、0.164 3、0.168 2 mg/L。吡唑醚菌酯的抑菌效果相对较差,EC50为0.413 7 mg/L。由此可得,咪鲜胺和苯醚甲环唑2 种药剂对褐斑病菌具有较强的抑制效果,值得用于田间防治该病害。

表1 6 种药剂对细极链格孢菌的抑制效果
3 讨论与结论
链格孢属(Alternaria)真菌适应性强,寄主范围广,为许多重要植物褐斑病的病原菌,如柑橘[19]苹果[21]、猕猴桃[18]、核桃[9]、甜叶菊[22]等。链格孢属、小孢子种为一类近似种,仅依靠形态观察与ITS 序列分析很难明确其具体分类地位[23]。本研究对病原菌的孢子形态和隔膜特征等形态结构进行了观察,发现其形态特征与赵金梅等[18]、李亚等[19]描述的链格孢属真菌基本一致。采用ITS 结合TEF1-α 和Histone 3 基因对病原菌进行分子鉴定,结果发现,危害‘红阳’猕猴桃褐斑病的病原菌与细极链格孢(A.tenuissima)聚在一起,鉴定结果与Li 等[14]研究结果一致。
褐斑病为猕猴桃的主要病害之一,能贯穿于猕猴桃的整个生长季节,目前生产上对该病害的防控主要以化学防治为主。本研究以6 种保护性杀菌剂原药为供试药剂,采用菌丝生长速率法探究其对猕猴桃细极链格孢菌的抑菌效果。试验结果表明,咪鲜胺、苯醚甲环唑、戊唑醇、异菌脲、肟菌酯和吡唑醚菌酯6 种药剂均具有较强的抑菌活性,其中咪鲜胺和苯醚甲环唑的抑菌活性最强,其EC50分别为0.008 4、0.055 3 mg/L。据报道,400 g/L 氟硅唑乳油、500 g/L 异菌脲悬浮剂、10%多抗霉素B 可湿性粉剂和10%苯醚甲环唑水分散粒剂对中华猕猴桃褐斑病链格孢菌(A.alternata)具有较强的抑菌效果[18];25%苯醚甲环唑乳油、25%咪鲜胺乳油、25%丙环唑乳油、25%嘧菌酯悬浮剂和80%代森锰锌可湿性粉剂对猕猴桃叶斑病(Pseudocercospora actinidiae Deighton、Phyllosticta sp.)均具有较高的抑菌活性[24];咪鲜胺锰盐、戊唑醇、氟硅唑、吡唑醚菌酯、丙环唑、异菌脲对‘红阳’猕猴桃叶斑病菌(Corynespora sp.)菌丝生长有较强的抑制作用[25]。本研究结果与前人研究结果基本吻合。但本试验只在室内测定了咪鲜胺和苯醚甲环唑对褐斑病菌有较强的抑菌作用,对于大田防控效果,还有待进一步研究。
咪鲜胺和苯醚甲环唑同为DMI 类杀菌剂,低毒、高效、杀菌谱广,通过破坏或抑制病菌麦角甾醇的合成,使菌体的细胞膜功能受到损坏,从而达到抑制或干扰病菌孢子和菌丝的形成[26-27],对多种真菌病害具有较高的保护和治疗活性[28-29]。本试验也验证了咪鲜胺和苯醚甲环唑2 种药剂对细极链格孢菌具有较强的抑制效果。但目前果树生产上存在诸多问题,如用药盲目、农残超标、环境污染等[30],为此应加强褐斑病发病规律和病菌致病机理的研究,研发有效生物药剂,筛选高效拮抗菌株,并结合农业防治措施,开展猕猴桃病虫害绿色防控。
