基因编辑技术在柑橘中的应用研究进展*
2021-06-27孙立方徐建国柯甫志
孙立方,徐建国,柯甫志
(浙江省柑橘研究所,国家柑橘品种改良中心浙江分中心,台州 318026)
常规育种方法已成功地用于柑橘品种改良和新品种的培育,但由于柑橘植株大、童期长、杂交或自交不亲和、遗传杂合度高、多胚以及单性结实等特性给常规育种工作带来很多困难和限制[1]。因此,常规育种很难在短期内培育具有理想性状的新品种。与常规育种相比,基因工程育种能高效地对植物进行定向改良,缩短育种周期,逐渐成为柑橘定向育种和研究工作的重要手段。近10 余年来,以转基因技术为主的基因工程育种在柑橘抗病育种、抗非生物逆境胁迫以及改良柑橘果实性状等方面的研究已成功取得了一系列进展[2-4]。
作为常规基因工程育种技术的核心,转基因技术虽然可以调控植物中目标基因的表达,但无法实现对目标基因的精准编辑,导致其在基因工程育种的应用过程中受到了一定的限制[5]。基因编辑技术是继转基因技术之后兴起的能够对特定基因位点实现精确编辑的一种基因修饰技术,此项技术的出现为作物的遗传改良和植物基因功能等研究提供了新的思路与途径[6]。据报道显示,作为目前最高效的基因组编辑工具,CRISPR/Cas 系统自2013 年首次被应用于植物以来[7-8],已经成功在24 个科的45 个属植物中应用,包括模式植物、主要作物、园艺及药用植物等[9]。本文介绍了基因编辑技术的发展过程以及CRISPR/Cas 系统的种类和技术优势,综述了CRISPR/Cas 系统在柑橘基因工程育种等研究中的应用进展,并对基因编辑系统目前在柑橘育种应用中存在的问题以及未来的发展趋势进行了探讨。
1 基因编辑技术的发展与应用
基因编辑系统根据序列特异性核酸酶的不同,可以分为3 类:锌指核酸酶(zinc finger nucleases,ZFNs)、类转录激活因子效应物核酸酶(transcription activator like effector nuclease,TALENs)、基于Ⅱ型簇状规则间隔的短回文重复序列(clustered regularly interspaced short palindromic repeats,CRISPR)及其相关蛋白开发的CRISPR/Cas 系统[10]。这3 类基因组编辑系统的作用原理类似,均首先在基因组中产生DNA 双链断裂(DSB),然后通过非同源末端连接(NHEJ)或同源定向修复(HDR)途径修复,但由于这3 类核酸酶在结构、活性和酶作用机制上存在差异,导致靶点选择、效率、特异性和突变特征的差异[10]。其中,ZFNs 和TALENs 在早期的基因组编辑技术中占主导地位,但由于这2 项技术受效率低和适用物种范围小等限制,未能被广泛地应用[11]。而新开发的CRISPR/Cas 基因编辑系统是基于RNA引导的核酸酶,与ZFNs 和TALENs 相比,具有简单、高效和多功能性等优势,成为近年来最主流的基因编辑技术[12]。CRISPR 系统是一种复杂的适应性免疫机制,存在于细菌和古细菌中,用于防御入侵的噬菌体和外源性DNA[13],它于1987 年首次在大肠埃希菌的基因组中被发现[14]。根据其Cas 基因核心元件序列的不同,CRISPR/Cas 系统被分为两大类,并根据其特征基因进一步细分为6 类:I 类CRISPR/Cas 系统(I、III、IV 型)利用多Cas 蛋白复合物进行靶位点的切割,而II 类CRISPR/Cas 系统(II、V、VI 型)利用单个Cas 蛋白与CRISPR-RNAs(crRNAs)形成的复合物对靶位点进行破坏。在CRISPR/Cas 不同类别的系统中,属于II 型的CRISPR/Cas9 系统是目前技术最成熟的基因编辑系统[12]。
随着技术的改进和优化,CRISPR/Cas 系统已从最初的CRISPR/Cas9 发展到现在的多个变种及新的编辑系统,如CRISPR/Cas9 系统及变种(SpCas9、SaCas9、FnCas9、dCas9 和xCas9)、CRISPR/Cas12、CRISPR/Cas13 系统等[15]。这些CRISPR/Cas 系统的优化和新系统的开发解决了 PAM(protospacer adjacent motif)位点和编辑效率等限制,进一步为植物基因组精确编辑提供了更多的选择。然而,在植物细胞中,由于同源重组频率偏低和DNA 供体递送困难,CRISPR 介导的HDR 效率显著受限,往往也难以实现高效的基因组精确编辑[16]。为提高编辑效率和精准性,植物中以CRISPR/Cas 为基础的基因编辑系统不断被优化与升级。碱基编辑(base editing)系统是新近发展的不依赖于HDR 而通过碱基精确替换的新型基因编辑技术,目前主要包括两类:胞嘧啶碱基编辑器(cytosine base editor,CBE)与腺嘌呤碱基编辑器(adenine base editor,ABE),可分别实现C-T(G-A)或A-G(T-C)的碱基替换,自开发以来已被迅速地应用于植物中[17-18]。2019年,Anzalone 等开发了不同于碱基编辑的基因组精准编辑技术,即引导编辑(prime editing)系统[19]。在此基础上,国内学者高彩霞等构建了适于植物表达的引导编辑工具,并成功地在水稻和小麦中完成了DNA 精准编辑[20]。除了针对Cas9 蛋白本身进行优化外,还有研究通过降低Cas9 在体内活化的时间以降低其脱靶效应,如直接向植物细胞内递送sgRNA 和Cas9 蛋白的核糖核苷酸蛋白(RNP)复合物来实现基因编辑[21]。以上这些基因编辑系统经过不断地优化与改进,逐渐创制出具有高效、不依赖HDR和无外源DNA插入等优势的多用途编辑工具,为植物基因组编辑提供了新路径。下面将详细介绍CRISPR/Cas 介导的基因组编辑系统在柑橘中的应用研究进展。
2 基因编辑技术在柑橘中的应用进展
2.1 柑橘中CRISPR/Cas 基因编辑系统的建立和应用
除模式植物和主要作物外,CRISPR/Cas 介导的基因编辑系统已在多种木本果树中成功运用[22-24]。在柑橘中,Jia 等首次将CRISPR/Cas9 系统应用于‘伏令夏橙’(Citrus sinensis Valencia)和‘邓肯葡萄柚’(Citrus paradisi Macf.)中CsPDS 基因的靶向编辑,通过黄单胞杆菌亚种(Xanthomonas citri subsp.citri,Xcc)辅助的农杆菌侵染和瞬时转化方法将Cas9 蛋白和一种合成的sgRNA 导入柑橘,并成功地修饰了CsPDS 基因[24]。测序结果证实了甜橙叶片中 CsPDS 基因在靶位处发生了突变,但Cas9/sgRNA 的编辑效率较低,为3.2%~3.9%,没有检测到脱靶效应[24]。经后期优化,柑橘中建立了稳定的CRISPR/Cas 基因编辑系统[25],并在柑橘抗病育种及基因功能等研究中成功应用(表1)。
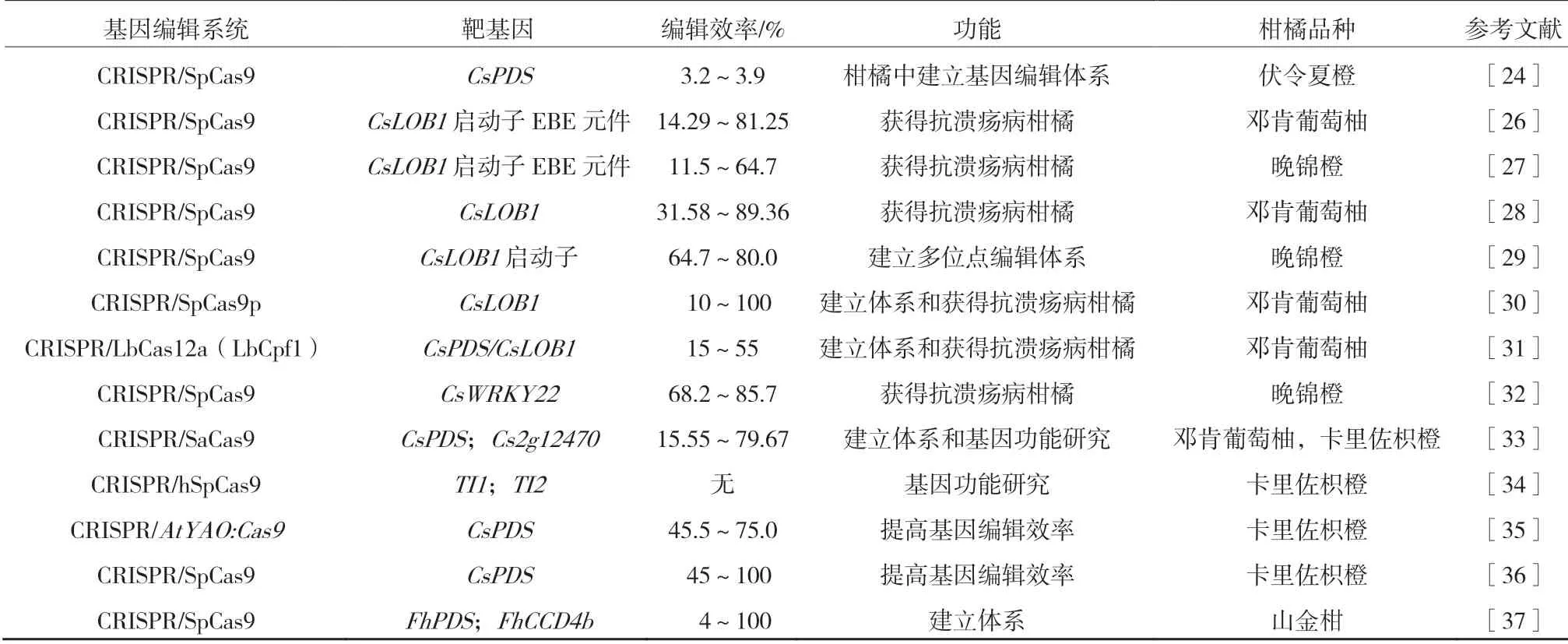
表1 基因编辑系统在柑橘中的应用
柑橘溃疡病由柑橘黄单胞菌亚种引起,是一种非常严重的细菌性病害,广泛分布于全球柑橘产区,严重影响多数柑橘品种及重要的经济品种,如柑橘、柚、甜橙、柠檬和柑橘砧木等[38]。CsLOB1是一个柑橘侧生器官边界基因(citrus lateral organ boundaries 1),为植物LBD(Lateral organ boundaries domain)转录因子家族成员,已经被证明是柑橘溃疡病的关键感病基因[39]。柑橘溃疡病致病菌Xcc 菌株编码转录激活类(Transcription activator-like,TAL)效应子PthA4,该效应子可与CsLOB1 基因启动子中的效应子结合元件(EBE)结合并诱导CsLOB1 基因的表达[39]。因此,研究人员尝试通过利用CRISPR/Cas 系统对CsLOB1 基因进行编辑,来提高柑橘对溃疡病的抗性。最初研究发现,基于CRISPR/SpCas9 对‘邓肯葡萄柚’中Type I CsLOB1基因EBE 元件的修改,只轻微缓解溃疡病症状,并没有获得对溃疡病抗性较强的突变株系,可能由于单个碱基的改变没影响EBE 结合元件的功能造成的,也可能因为杂合葡萄柚中另一个等位基因Type II CsLOB1 中的EBE 元件功能正常引起的感病[26]。因此,为保证对CsLOB1 及等位基因启动子的编辑效率,后续有研究将5 个Cas9/CsLOB1sgRNA 载体同时成功转入‘晚锦橙’(Citrus sinensis Osbeck),并有效地对CsLOB1 及等位基因中EBE 元件编码序列进行编辑(删除或突变),编辑效率为11.5%~64.7%,其中CsLOB1 整个EBEs 编码序列删除的纯合突变株系对溃疡病表现出高度抗性[27]。此外,Jia等还在另一项研究中发现,利用CRISPR/SpCas9 编辑CsLOB1 及等位基因的编码区获得的‘邓肯葡萄柚’株系也增强了对溃疡病的抗性,编辑效率为31.58%~89.36%[28]。国内还有研究利用CRISPR/ Cas9 系统对CsLOB1 启动子进行多位点编辑,并获得了较大DNA 片段删除的突变体,基因编辑效率高达80.0%[29]。在CRISPR/SpCas9 基础上优化和新开发的基因编辑系统在柑橘中也已被成功应用,如Jia 等近期还利用密码子优化的SpCas9(SpCas9p)系统来修饰纯合的柚(Citrus maxima)中LOB1 基因启动子的EBE 区域,并成功在T0代获得等位基因纯合突变的抗溃疡病株系[30],这对缩短柑橘转基因抗病育种的周期具有重要意义。另外,一个新开发的II类CRISPR/Cas系统V型核酸内切酶CRISPR/ LbCas12a(LbCpf1)被成功用于对‘邓肯葡萄柚’基因CsLOB1 及等位基因中EBE 元件编码序列的编辑,并获得了对Xcc 具有抗性的突变植株[31]。除对CsLOB1 基因进行编辑外,近期 Wang 等利用CRISPR/Cas9 系统对‘晚锦橙’中病原触发免疫标记基因CsWRKY22 进行了敲除,获得了68%的突变率,抗性鉴定证实CsWRKY22 基因敲除同样降低了柑橘对溃疡病的易感性[32]。这些研究报道表明,利用CRISPR/Cas 基因编辑系统对柑橘中溃疡病感病基因等进行编辑后,均成功提高了柑橘对溃疡病的抗性。不仅抗病育种,CRISPR/Cas 介导的基因编辑系统在柑橘基因功能研究中也有应用。例如,Jia等利用 CRISPR/SaCas9 系统成功编辑枳橙中的Cs7g03360 基因,该基因为番茄中参与调控叶片发育的SlAgo 基因的同源基因,并获得基因编辑效率为15.55%~79.67%的12 个枳橙突变株系,但可能由于这些突变株系并非纯合体导致均未出现叶片变化的表型[33]。近期,Zhang 等利用CRISPR/AtYAO:hSpCas9 系统对‘卡里佐枳橙’(Citrus sinensis×Poncirus trifoliata)中的THORN IDENTITY 1(TI1)和TI2 基因进行编辑,来研究二者在针刺发育成枝过程中的作用,发现编辑后的枳橙突变体中部分针刺可以发育转变成枝,增加了植株分枝数量[34]。
虽然CRISPR/Cas 介导的基因编辑系统在柑橘中已成功应用,上述这些报道也表明,与其他植物相比,CRISPR/Cas 系统在柑橘中的编辑效率整体较低,且获得突变植株后代的周期较长。因此,有研究人员在提高柑橘中的基因编辑效率和开发模式柑橘等方面也做了一些尝试工作。与CaMV35S 启动子相比,Cas9 在拟南芥YAO 启动子驱动下的表达增加了特定位点的靶向突变数量[40]。鉴于此,有研究构建了拟南芥YAO 启动子驱动的Cas9 载体AtYAO :Cas9,对枳橙中CsPDS 基因进行编辑,研究结果表明该系统稳定高效,编辑效率为45.5%~75.0%[35]。短期热胁迫处理被认为是提高编辑效率的有效方法[36]。在经过37 ℃热激处理后,柑橘植株的突变率和拟南芥一样也明显增加,为45%~100%,这可能是因为随着温度升高导致spCas9 活性升高和gRNA 表达水平增加,并引起编辑效率的提升[36]。另外,上述报道的柑橘中CRISPR/Cas9 介导的靶向突变多以甜橙或柚为材料,但由于这2 个种类多胚和童期长的特性,这些研究发表时均还没有获得T1代的转化材料,这类问题也是柑橘基因工程育种的一个巨大阻碍。近期,国内学者首次报道了一个基于早花‘山金柑’(Fortunella hindsii)建立的实用CRISPR/Cas9 系统,它大约需要15 个月即可产生T1代转化材料,极大地缩短了基因工程育种的周期[37]。不过,与上述一些研究报道相比,‘山金柑’的基因编辑效率相对较低(平均约50%),这可能是由于转化载体差异或金柑本身的自然特性造成的。‘山金柑’的基因组测序也已经完成,单胚和童期短的特性使之可能成为柑橘分子生物学研究的一个“模式柑橘”。编辑效率的提高和“模式柑橘”的开发将进一步扩大CRISPR/Cas 基因编辑系统在柑橘中的应用范围。
2.2 CRISPR/Cas9 系统在柑橘病害传播媒介木虱(ACP)中的应用
柑橘黄龙病(Huanglongbing,HLB)是目前柑橘生产上危害最为严重的病害,影响范围覆盖全球主要柑橘产区,以植物韧皮部汁液为食的半翅目昆虫柑橘木虱(Asian citrus psyllid,ACP)Diaphorina citri 为主要传播媒介[41]。近年来,研究人员发现CRISPR 基因编辑技术在柑橘病毒性细菌病的载体管理方面具有巨大的潜力[42]。有研究报道CRISPR/Cas9 基因编辑技术被用来对柑橘黄龙病传播媒介ACP 中的硫氧还蛋白基因(TRX-2)进行敲除,结果发现TRX-2 基因被编辑突变后导致木虱发育延缓、生命周期缩短,而且繁殖力降低[43-44]。这些研究结果表明,利用CRISPR/Cas 介导的基因编辑技术降低依靠昆虫传播媒介的柑橘病害有潜力成为一种可持续和环境友好的抗病策略。
3 讨论与展望
基因编辑技术已经成为植物品种改良、抗病育种和基因功能等研究的高效工具。与常规转基因技术相比,基因编辑系统有助于在植物基因组中引入稳定的遗传位点修饰,并创造非转基因植物[45-46],避免了转基因育种材料面临的诸多限制。目前,CRISPR/Cas 介导的基因编辑系统已在柑橘、苹果、葡萄、梨、猕猴桃等木本果树中成功应用[22-24]。其中,CRISPR/Cas9 及其变种系统在柑橘的应用主要集中在体系的建立、溃疡病感病基因的编辑和功能基因研究等方面,成功在多个品种中建立稳定、高效的基因编辑体系,并获得一些抗溃疡病的柑橘基因编辑(突变)株系。然而,CRISPR/Cas 系统在柑橘的应用中还面临着一些限制和挑战。例如,除潜在的脱靶效应和非靶向突变[33],柑橘的多倍体和杂合特性对CRISPR/Cas 系统的应用也极为不利。一些研究已经证明,多倍体杂合植株的基因编辑效率通常较低,为达到敲除效果还须同时编辑多个等位基因[29,47],增加了获得纯合突变株系的难度。基因编辑系统在柑橘中应用面临的另一个重要挑战是缺乏适用不同品种的高效转化方法和传递技术。遗传转化方法往往局限于特定的组织和培养类型,并不能应用于所有柑橘品种,不同品种间转化和组织再生效率有很大差异。目前,基因编辑系统的元件主要通过农杆菌介导的传递系统转化导入柑橘外植体的细胞,并通过耗时的组织培养方法获得植株的再生后代。
近年来,随着CRISPR/Cas 基因编辑技术的改进和创新,一些更高效和精准的基因编辑系统不断出现。因此,加速将在CRISPR/Cas9 基础上开发的新的变种系统、碱基编辑和引导编辑等系统在柑橘中的应用进程,以此来解决编辑效率和潜在的脱靶效应等相关问题。而且,从目前研究面临的限制来看,优化现有的遗传转化方法和开发更高效的传递系统是进一步促使CRISPR/Cas 基因编辑技术在柑橘育种中广泛应用亟待解决的问题。除农杆菌介导的转化方法外,Cas9/sgRNA 核糖核蛋白复合物(RNP)可以通过原生质体转化的方式直接导入细胞内,既提高了编辑效率,又可以很好地解决外源DNA 的插入问题,但该技术受原生质体制备、转化和再生体系的限制[48-50]。所以,开发不同柑橘品种的单细胞转化方法和再生体系,将有助于加快基因编辑介导的育种进程。随着技术的发展,新兴的纳米载体逐渐成为CRISPR/Cas 系统元件的潜力递送工具。已经有报道利用纳米材料作为载体,成功将外源DNA 和CRISPR/Cas 元件导入植物花粉或原生质体[51-52],这种传递方式不仅避开了转化和组培过程,还可能解决品种特异性对植株再生的限制。近期还有研究报道了使用RNA 病毒载体表达可移动的sgRNA 和从头诱导分生组织的方法,获得基因编辑植株的后代[53]。纳米材料传递载体和分生组织的诱导编辑等这些不需要组织培养的转化方法,将成为植物基因编辑未来发展的一种趋势,但其是否同样适用于柑橘,也有待研究证实。相信随着柑橘重要性状调控基因和病害相关等基因的挖掘,CRISPR/Cas 基因编辑技术势必将成为柑橘基因工程育种等研究广泛应用的一个重要工具。
