基于“要素拼装”的思维模型建构
——以各类滴定计算为例
2021-06-25广东省佛山市教育局教学研究室528000
广东省佛山市教育局教学研究室(528000) 潘 红
广东省佛山市高明区教师发展中心(528500) 雷范军
滴定法是将一种标准溶液滴加到待测物质溶液中,直到与待测物质按化学计量关系定量反应为止,然后根据标准溶液的浓度和消耗的体积,计算待测物质含量的方法。滴定法作为一种化学分析方法,具有便捷、快速、准确度高等优点,在工业分析和日常生活中有广泛应用,如食醋中乙酸含量的测定、碘量法测水中溶解氧、EDTA法测Mg2+含量等。根据滴定反应原理的不同,可以将滴定法分为四大类型:酸碱中和滴定、氧化还原滴定、沉淀滴定和配位滴定。
本文通过对全国卷高考真题中常见滴定实验考查角度的分析,聚焦各类滴定分析对于计算的考查。以两例氧化还原滴定试题为例,梳理出解答滴定计算的一般思路,建构了基于“要素拼装”的解题思维模型。应用模型对涉及酸碱中和滴定和配位滴定的高考真题进行快速解答,验证了该解题模型的广泛适用性,并反思了建构基于“要素拼装”的解题模型的意义。
1 考题分析
从高考命题来看,氧化还原滴定、沉淀滴定和配位滴定均是建立在酸碱中和滴定原理的基础之上进行考查,试题情境一般是从化工生产或生活中取材,综合考查元素化合物知识、滴定实验基本操作、滴定终点判断以及滴定计算。
其实,各类滴定分析方法在历年高考真题中都有涉及,笔者通过对近4年高考真题中滴定方法的考查进行了统计,发现氧化还原滴定的考查最为常见,仅近三年全国卷中的考查就达6次之多。酸碱中和滴定和沉淀滴定考查较少,在2020年全国II卷27题有涉及。配位滴定由于反应原理和实验药品对于学生有较大陌生度,仅在浙江、江苏卷中曾经出现过。
近三年高考全国卷试题中滴定实验考查内容见表1。从表中不难发现,滴定分析考查角度主要集中在以下三个方面:①滴定终点的现象描述;②定量计算;③滴定误差分析。
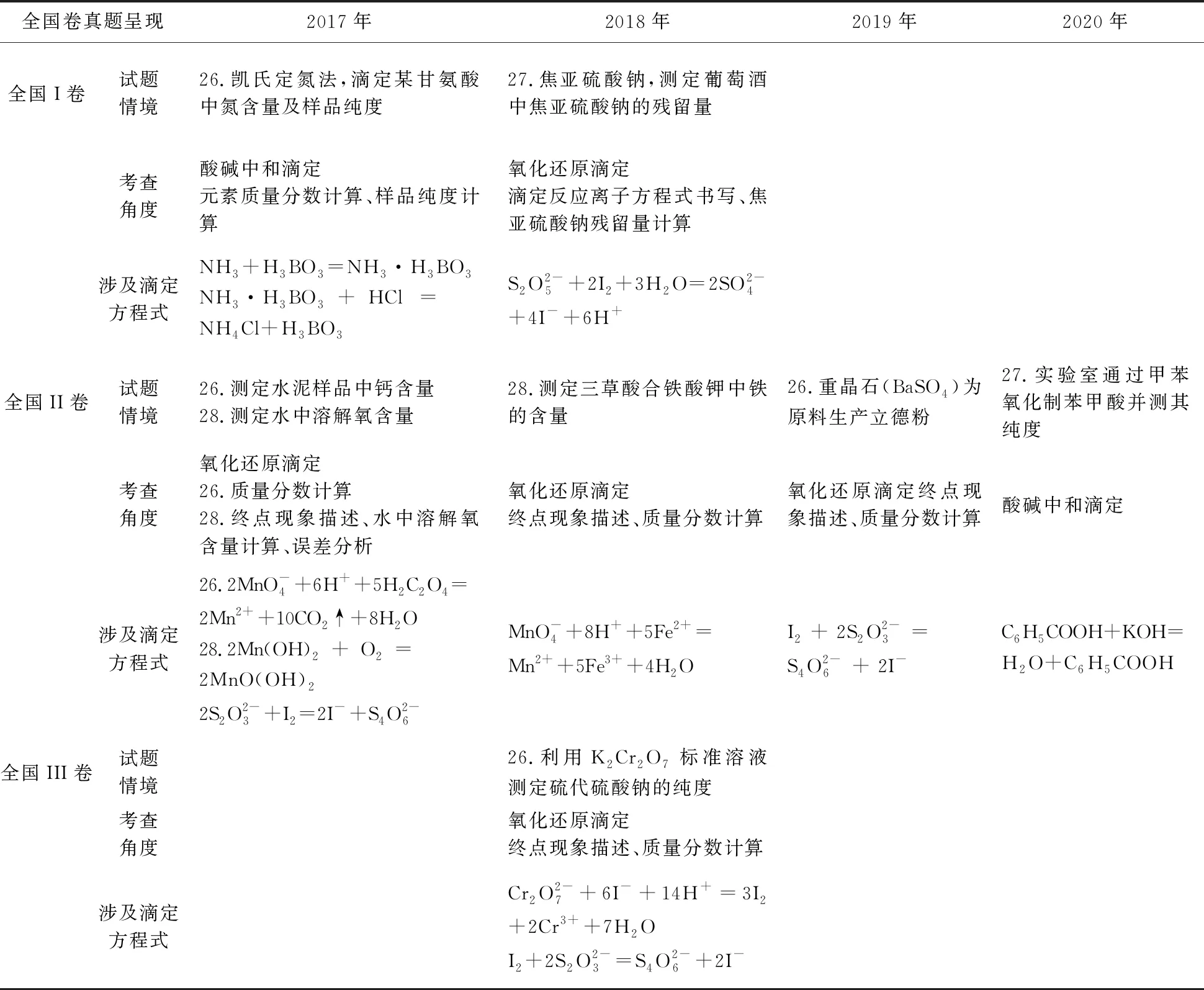
表1 近三年全国卷高考滴定实验考查统计
2 突破滴定计算的一般思路
高考试题中区分度高的题目一般都会涉及相关定量计算,而滴定计算每年都会涉及,是名副其实的高频考点。2017年全国II卷甚至考查了两道滴定计算,但学生解题情况却实在不尽人意,甚至大多数学生在此题留空。快速、准确答对定量计算题目,是学生夺取高分考上名校的现实需要。
课堂教学中,教师如果能帮助学生将复杂的思维过程进行梳理,去伪存真、去粗取精,并从中提取能准确描述该过程的核心元素或核心参数,找出它们之间的正确关系,就可以帮助学生形成思考这一类问题的思维路径或模型。
笔者基于对学生面对化学计算的畏难心理及解题困难点的分析,构建了基于“要素拼装”的解题思维模型,帮助学生有序思维快速破题,以求快速准确地突破各类滴定计算。
例1(2018年全国I卷27题):Na2S2O5可用作食品的抗氧化剂。在测定某葡萄酒中Na2S2O5残留量时,取50.00 mL葡萄酒样品,用0.01 000 mol·L-1的碘标准液滴定至终点,消耗10.00 mL。滴定反应离子方程式为________该样品中Na2S2O5的残留量为________g·L-1(以SO2计)。
解析:
(2)寻找“待测液”与“标准液”反应的定量关系。
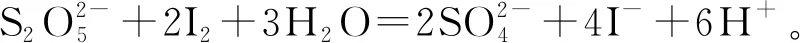
(3)由标准液的定量,结合定量关系换算待测液的定量。
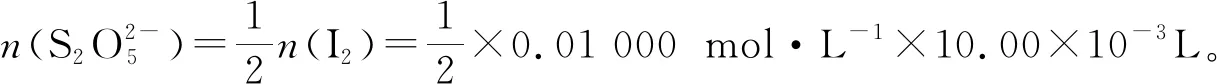
(4)结合题目要求,得出结果。
例2(2019年10月浙江十校联考):保险粉样品中Na2S2O3·5H2O的纯度(质量分数)可通过氧化还原滴定法测定,相关反应方程式为2Na2S2O3+I2=2NaI+Na2S4O6。准确称取W g样品于锥形瓶中,用适量蒸馏水溶解,并滴加淀粉溶液作指示剂,用0.1 000 mol/L碘标准溶液进行滴定。到达终点时测得消耗碘标准溶液体积为18.10 mL,产品的纯度为:____(设Na2S2O3·5H2O相对分子质量为M)。
解析:
(1)明确“待测液”为Na2S2O3,“标准液”为I2。
(2)由反应方程式2Na2S2O3+I2=2NaI+Na2S4O6得到“待测液”与“标准液”反应的定量关系为2Na2S2O3~I2,用数字表示为2。
(3)由标准液的定量,结合定量关系换算待测液的定量。
(4)结合题目要求,得出结果。
保险粉样品中Na2S2O3·5H2O的纯度为:
结合例1和例2的分析,可以总结得出解答滴定计算的一般思路如图1所示。

图1 解答滴定计算的一般思路
3 基于“要素拼装”的解题思维模型的建构
对比观察例1和例2中滴定计算的表达式,就可以发现它们都有5个要素,分别用①②③④⑤表示。
例1:
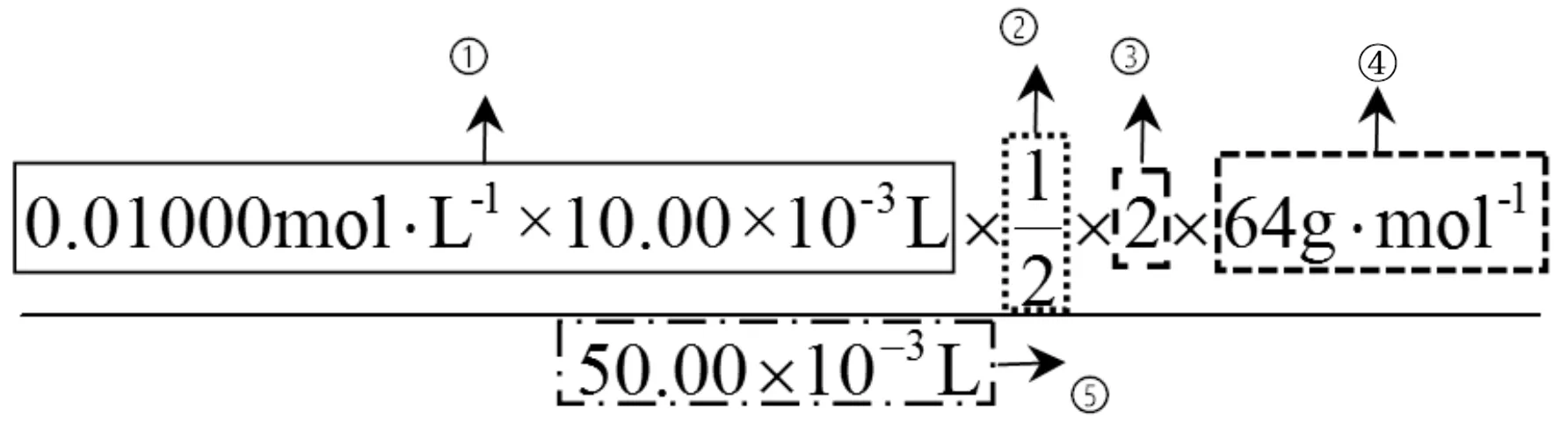
例2:

下面笔者就“5要素”分别作解读:
①中式子由3个数相乘,即c标×V标×10-3,表示标准液的用量n标,单位mol。
②是一个分数或整数,表示“待测液”与“标准液”反应的定量关系。
找准此“定量关系”是整个计算表达式中是核心而关键的一个要素,直接影响到最终计算结果的正确表达。对于氧化还原滴定反应来说,有时候题目未给出具体的滴定反应,那么此时就需按照氧化还原反应的原理从元素价态入手进行分析,找准待测液、标准液与氧化剂、还原剂的对应关系,再分析清楚“氧化剂→还原产物”和“还原剂→氧化产物”的物质变化,最后根据得失电子守恒和原子守恒等原则书写出正确的反应方程式,从而快速准确地突破“待测液”与“标准液”反应的定量关系。对于沉淀滴定、酸碱中和滴定和配位滴定,此“定量关系”一般来说较为简单。
③表示取量关系。如例1中由①×②求得了待测样品中Na2S2O5的物质的量,而题目要求样品中Na2S2O5的残留量以SO2计。由于n(SO2)=2n(Na2S2O5),所以定“取量关系”为2。
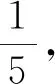
④是待测物的摩尔质量,单位g·mol-1。有些题目会在题干给出(如例2),没有直接给出(如例1)就需要根据试卷中“可能用到的相对原子质量”计算。
⑤表示样品用量,一般是取样的体积或质量。如例1中要求样品中Na2S2O5的残留量单位为g·L-1,所以表达式的分母上就要将葡萄酒样品50.00 mL换算成50.00×10-3L。
至此,可将滴定计算中出现最多的样品纯度计算表达式,基于“要素拼装”,用一个模型表示如下:

从确定各要素的复杂性和重要性角度,用一句口诀可以概括如下:n标表达很简单,定量关系最关键,取量倍数凭口算,摩尔质量看题干,样品用量最简单,直接照搬分母摊。
4 基于“要素拼装”的解题思维模型的应用
有了以上基于“要素拼装”的滴定计算解题模型,就可以迅速地帮助学生快速破解各类滴定计算的奥秘。现再举酸碱中和滴定和配位滴定两类常见的滴定情境,体现此模型的适用性。
例3(2017年全国I卷26题):取某甘氨酸(C2H5NO2)样品m g进行测定,滴定装置中吸收时消耗浓度为c mol·L-1的盐酸V mL,则样品中氮的质量分数为___%,样品的纯度≤___%(已知:NH3+H3BO3=NH3·H3BO3;NH3·H3BO3+HCl=NH4Cl+H3BO3)。
解析:此滴定情境为酸碱中和滴定。由题意知,甘氨酸(C2H5NO2)样品中的N元素在浓硫酸作用下转化为NH3,NH3被H3BO3吸收,反应方程式为NH3+H3BO3=NH3·H3BO3,再用盐酸对NH3·H3BO3进行滴定,滴定反应方程式为NH3·H3BO3+HCl=NH4Cl+H3BO3。
①n标=cV×10-3mol;
②由滴定反应方程式可以看出待测液与标准液的“定量关系”为1;
③样品“全量”进行反应,所以“取量关系”为1;
④氮的摩尔质量为14 g·mol-1;样品的摩尔质量为75 g·mol-1;
⑤“样品用量”为m g。
例4(2012年天津卷):探究小组用滴定法测定CuSO4·5H2O(Mr=250)含量。取a g试样配成100 mL溶液,每次取20.00 mL,消除干扰离子后,用c mol·L-1EDTA(H2Y2-)标准溶液滴定至终点,平均消耗EDTA溶液b mL。滴定反应如下:Cu2++H2Y2-= CuY2-+ 2H+,写出计算CuSO4·5H2O质量分数的表达式ω=________。
解析:此滴定情境为配位(络合)滴定。
①n标=cb×10-3mol;
②由滴定反应方程式可以看出待测液与标准液的“定量关系”为1;
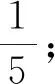
④摩尔质量为250 g·mol-1;
⑤“样品用量”为a g。
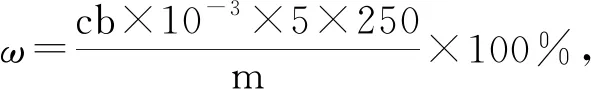
5 建构解题思维模型的意义
“模型认知”是高中学生在系统学习了化学、数学、物理等科学课程后所应具备的核心素养。课堂教学应促进学生通过分析、推理等方法认识研究对象的本质特征、构成要素及其相互关系,建立认知模型,并能运用模型解释化学现象,揭示现象的本质和规律。思维建模是将学习者内在的思维过程显现化、模式化,这一过程就是,经过筛选理清主线,并简化为具有广泛意义的思维模型。
在二轮复习备考过程中,教师针对高考高频考点的稳定题型进行解题思维模型建构,可以帮助学生精准筛选有用信息,快速排除干扰因素,迅速准确地入题、破题、解题,也利于培养学生学习化学的“模型认知”意识和素养,提高筛选整合信息的能力、分析和解决化学问题的能力。
理科综合考试题量大、思维跳跃性强,学生大多感觉时间不够用,遇到计算相关题目更是或“望而却步”,或“望风而逃”或“望洋兴叹”,考场之上必须果断入题、快速破题。教师如能帮助学生解构计算过程,进行要素分析,再反向将要素拼装,建立解题模型,这样就能消除学生对于化学计算的畏惧心理,增强夺分意识,在高考选拔性上占据主动。
