生脉注射液体外对CYP450酶与转运体抑制作用的研究
2021-06-24强婷婷李益萍王肖龙
强婷婷,李益萍,王肖龙*
1.上海中医药大学附属曙光医院 国家中医心血管病临床医学研究中心分中心,上海 201203
2.上海中医药大学附属曙光医院 心血管病研究所,上海 201203
随着中药应用日益广泛,由中药-西药联合使用产生的代谢性药物相互作用和不良反应事件也随之增加,因此,中药与西药联合应用的安全性和合理性受到广泛关注。肝脏是药物代谢的主要场所,主要包括I 阶段细胞色素P450(cytochrome P450,CYP450)酶系参与的氧化、还原、水解反应[1]。CYP450 酶系是由许多同工酶组成的超基因大家族,其在肝脏含量最高,对大量结构各异的药物的生物转化起着决定性作用[2]。药物在体内的吸收、分布、代谢、排泄过程非常复杂,除了肝脏的代谢转化外,膜转运体可以主动转运药物进出细胞,平衡细胞内的药物浓度,膜转运体在改变药物代谢方面显示出巨大的潜力[3]。目前国内外越来越多的学者通过预测中药对CYP450 酶及转运体活性影响,进而评估药物联用时发生药物相互作用的风险[4-6],研究发现,麝香保心丸在体外对人源CYP2B6、CYP2C9 以及有机阴离子 1B1(organic anion transporting polypeptide 1B1,OATP1B1)具有抑制作用,可能导致与其他药物联用时发生药物相互作用[7]。
生脉注射液源于古方生脉散,由红参、麦冬、五味子组成,具有益气固脱、养阴生津的功效,用于治疗气阴两亏、脉虚欲脱的心悸、气短、四肢厥冷、汗出、脉欲绝及心肌梗死、心源性休克等症状。生脉注射液具有抗缺血缺氧及再灌注损伤、抑制心肌细胞凋亡及心肌纤维化等作用[8-9]。生脉注射液与常规西药联合使用时,不仅可以改善心力衰竭和冠心病心绞痛患者的临床疗效[10-12],并且可以降低急性心肌梗死患者的死亡率[13]。但是,生脉注射液与心血管疾病常用药物如CYP2C9 底物华法林、CYP2D6 底物美托洛尔、CYP3A 底物辛伐他汀、多药耐药蛋白1(multidrug resistance proteins 1,MDR1)底物地高辛、乳腺癌耐药蛋白(breast cancer resistance protein,BCRP)与OATP1B1 底物瑞舒伐他汀、OATP1B1 底物替米沙坦等的代谢性相互作用的研究较少,存在用药安全隐患。
美国食品和药品管理局(FDA)发布的《药物相互作用研究指导原则(2017)》[14]以及我国颁布的《药物相互作用研究技术指导原则(试行)》[15]中,主要包括7 种酶以及9 种转运体的抑制作用的研究,与心血管药物代谢相关的转运体主要有MDR1、BCRP 与OATP1B1。因此,根据国内外的指导原则,在有无生脉注射液的人肝微粒体、MDR1以及BCRP 囊泡和人胚胎肾细胞HEK293 中,培养CYP450 酶与转运体的探针底物,采用液相色谱-串联质谱联用(LC-MS/MS)及酶标仪检测探针底物代谢产物的生成量或探针底物量,并计算半数抑制浓度(50% concentration of inhibition,IC50)值,从而进一步评估生脉注射液对CYP450 酶主要亚型以及转运体MDR1、BCRP 与OATP1B1 的抑制作用,以期为生脉注射液与其他药物临床上安全、有效的联用提供依据。
1 材料
1.1 人肝微粒体、囊泡和细胞
人肝微粒体(批号IHG,质量浓度为20 mg/mL)购自美国体外技术公司;人源MDR1 囊泡(批号KKA4G23,质量浓度为5 mg/mL)、BCRP 囊泡(批号QSHTG03,质量浓度为5 mg/mL)、稳定表达人源 OATP1B1 转运体的 HEK293 细胞系HEK293-OATP1B1、转染空白质粒的转基因HEK293 细胞系 HEK293-MOCK 均购自日本GenoMembrane 公司。
1.2 药品与试剂
生脉注射液(批号2018120503)购自上海和黄药业;对照品非那西汀(质量分数≥98%,批号77440)、阿莫地喹(质量分数≥100%,批号A2799)、双氯芬酸钠(质量分数≥98%,批号D6899)、α-萘磺酮(质量分数≥98%,批号N5757)、槲皮素(质量分数≥98%,批号Q4951)、噻氯匹定(质量分数≥99%,批号T6654)、4-羟基双氯芬酸(质量分数≥98%,批号H-3661)、N-去乙基阿莫地喹(纯质量分数≥98%,批号705349)、右啡烷(质量分数≥98%,批号 UC205)、荧光黄(质量分数≥100%,批号L0259)、N-甲基奎尼丁(质量分数≥100%,批号SBNMQ)、新生霉素(质量分数≥93%,批号74675)、17β-葡萄糖苷-雌二醇(质量分数≥98%,批号E1127)、利福平(质量分数≥97%,批号R3501)、G418 盐酸盐(批号A1720)、丁螺环酮(质量分数≥100%,批号B7148)、甲苯磺丁脲(质量分数≥97%,批号T0891)购自美国Sigma 公司;对照品安非他酮(质量分数≥98%,批号B3649)、酮康唑(质量分数≥98%,批号K0045)、对乙酰氨基酚(质量分数≥98%,批号H0190)购自日本东京化学工业株式会社;对照品塞替派(质量分数≥100%,批号20101110)、4-羟基美芬妥英(质量分数≥100%,批号H-3661)购自常州化工科技有限公司;羟基安非他酮对照品(质量分数≥99.6%,批号BUP-16-007)购自加拿大Acanthus 公司;6β-羟基睾酮对照品(质量分数≥100%,批号ZC-24060)购自上海甄准生物科技有限公司;甲醇购自美国Merck 公司;β-还原型烟酰胺腺嘌呤二核苷酸磷酸(β-nicotinamide adenine dinucleotide phosphate,β-NADPH,质量分数≥100%,批号10041939)购自瑞士Roche 公司;S-美芬妥英对照品(质量分数≥98%,批号7098-4-7)购自上海相辉医药科技公司;睾酮对照品(质量分数≥99.28%,批号DRE-C17322500)购自德国Dr.Ehrenstorfer 公司;右美沙芬对照品(质量分数≥100%,批号75469A)购自上海Damas-beta 公司;磺胺苯吡唑对照品(质量分数≥99%,批号178125)购自百灵威科技有限公司;奎尼丁对照品(质量分数≥100%,批号Q685000)购自加拿大TRC 公司;转运体囊泡试剂盒(批号GM3010)购自日本GenoMembrane公司;DMEM 培养基(批号11885-084)、胰酶(批号25300-062)、青霉素链霉素混合液溶液(批号15140-122)、胎牛血清(批号10099-141)购自美国Gibco 公司;BCA 蛋白定量试剂盒(批号23227)购自美国Thermo Fisher Scientific 公司;24 孔赖氨酸包被培养板(批号354414)购自美国Corning 公司。
1.3 仪器
XW-80A 型漩涡仪(其林贝尔实验室仪器有限公司);DK-S24 型电热恒温水浴锅(上海精宏实验设备有限公司);AL204 型天平(德国梅特勒-托利多仪器(上海)有限公司);VELOCITY18R 离心机(美国Thermo Fisher Scientific 公司);HTS PAL 自动进样系统(瑞士思特斯分析仪器股份公司);LC20液相色谱仪(日本岛津公司);API4000 质谱仪(美国应用生物系统有限公司)。
2 方法
2.1 生脉注射液的剂量设定依据
根据药品说明书,生脉注射液静脉滴注,20~60 mL/次;以标准成人65 kg 体质量计算,循环血液总量约为5 L,故使用临床常用剂量时的理论最大血药浓度为1.2%(体积分数),考虑到肝脏内浓度可能会高于血药浓度,因此提高体外实验的浓度上限至30.0%(体积分数)。在确定最高浓度后,设计的浓度范围尽量包括临床血药浓度,但要满足在1 个lg 内需要有1 个浓度,否则在出现抑制作用时,无法准确拟合IC50,因此在设置梯度浓度时可以2~5 倍交叉梯度稀释。
2.2 生脉注射液对CYP1A2、CYP2B6、CYP2C8、CYP2C9、CYP2C19、CYP2D6 和CYP3A4 的体外抑制作用
阴性对照组:人肝微粒体(终质量浓度为0.5 mg/mL)与空白缓冲液预孵育15 min 后,加入相应的探针底物溶液:非那西汀(30 μmol/L,CYP1A2)、安非他酮(100 μmol/L,CYP2B6)、阿莫地喹(1.5 μmol/L,CYP2C8)、双氯芬酸(25 μmol/L,CYP2C9)、S-美芬妥英(50 μmol/L,CYP2C19)、右美沙芬(8 μmol/L,CYP2D6)和睾酮(100 μmol/L,CYP3A4),再加入β-NADPH,37 ℃孵育30 min。
阳性对照组:人肝微粒体(终质量浓度为0.5 mg/mL)分别与各亚酶的选择性抑制剂:α-萘磺酮(30 μmol/L,CYP1A2)、塞替派(200 μmol/L,CYP2B6)、槲皮素(100 μmol/L,CYP2C8)、磺胺苯吡唑(10 μmol/L,CYP2C9)、噻氯匹定(5 μmol/L,CYP2C19)、奎尼丁(10 μmol/L,CYP2D6)和酮康唑(5 μmol/L,CYP3A4)于37 ℃预孵育15 min后,加入各亚酶的探针底物和β-NADPH,于37 ℃孵育30 min。
生脉注射液组:人肝微粒体(终质量浓度为0.5 mg/mL)分别与不同体积分数(0.1%、0.5%、3.0%、10.0%、30.0%)生脉注射液预孵育15 min后,加入各亚酶的探针底物和β-NADPH,于37 ℃孵育30 min。
各组加入预冷的甲醇终止反应,4000 r/min 离心5 min,取上清液,采用LC-MS/MS 方法测定各探针底物的代谢产物生成量,并计算CYP450 亚酶的相对活性。
CYP450 亚酶的相对活性=给药组或阳性对照组代谢产物生成量/阴性对照组代谢产物生成量
2.3 生脉注射液对MDR1与BCRP的体外抑制作用
阴性对照组:Buffer A2 与人源 MDR1(5 mg/mL)和BCRP 囊泡(5 mg/mL)于37 ℃预孵育5 min,分别加入Reagent C2 和探针底物:N-甲基奎尼丁(5 μmol/L,MDR1)或荧光黄(10 μmol/L,BCRP),在有ATP 或AMP 的条件下,于37 ℃孵育5 min。
阳性对照组:酮康唑、新生霉素作为MDR1 与BCRP 的选择性抑制剂,与人源性MDR1 及BCRP囊泡于37 ℃预孵育5 min,加入Reagent C2、荧光黄或N-甲基奎尼丁,在有ATP 或AMP 的条件下,于37 ℃孵育5 min。
生脉注射液组:不同体积分数(0.1%、0.5%、2%、5%、20%)生脉注射液与人源MDR1 和BCRP囊泡于37 ℃预孵育5 min,分别加入Reagent C2、N-甲基奎尼丁或荧光黄,在有ATP 或AMP 的条件下,于37 ℃孵育5 min。
各组加入预冷的Buffer B2 终止孵育,转移至96 孔滤板,用真空泵抽滤,弃去滤液;加入0.2 mL预冷的Buffer B2 反复洗涤5 次;加入50 μL 80%甲醇溶解滤板上的囊泡,2000 r/min 离心2 min,离心2 次,收集滤液;合并2 次滤液,混匀,加入等体积0.05 mol/L H2SO4(N-甲基奎尼丁)或等体积DMSO(荧光黄),配制N-甲基奎尼丁或荧光黄标准曲线,采用酶标仪检测样本中N-甲基奎尼丁或荧光黄含量。N-甲基奎尼丁的激发光为355 nm,发射光为460 nm;荧光黄的激发光为428 nm,发射光为536 nm,其荧光强度与N-甲基奎尼丁或荧光黄水平成正比。计算底物被转运到囊泡内的转运速率、相对活性和摄取率。
转运速率=(底物在ATP 驱动下的转运量-底物在AMP驱动下的转运量)/孵育时间×囊泡蛋白质量
相对活性=给药组或阳性对照组代谢产物生成量/阴性对照组代谢产物生成量
摄取率=阴性对照组或ATP 组探针底物转运量/AMP 组探针底物转运量
2.4 生脉注射液对OATP1B1 的体外抑制作用
2.4.1 HEK293 细胞培养 将人源HEK293-MOCK细胞作为HEK293-OATP1B1 细胞的阴性对照。细胞用含10%胎牛血清、青霉素(100 U/mL)、链霉素(0.1 mg/mL)和遗传霉素(0.5 mg/mL)的DMEM培养基,于37 ℃、5% CO2的培养箱中培养。取处于对数生长期的细胞以4×105/孔接种于24孔板中,当细胞融合度达到80%~90%时进行转运实验。
2.4.2 转运实验 弃去培养基,用预温的转移缓冲液(pH 7.4)清洗2 次,将第2 次缓冲液留置在板孔内,于37 ℃静置5 min,弃去缓冲液。设置阴性对照组、阳性对照组和生脉注射液(0.1%、0.5%、2%、5%、20%)组,阴性对照组加入预温的含17β-葡萄糖苷-雌二醇(20 μmol/L)的空白缓冲液,阳性对照组加入预温的含17β-葡萄糖苷-雌二醇(20 μmol/L)的利福平(100 μmol/L)溶液,生脉注射液组加入预温的含 17β-葡萄糖苷-雌二醇(20 μmol/L)的生脉注射液,孵育10 min。弃去培养基,用4 ℃预冷的缓冲液洗涤3 次,弃去板内残余溶液;加入0.3 mL 蒸馏水,用液氮反复冻融3 次,使细胞完全裂解;取100 μL 细胞裂解液与含内标甲醇按1∶4 沉淀,4 ℃、12 000 r/min 离心5 min,取上清,采用LC-MS/MS 方法检测上清中的探针底物水平。取25 μL 细胞裂解液,用BCA 蛋白定量试剂盒检测蛋白质量浓度。计算底物摄取速率、底物净摄取速率、相对转运活性和摄取率。
底物摄取速率=细胞裂解液中被转运的底物量/细胞蛋白质量×孵育时间
底物净摄取速率=底物摄取速率-阴性对照组底物摄取速率
相对转运活性=给药组或阳性对照组净摄取速率/阴性对照组净摄取速率
摄取率=阴性对照组转运体细胞的底物摄取速率/阴性对照组底物摄取速率
2.5 LC-MS/MS 测定 CYP450 酶以及转运体OATP1B1 活力
2.5.1 色谱条件 DikmaInspire C18色谱柱(50 mm×2.1 mm,5 μm)、Phenomenex SynergiTMHydro-RP 80 A 色谱柱(30 mm×2 mm,4 μm),流动相为0.1%甲酸水溶液(A)-0.1%甲酸乙腈溶液(B),梯度洗脱:0~0.70 min,90%~30% A;0.70~0.71 min,30%~5% A;0.71~1.20 min,5% A;1.20~1.21 min,5%~90% A;1.21~1.50 min,90% A;1.50~1.70 min,90%~30% A;1.70~2.01 min,30% A;2.01~2.30 min,30%~80% A。柱温为45 ℃;进样量为5 μL;体积流量为0.45 mL/min。
2.5.2 质谱条件 电喷雾电离源(ESI),多反应监测模式。ESI+模式下,碰撞气压力为41.37 kPa,气帘气压力为137.90 kPa,雾化气压力为344.75 kPa,辅助气压力为344.75 kPa,离子电压为5000 V,离子喷射温度为500 ℃。ESI-模式下,碰撞气压力为55.16 kPa,气帘气压力为137.90 kPa,雾化气压力为344.75 kPa;辅助气压力为344.75 kPa,离子电压为-4500 V,离子喷射温度为500 ℃。目标代谢产物质谱条件及其离子见表1。
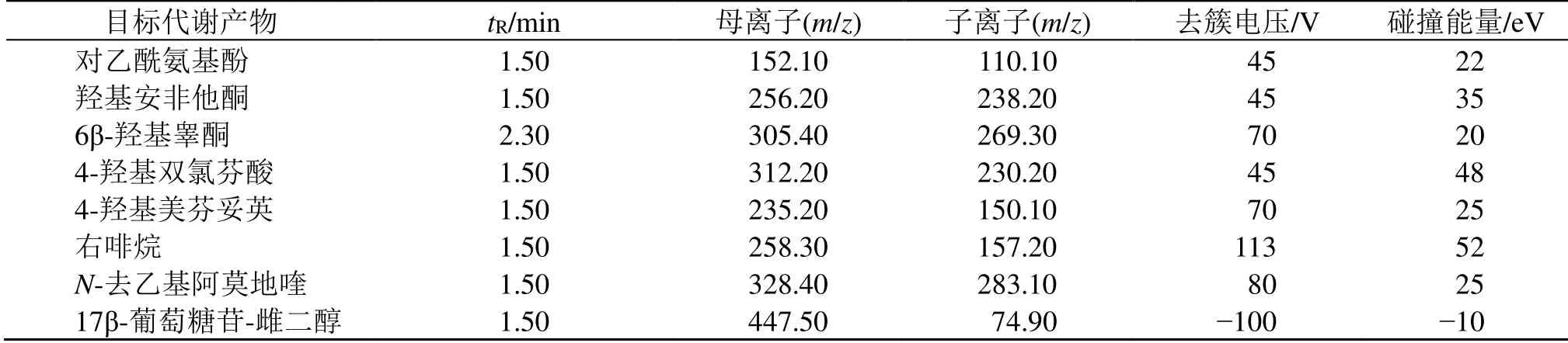
表1 目标代谢产物质谱条件及其离子Table 1 Mass spectrometric parameters for target metabolites and their ions
2.5.3 对照品溶液的配制 取对乙酰氨基酚、羟基安非他酮、6β-羟基睾酮、4-羟基双氯芬酸、4-羟基美芬妥英、右啡烷、N-去乙基阿莫地喹和17-β-葡萄糖苷-雌二醇对照品适量,溶于甲醇溶液,分别配制成10 mmol/L 的对乙酰氨基酚、羟基安非他酮、6β-羟基睾酮、4-羟基双氯芬酸、4-羟基美芬妥英、右啡烷的对照品储备液,以及1 mg/mL 的N-去乙基阿莫地喹、17-β-葡萄糖苷-雌二醇的对照品储备液。取丁螺环酮、维拉帕米、甲苯磺丁脲、特非那定对照品适量,溶于甲醇溶液,分别配制成10 mmol/L的丁螺环酮、甲苯磺丁脲、特非那定内标储备液,以及1 mg/mL 的维拉帕米内标储备液。
2.5.4 样品处理 对标准曲线样品、质控样品和测试样品加入样品50 µL,对空白样品和空白质控样品加入空白基质50 µL,对定量上限样品加入不含内标的样品50 µL。标准曲线样品、质控样品,空白质控样品和测试样品中加入200 µL 内标工作溶液(丁螺环酮10.0 nmol/L、维拉帕米0.400 ng/mL、甲苯磺丁脲20.0 nmol/L、特非那定10.0 nmol/L),向空白样品和定量上限样品加入200 µL 甲醇,室温涡旋混匀10 min,4 ℃、4000 r/min 离心10 min,吸取200 µL 上清液至96 孔聚丙烯板中,进样测定。
2.5.5 方法学考察
(1)检出限、定量限、线性范围和基质效应 在选择的样品处理、色谱与质谱条件下,8 种目标代谢物在低、中、高3 个浓度水平上的绝对基质效应;分别以10 倍信噪比计算目标代谢物的定量限和检出限。以各代谢产物浓度为横坐标(X),各代谢产物与内标的峰面积比值为纵坐标(Y),建立线性回归方程。如表2所示,8 种目标代谢物的线性相关系数(R2)均大于0.994,定量限为10 mmol/L,检出限为10 mmol/L。
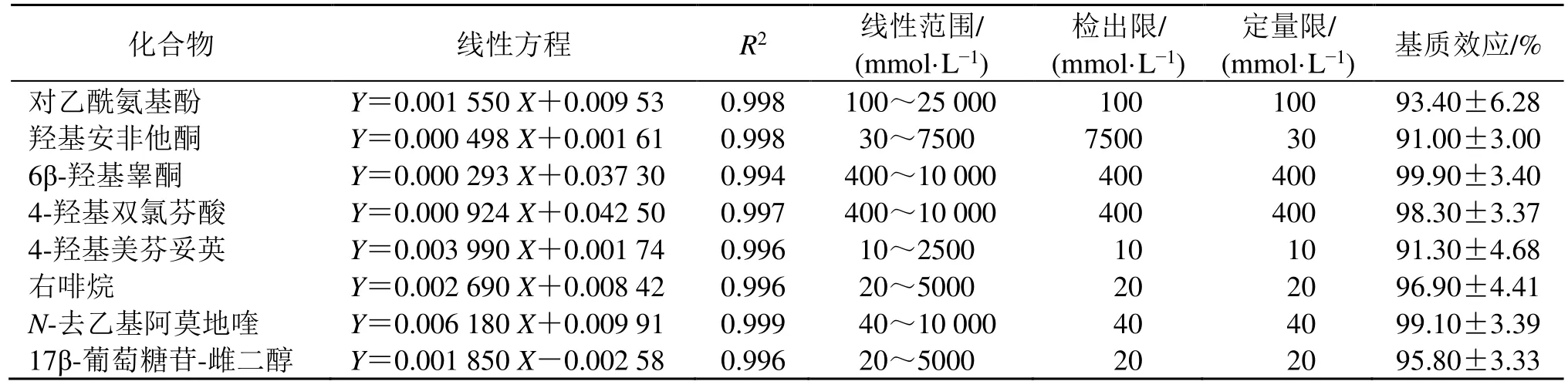
表2 8 种目标代谢产物的线性方程、相关系数、检出限、定量限和基质效应Table 2 Linear equations,correlation coefficients,limits of detection,limits of quantitation and matrix effects of eight target metabolites
(2)精密度 通过计算低、中、高浓度(1.2、40、80 mmol/L)质控样品间的RSD 变化来考察精密度,最低浓度质控样品的RSD 在20%以内,低、中、高浓度质控样品RSD 在15%以内,可以认为精密度良好。结果见表3。
(3)提取回收率 通过比较样品经过提取后的色谱峰面积与未经提取的色谱峰面积之间的比值来考察样品前处理过程中的提取回收率。低、中、高浓度(1.2、40、80 mmol/L)质控样品提取回收率的RSD 在15%以内,可以认为不同浓度下,样品前处理过程中的提取回收率是一致的。结果见表3。

表3 8 种目标代谢产物的提取回收率和精密度(n=6)Table 3 Spiked recoveries and precisions of eight target metabolites(n=6)
2.6 统计分析
3 结果
3.1 生脉注射液对CYP450 酶的抑制作用
如表4所示,生脉注射液(0.1%、0.5%、3.0%、10.0%、30.0%)对人肝微粒体中CYP1A2、CYP2B6、CYP2C9、CYP2C19、CYP2D6 和CYP3A4 酶活性均存在剂量相关性的抑制作用,IC50值分别为6.12%、2.72%、14.31%、12.96%、12.26%、3.72%;对人肝微粒体中CYP2C8 酶活性也存在抑制作用,其IC50值为10.00%~30.00%。
表4 生脉注射液对CYP450 酶相对活性的影响Table 4 Effect of Shengmai Injection on relative activity of CYP450
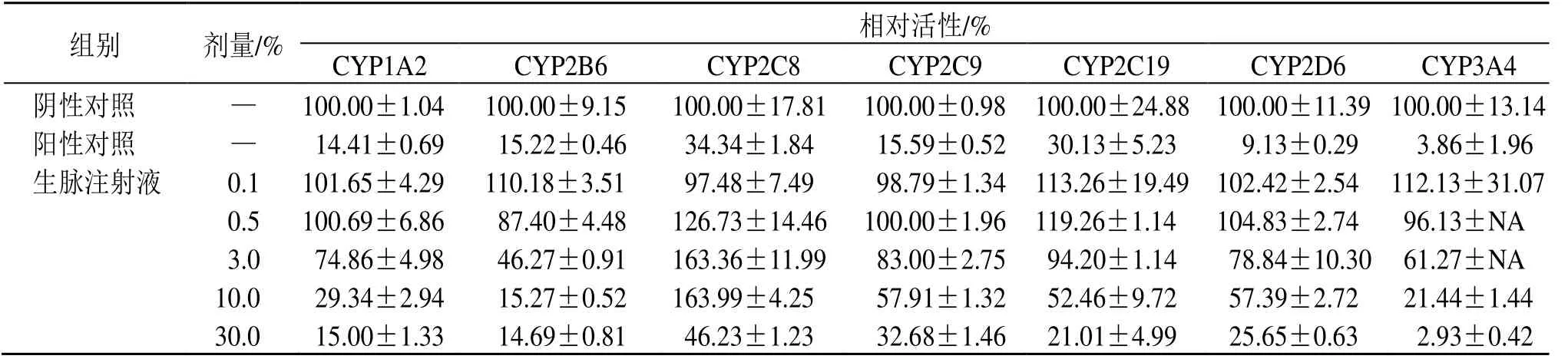
表4 生脉注射液对CYP450 酶相对活性的影响Table 4 Effect of Shengmai Injection on relative activity of CYP450
NA 表示未获得NA means it has not obtained
组别 剂量/% 相对活性/%CYP1A2 CYP2B6 CYP2C8 CYP2C9 CYP2C19 CYP2D6 CYP3A4阴性对照 — 100.00±1.04 100.00±9.15 100.00±17.81 100.00±0.98 100.00±24.88 100.00±11.39 100.00±13.14阳性对照 — 14.41±0.69 15.22±0.46 34.34±1.84 15.59±0.52 30.13±5.23 9.13±0.29 3.86±1.96生脉注射液 0.1 101.65±4.29 110.18±3.51 97.48±7.49 98.79±1.34 113.26±19.49 102.42±2.54 112.13±31.07 0.5 100.69±6.86 87.40±4.48 126.73±14.46 100.00±1.96 119.26±1.14 104.83±2.74 96.13±NA 3.0 74.86±4.98 46.27±0.91 163.36±11.99 83.00±2.75 94.20±1.14 78.84±10.30 61.27±NA 10.0 29.34±2.94 15.27±0.52 163.99±4.25 57.91±1.32 52.46±9.72 57.39±2.72 21.44±1.44 30.0 15.00±1.33 14.69±0.81 46.23±1.23 32.68±1.46 21.01±4.99 25.65±0.63 2.93±0.42
3.2 生脉注射液对MDR1 与BCRP 的抑制作用
阴性对照组探针底物N-甲基奎尼丁和荧光黄的摄取率分别为14.2 和20.4,选择性抑制剂分别抑制了MDR1 和BCRP 98.5%、97.1%的转运活性,表明测试系统适合于本实验。如表5所示,生脉注射射液(0.1%、0.5%、2.0%、5.0%、20.0%)抑制BCRP转运荧光黄和MDR1 转运N-甲基奎尼丁,呈剂量相关性,其IC50值分别为0.75%、0.15%。
表5 生脉注射液对MDR1 与BCRP 相对活性的影响Table 5 Effect of Shengmai Injection on relative activity of MDR1 and BCRP
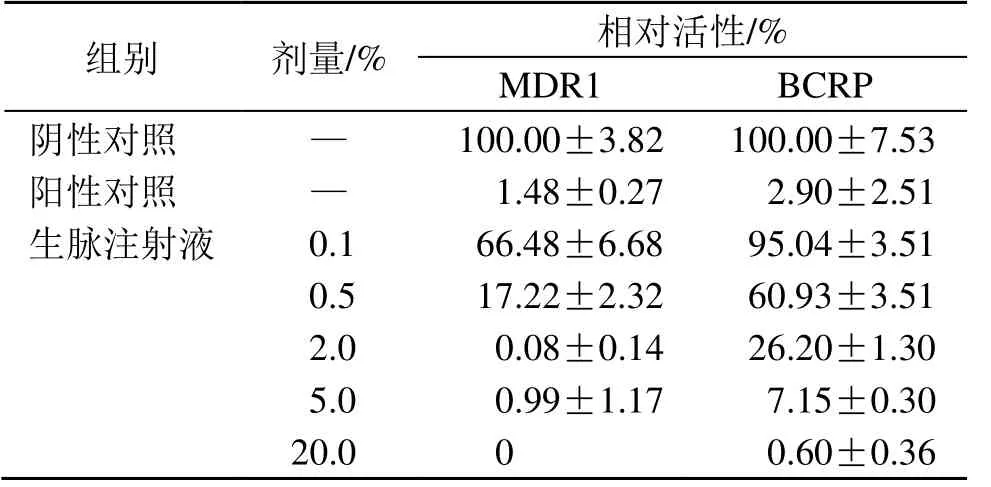
表5 生脉注射液对MDR1 与BCRP 相对活性的影响Table 5 Effect of Shengmai Injection on relative activity of MDR1 and BCRP
组别 剂量/% 相对活性/%MDR1 BCRP阴性对照 — 100.00±3.82 100.00±7.53阳性对照 — 1.48±0.27 2.90±2.51生脉注射液 0.1 66.48±6.68 95.04±3.51 0.5 17.22±2.32 60.93±3.51 2.0 0.08±0.14 26.20±1.30 5.0 0.99±1.17 7.15±0.30 20.0 0 0.60±0.36
3.3 生脉注射液对转运体OATP1B1 的抑制作用
阴性对照组转运体OATP1B1 介导的探针底物的摄取率为23.9,阳性对照组加入选择性抑制剂后,底物的转运活性降低至阴性对照组的0.889%,表明转运体的测试系统适合于本实验。如表6所示,生脉注射液(0.1%、0.5%、2.0%、5.0%、20.0%)抑制OATP1B1 转运活性,呈剂量相关性,其IC50值为2.03%。
表6 生脉注射液对 OATP1B1 相对活性的影响Table 6 Effect of Shengmai Injection on relative activity of OATP1B1
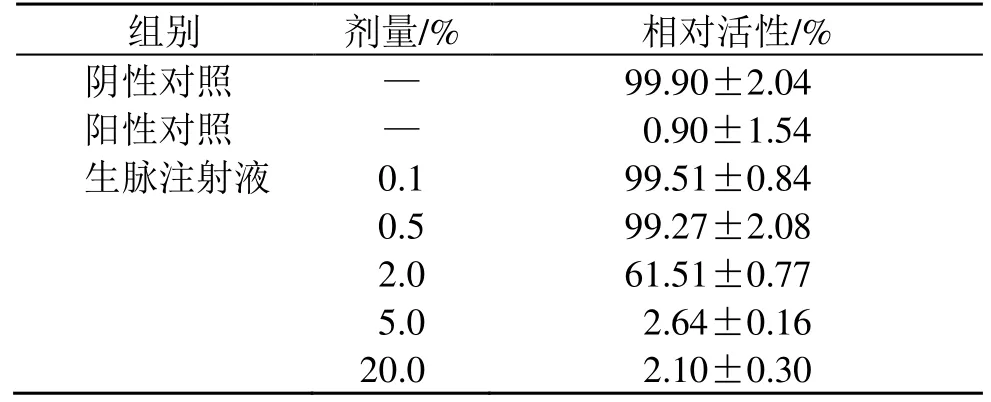
表6 生脉注射液对 OATP1B1 相对活性的影响Table 6 Effect of Shengmai Injection on relative activity of OATP1B1
组别剂量/% 相对活性/%阴性对照 — 99.90±2.04阳性对照 — 0.90±1.54生脉注射液 0.1 99.51±0.84 0.5 99.27±2.08 2.0 61.51±0.77 5.0 2.64±0.16 20.0 2.10±0.30
4 讨论
随着临床药物联用的日益普遍,药物相互作用已成为现今临床医疗中不可回避的实际问题。目前临床上药物相互作用问题主要表现在代谢性药物相互作用方面。据统计,临床90%以上的代谢性药物相互作用均由CYP450 酶活性的改变引起。1980—1998年,由于严重不良反应的陆续发生,FDA 先后将其批准问世的13 种新药从市场上撤出,其中有5 种药物与CYP450 介导的代谢性药物相互作用相关[16-18]。CYP3A4 的抑制剂酮康唑与特非那定联合使用时,酮康唑抑制了特非那定的代谢,使特非那定积累到高水平,导致RR 间期和QT 间期显著延长,最终可能造成尖端扭转型室性心动过速[19]。因此,当联用药物共同为CYP450 酶系的底物、抑制剂或激动剂时,容易出现药物相互作用的可能,导致活性代谢产物或毒性代谢产物生成增多,从而减少药效或增加不良反应,影响药物联用的安全性或有效性[20-21]。在临床诊治过程中,为了使患者获得更好的疗效,中药与西药一般结合使用[22-24],但大部分中药无论以何种形式使用,在体内均以化合物形式发挥其药理作用,在代谢过程中,均可能与西药发生作用,从而改变药物的药理学特性,产生代谢性药物相互作用[25]。生脉注射液的应用极为广泛,不仅可以用于心力衰竭、冠心病心绞痛与心肌梗死等疾病的治疗,而且还具有抗休克、辅助治疗肿瘤等作用。Meta 分析显示,较单纯使用常规西药相比,生脉注射液与常规西药联合使用时,不仅提高了心衰患者的临床疗效,而且对左室射血分数(left ventricular ejection fraction,LVEF)和心功能分级(New York heart association classification,NYHA)心功能也有明显改善[26]。但是,基于CYP450 酶与转运体的代谢性药物相互作用的相关研究几乎空白,因此,无法评估生脉注射液与其他西药联用时的有效性和安全性。
本研究考察了生脉注射液对CYP450 酶系的影响,发现较对照组相比,生脉注射液在30%(v/v)浓度范围内可以抑制CYP450 酶底物非那西汀、安非他酮、阿莫地喹、双氯芬酸钠、S-美芬妥因、右美沙芬与睾酮分别向对乙酰氨基酚、羟基安非他酮、N-去乙基阿莫地喹、4-羟基双氯酚酸、4-羟基美芬妥因、右啡烷、6β-羟基睾酮的生物转化,表明生脉注射液对CYP1A2、CYP2B6、CYP2C8、CYP2C9、CYP2C19、CYP2D6 与CYP3A4 的活性具有抑制作用,其IC50值分别为6.12%、2.72%、10.00%~30.00%、14.31%、12.96%、12.26%、3.72%,其中对CYP2B6 的抑制作用最显著。上述IC50值均显著超过生脉注射液在人体内的最大血药浓度1.20%,表明生脉注射液在临床常用剂量范围内,与上述酶底物联用时发生药物相互作用的可能性较小。
维拉帕米是经FDA 批准的药物相互作用临床研究的MDR1 的抑制剂,与MDR1 底物地高辛联合使用时,使地高辛的清除减少,导致地高辛血药浓度升高40%~80%,容易造成地高辛中毒反应[27]。替米沙坦通常用于高血压的治疗,研究表明替米沙坦可以通过抑制肠道BCRP,使肠细胞对瑞舒伐他汀的摄取量增加2.2 倍[28]。本研究发现生脉注射液对转运体MDR1、BCRP、OATP1B1 均具有抑制作用,IC50值分别为0.15%、0.75%、2.03%,其中对MDR1 与BCRP 的抑制作用较显著,其IC50值均未超过生脉注射液在人体内的最大血药浓度。因此,同样作为MDR1 与BCRP 的抑制剂,生脉注射液与MDR1 及BCRP 底物结合应用时可能存在药物代谢性相互作用的风险,但是否会产生由代谢性相互作用引起的药物不良反应,需要进一步的体内实验研究证实。
当前,随着中西联合用药普遍性的增加,由此产生的药物相互作用和不良反应事件也随之增加,因此,中药与其他药物间的联合应用的安全性和合理性受到越来越多关注。目前关于中药对CYP450酶和转运体活性影响的研究较少,缺乏指南指导下的系统性研究。为了使临床上合理、安全、有效地联合使用中西药物,应当加强中药在药物代谢方面的研究。
利益冲突所有作者均声明不存在利益冲突
