电解液添加剂NaHCO3对多孔氮化铌纤维电化学性能的影响
2021-06-24崔静轩吕东风张学凤郭鑫鑫张澳寒魏恒勇卜景龙
崔静轩,吕东风,张学凤,郭鑫鑫,刘 洁,张澳寒,崔 帅,魏恒勇,卜景龙
(1 华北理工大学 材料科学与工程学院,河北 唐山 063210;2 河北省无机非金属材料实验室,河北 唐山 063210;3 唐山市环境功能材料重点实验室,河北 唐山 063210;4 华北理工大学 新材料产业技术研究院,河北 唐山 063210)
随着能源危机和环境污染问题的日益严峻,高效、清洁和可持续利用能源逐渐成为当今研究的主题之一。但太阳能、风能等可再生能源的获取严重受到天气、海拔等外界环境的影响,具有明显的不稳定性,因此储能技术成为能源产业发展的关键环节,开发稳定、高效和环保的储能设备已成为当务之急[1]。超级电容器作为一种重要的新兴储能装置,由于其高能量密度、高功率密度、循环寿命长和绿色环保等优点受到广泛关注[2-3]。而电极材料作为超级电容器的重要组成部分,决定了其储能性能的优异,因此制备一种兼具高能量密度和高功率密度的电极材料是提升电容器性能的关键[4-5]。过渡金属氮化物具有高导电性、快速充放电性能及高振实密度等优点,是一类极有发展潜力的电极材料[6]。其中,氮化铌具有低电阻率(200 μΩ·cm)、高导电性,兼具高价态特征,能在电化学反应过程中实现价态的转化,因此表现出较高的电化学活性,可作为新型电极材料应用到超级电容器中[7-9]。此外,将纤维进行多孔化处理,能够有效增加材料比表面积,有利于电解液中离子的渗透和扩散,明显提高离子传输速率,有效降低电极电阻,并且纤维中存在的孔道结构可以缓解充放电过程中产生的机械应力,进一步提升材料的电化学容量存储性能。除此以外,氮化铌基超级电容器的性能与离子在电极和电解液中的传导速率、界面电荷传递速率等密切相关,这些因素均受到电解液成分的影响,因此寻找一种有效的电解液添加剂是很必要的[10]。例如,Komaba等[11]在氧化锰电池的电解液中添加NaHCO3,其缓冲作用避免了pH值的大幅变化,抑制锰的歧化反应,同时也有效抑制锰氧化物的溶解,使电池的比电容增加到230 F·g-1,提高了电池的电化学性能。
本工作采用静电纺丝结合氨气还原氮化技术合成出多孔氮化铌纤维,并以其作为电极材料制备成Nb4N5||Nb4N5对称型扣式电容,同时在电解液中添加NaHCO3以期改善电容器性能对电化学性能的影响。
1 实验材料与方法
1.1 实验原料
五氯化铌(NbCl5),聚乙烯吡咯烷酮(PVP,Mw=1300000),N,N-二甲基甲酰胺(DMF),N-甲基吡咯烷酮(NMP),聚偏氟乙烯(PVDF),无水乙醇(EtOH),均为分析纯。
1.2 实验过程
将1.5 g NbCl5和1.0 g PVP溶解于15 mL EtOH中,并加入6 mL DMF,经磁力搅拌2 h后制得前驱体纺丝溶液。采用静电纺丝法制备前驱体纤维,纺丝电压为20 kV,给料速度为1.0 mL/h,收集距离为15 cm。将收集到的前驱体纤维于80 ℃下干燥24 h,于空气气氛中600 ℃煅烧0.5 h,升温速率为5 ℃/min,得到多孔氧化铌纤维。
采用氨气还原氮化技术合成多孔氮化铌纤维:将得到的氧化铌纤维于800 ℃下还原氮化2 h,升温速率为5 ℃/min,得到多孔氮化铌纤维。进行氨气还原氮化时,先通入80 mL/min的N2,当温度升至300 ℃时换成流速400 mL/min的NH3,温度升到500 ℃时调整NH3流速为800 mL/min至最高温度800 ℃。降温时,当温度降至500 ℃时,NH3流速调至400 mL/min,降到300 ℃时,换成80 mL/min的N2。其中,尾气吸收液为冰乙酸与水的混合溶液。
1.3 制备对称式Nb4N5||Nb4N5扣式电容
按质量比16∶3∶1分别称取0.1 g的多孔氮化铌纤维、0.018 g的导电剂(乙炔黑)和0.00625 g的黏结剂(PVDF)加入研磨体中,再加入0.4 mL的溶剂(NMP)后进行研磨。将磨成的浆料均匀填涂于3.0 cm×4.5 cm的泡沫镍基体上,于80 ℃下干燥24 h。采用压片机于10.0 MPa下压制成电极片,然后利用冲孔机制备8 mm的电极片,选取两个质量相近的作为电极使用,采用直径为15 mm的玻璃纤维作为隔膜。将2.13 g的无水硫酸钠(Na2SO4)溶解于15 mL去离子水中,并加入不同添加量的碳酸氢钠(0,15,30,45 mmol·dm-3)作为电解液使用,采用手动电池封口机于100 MPa下组装成对称式LIR 2032扣式电容器。于25 ℃静置24 h后即可进行电化学性能测试。将制备成的扣式电容标记为Nb4N5-x,x为碳酸氢钠的用量,分别为Nb4N5-0,Nb4N5-15,Nb4N5-30,Nb4N5-45。
1.4 测试与表征
利用D/MAX2500PC型X射线衍射仪(XRD)测试样品的物相组成;采用Scios型聚焦离子束场发射扫描电子显微镜(SEM)表征样品的形貌结构;使用CHI604E型电化学工作站进行循环伏安(CV)、莫特肖特基(M-S)测试和阻抗(EIS)测试;利用CT2001A电池测试系统测试电容器的恒流充放电(GCD)性能。
2 结果与分析
2.1 结构分析
图1为样品的XRD谱图测试结果。可知,在2θ=24.64°,26.09°,36.13°,41.74°,60.87°,72.36°与76.41°处均出现了特征衍射峰。通过与标准卡片(JCPDS 51-1327)对比,发现上述衍射峰对应于四方相氮化铌晶体(101),(200),(211),(310),(312),(431)与(422)晶面,同时特征峰的峰形尖锐,无其他杂质峰存在,说明样品为纯度较高的氮化铌晶体[12]。
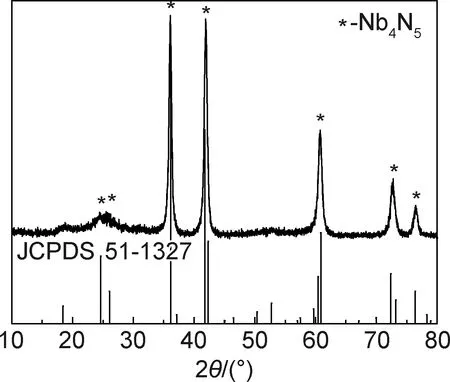
图1 纤维的XRD谱图Fig.1 XRD pattern of fibers
利用Crystal cell parameters软件,计算样品的晶胞参数a=0.685 nm,c=0.431 nm,与Nb4N5晶体的标准晶胞参数a=0.683 nm,c=0.428 nm有一定偏差,这是由于样品中有一定的氧元素[13]。采用式(1)计算样品的晶粒尺寸为24.8 nm。
(1)
式中:D是晶粒尺寸;K是谢乐常数(0.89);λ是X射线波长(0.154 nm);β是衍射峰的半高宽;θ是布拉格衍射角。
样品的XPS测试结果如图2所示。图2(a)的全谱表明,Nb4N5纤维由Nb,N,O和C元素组成。Nb3d核心能谱图包括两个明显的双峰和另一个弱的肩部,如图2(b)所示。对其进行拟合涉及Nb3+—N(203.8 eV处),Nb5+—N(206.4 eV处)和Nb5+—O(209.0 eV)的共同作用[13-15]。拟合结果表明,除了主要的Nb4N5之外,纤维表面还存在少量氧化铌。在图2(c)的O1s窄谱中,也出现了Nb—O(529.0 eV处)和Nb—N—O(和531.4 eV处)的结合键。在图2(d)的N1s元素窄谱中,395.8 eV和398.6 eV处分别对应Nb—N和Nb—N—O结合键[15]。这种现象在TiN和VN纳米线[16-17]中也有类似报道,主要是由于氧化铌未完全氮化造成的。
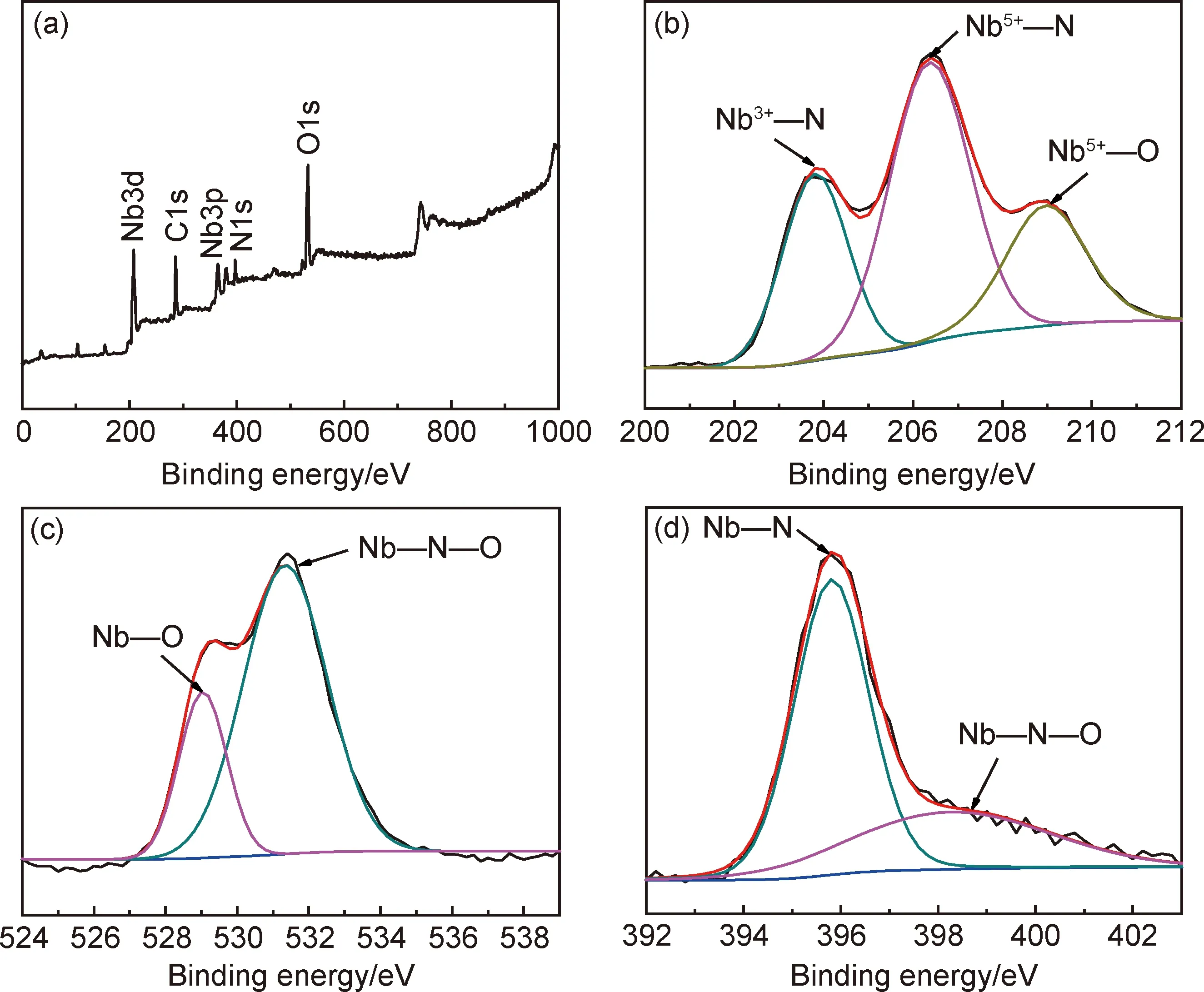
图2 纤维的元素分析 (a)XPS全谱图;(b)Nb3d高分辨光谱;(c)O1s高分辨光谱;(d)N1s高分辨光谱Fig.2 Elemental analysis of fibers (a)XPS total spectrum;(b)Nb3d high resolution spectra;(c)O1s high resolution spectra;(d)N1s high resolution spectra
图3为样品的SEM图。可以看出,氮化铌纤维具有良好的连续性,且纤维之间相互交织,但未发生粘连,纤维平均直径为150 nm。同时纤维中出现了纳米孔道结构,平均孔径为20 nm,这些分布在纤维中的孔结构能够使电极表面与电解质之间有更好的接触,有利于电解液进入纤维内部,为离子传输提供通道,增大电化学反应的空间,从而增加电化学反应活性,提高电化学性能[18]。

图3 纤维的SEM图Fig.3 SEM image of fibers
2.2 性能分析
为研究NaHCO3添加量对氮化铌纤维的电化学性能的影响,对制成的Nb4N5||Nb4N5对称型扣式电容进行电化学性能测试,如图4所示。CV测试曲线如图4(a)~(d)所示,其中电压为0~0.6 V,扫描速率为5~500 mV/s。
由图4(a)~(d)可知,当不添加电解液NaHCO3时,CV曲线中并无明显的氧化还原峰存在。表明在电化学测试过程中没有产生明显的赝电容,符合双电层电化学特征。当扫描速率增大时,曲线也能够存在类矩形,且表现出较高的对称性[19]。随着NaHCO3的加入,CV曲线仍能保持类矩形,且具有更大的积分面积,表现出更好的电容性。但由于Nb4N5电极表面存在大量的表面活性位点、残留氧元素以及多种价态的铌离子,在进行电位扫描中可能发生H+/Na+离子的嵌入及脱嵌化学反应,实现赝电容能量的储存机制,如式(2)所示[20]。

图4 扣式电容器在NaHCO3添加量为 0(a),15(b),30(c),45 mmol·dm-3(d)时的CV测试曲线及倍率性曲线(e)Fig.4 CV test curves of button capacitors with NaHCO3 content of 0(a),15(b),30(c),45 mmol·dm-3(d) and rate curves(e)
M=H+/Na+
(2)
根据CV曲线,由式(3)计算出比电容,进而得到图4(e)所示的倍率性曲线。可见随扫描速率的增加,倍率性出现衰减[21]。
(3)
式中:C为比电容,F/g;I为电流,A;m为活性物质质量,g;v为扫描速率,(V·s-1);V1,V2分别为电势窗口高压和低压值,V;S为单个CV曲线的积分面积;U为窗口电压,取0.6 V。
通过分析可知,Nb4N5纤维作为电极存在两种储能机制:双电层储能和赝电容储能,为此可以利用式(4),(5)量化赝电容的作用[22]。
i(V)=k1v+k2v1/2
(4)
i(V)/v1/2=k1v1/2+k2
(5)
式中:i为指定电位下的总电流响应,V;k1v为表面电容效应引起的电流;k2v1/2为扩散控制H+/Na+插入过程引起的电流。
绘制不同电位下i/v1/2与v1/2的关系图,得到直线斜率(k1)和截距(k2),进而求出CV区域中不同能量存储模式的存储电荷量,采用式(6)计算。
Q=Qs+Qd
(6)
式中:Q为一定扫描速率下封闭CV区域中的总存储电荷量;Qs为表面电容效应存储的电荷量;Qd为来自扩散控制H+/Na+插入过程存储的电荷量。计算结果如图5所示。

图5 500 mV/s扫描速率下电容器在NaHCO3添加量为0(a),15(b),30(c),45 mmol·dm-3(d)时的电容电荷存储作用图及不同电容电荷存储比例图(e)Fig.5 Capacitance charge storage contribution graphs at 500 mV/s scan rate with NaHCO3 content of 0(a),15(b),30(c),45 mmol·dm-3(d) and different capacitance charge storage ratios graph(e)
由图5(a)~(d)可发现,无添加剂时电极的赝电容占比为75.2%,添加NaHCO3后赝电容占比呈先上升后下降的趋势。如图5(e)所示,当添加量为15 mmol·dm-3时,赝电容占比增大到77.2%,而当添加量增加到30 mmol·dm-3和45 mmol·dm-3时,赝电容占比下降,分别为71.7%和65.3%。
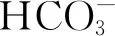
(7)
式中:CH是亥姆霍兹模型双电层电容器的比电容;εr是双电层内部的介电常数;ε0是真空介电常数;A是电极的表面积;d是表面电荷层和反离子层的间距。
图6为样品进行恒电流充放电测试制成的GCD曲线,其中,充放电电压为0~0.6 V,电流密度为5~1000 mA/g。图6(a)样品的充电时间明显大于放电时间,这是因为电解质离子渗入电极材料的孔道结构需要克服阻力,消耗更多的能量[24]。图6(b)~(d)样品的GCD曲线近似于三角形,充放电时间基本一致,有很好的对称性特征,表明其具有极高的库仑效率、较低的极化率和优良的化学可逆性。在电流密度相同的情况下,相比于Nb4N5电极在纯Na2SO4电解液中的放电时间,氮化铌电极在Na2SO4和NaHCO3混合电解液中的放电时间更长,进一步说明NaHCO3添加剂有利于电极材料稳定地保持其电化学性能。值得注意的是,随着电流密度的减小,电势-时间曲线的非线性变得尖锐,这是整个电势窗口的伪恒定充放电过程[25]。
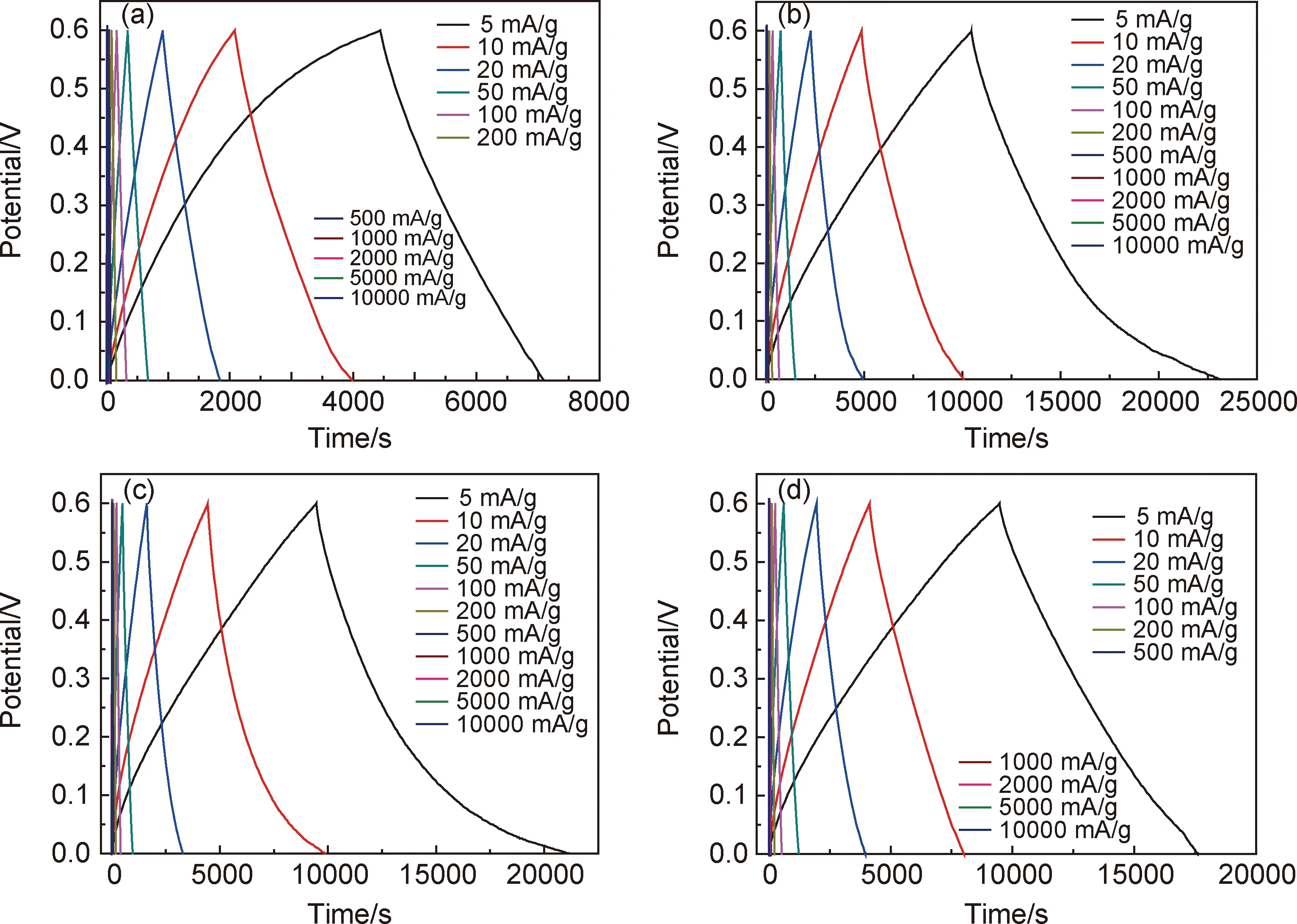
图6 扣式电容器在NaHCO3添加量为0(a),15(b),30(c),45 mmol·dm-3(d)时的GCD测试曲线Fig.6 GCD test curves of button capacitors with NaHCO3 content of 0(a),15(b),30(c),45 mmol·dm-3(d)
根据充放电曲线计算比电容[26],如式(8)所示。
(8)
式中:Δt为放电时间;I为放电电流;ΔU为充放电时间下的电势差。
不同扣式电容器的比电容曲线如图7所示。
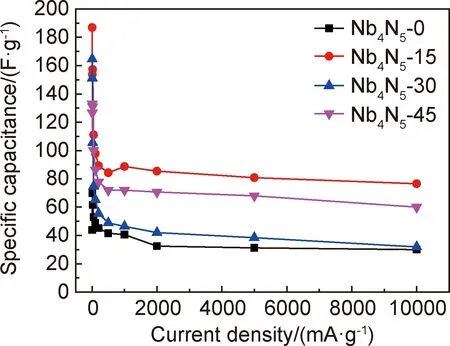
图7 不同扣式电容器的比电容曲线Fig.7 Specific capacitance curves of different button capacitors
图8为不同电容器的电化学阻抗谱。样品的阻抗曲线均由高频区的近似半圆和低频区的斜线两部分组成,其中高频区的半圆在阻抗x轴上的截距代表内在阻抗(R1),半圆弧直径代表反应中的界面电荷转移阻抗(R2),低频区的斜线斜率代表电解液中电解质离子的扩散阻抗(WR)[28-29]。经过拟合计算,各部分的电阻值如表1所示。

表1 不同扣式电容器的拟合电阻值Table 1 Fitting resistance value of different button capacitors
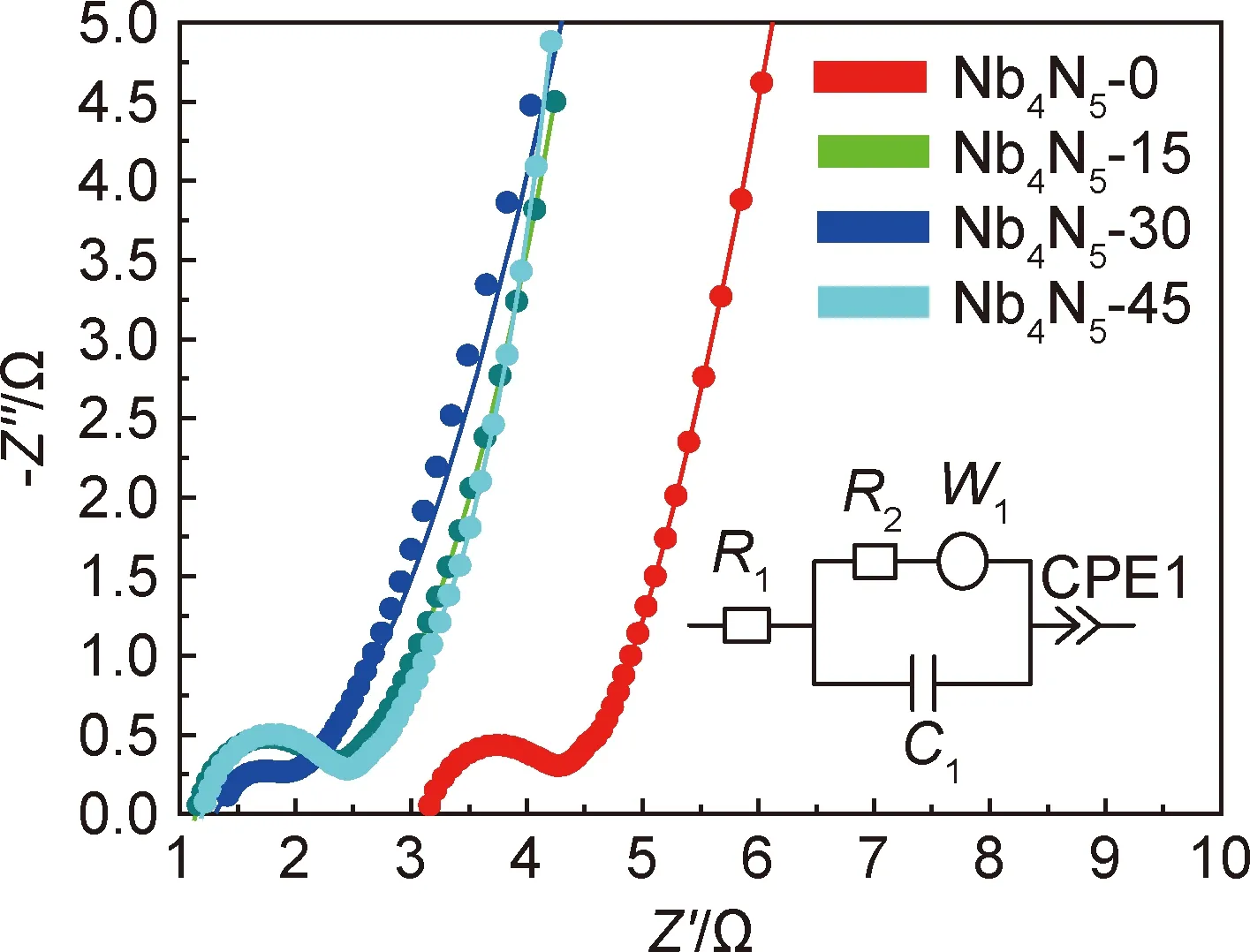
图8 不同扣式电容器的EIS测试曲线Fig.8 EIS test curves of different button capacitors
溶液阻抗R1很大程度上取决于所用电解质材料的类型(水、有机物、聚合物)及其在电极孔隙中的电阻,转移阻抗R2通常取决于电极厚度、微孔之间的导电性、反应界面的接触电阻和活性材料的导电性[30]。推测低频范围内45°或更高角度的倾斜直线是由于质子和钠离子扩散到电极的过程,再加上氮化铌纤维中纳米孔道中的电解液扩散和双电层电容共同作用的结果。
可发现,当加入NaHCO3后,电容器的R1减小。这是由于电解液的缓冲作用改善了电极孔道与电解液的接触,提高了离子导电性,保证了电子的快速转移。R2依NaHCO3添加量的不同略有增减,这与反应时电解液与界面的接触有关。NaHCO3浓度不同时阻抗谱在低频范围存在差异,归因于循环过程中纳米孔道中电解液的扩散差异。当添加剂浓度为15,45 mmol·dm-3时,扩散阻抗WR显著降低。值得注意的是,当加入量为30 mmol·dm-3时,R2较小,而WR显著增加,导致离子或电解液扩散困难,这也解释了为什么开始的电容值比较高,而后期衰减较为严重。
因此,NaHCO3主要通过降低本体电阻和增加扩散来提高电容器的比电容,但只有适量的添加剂能够明显降低电极电阻,提升电化学性能。过量的添加剂可能会导致电极与溶液反应生成铌酸钠,明显降低电极/电解质界面电荷转移的效率,加速容量衰减,同时铌酸钠的积累还会进一步诱导铌溶解,使电容进一步衰减。
为进一步验证阻抗分析结果,图9给出了电容器的Bode图。当相位角为-45°时,所对应的频率即为电极的特征频率,此时电容器的电容阻抗和电阻阻抗相等[31]。电极特征频率f0分别为2.1,4.1,3.8,3.2 Hz,对应的弛豫时间τ0可由式(9)计算。
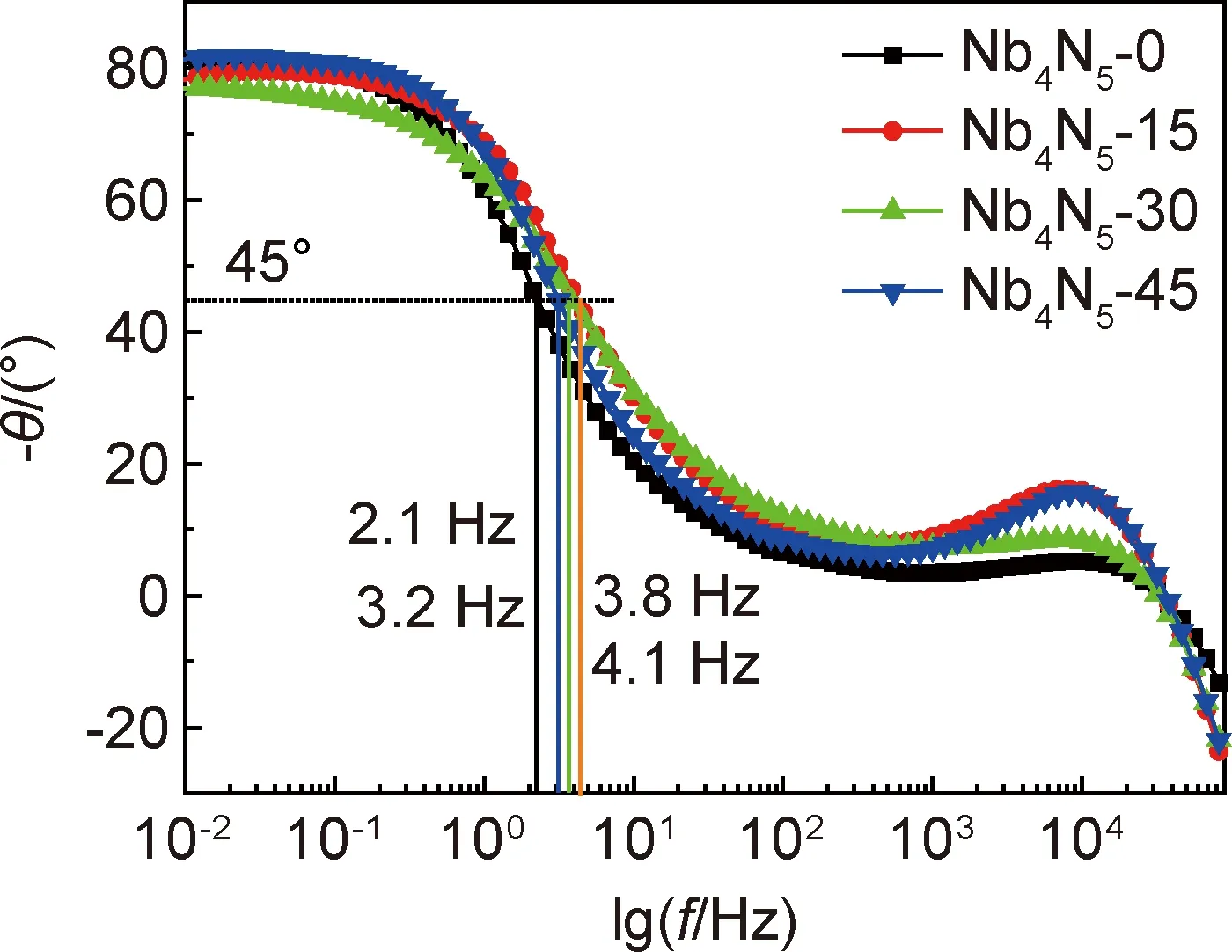
图9 不同扣式电容器的Bode图Fig.9 Bode diagram of different button capacitors
(9)
当NaHCO3添加量为0,15,30,45 mmol·dm-3时,对应的弛豫时间τ0分别为0.48,0.24,0.26,0.31 s,代表着电极以超过50%的效率释放所有能量所消耗的最短时间。可看出NaHCO3添加剂能够有效缩短能量释放所需的时间,其中,当引入量为15 mmol·dm-3时最显著,这与上述的实验结论一致。电解液中加入NaHCO3增加了离子的传输速率,促进了氮化铌电极材料的电化学反应,有利于提升电极的电化学性能进而产生高的比电容。
为探究样品导电性增强的原因,对样品进行莫特肖特基曲线(Mott-Schottky,M-S)测试,如图10所示,其中,电位扫描区间为0~6 V,频率为5 Hz。M-S曲线斜率先正后负,表明电极具有双极性N-P型半导体的特征。在开始电位条件下,电极呈现N型半导体特征,然后出现一个峰值。这可能是,电解质溶液与基体间可看作一个平板电容,在电场作用下离子的偶极矩矢量总和不为0,产生了极化[32],其中添加量为15 mmol·dm-3的峰值电位明显左移,随着电位的增大,电极呈现P型半导体的特征。
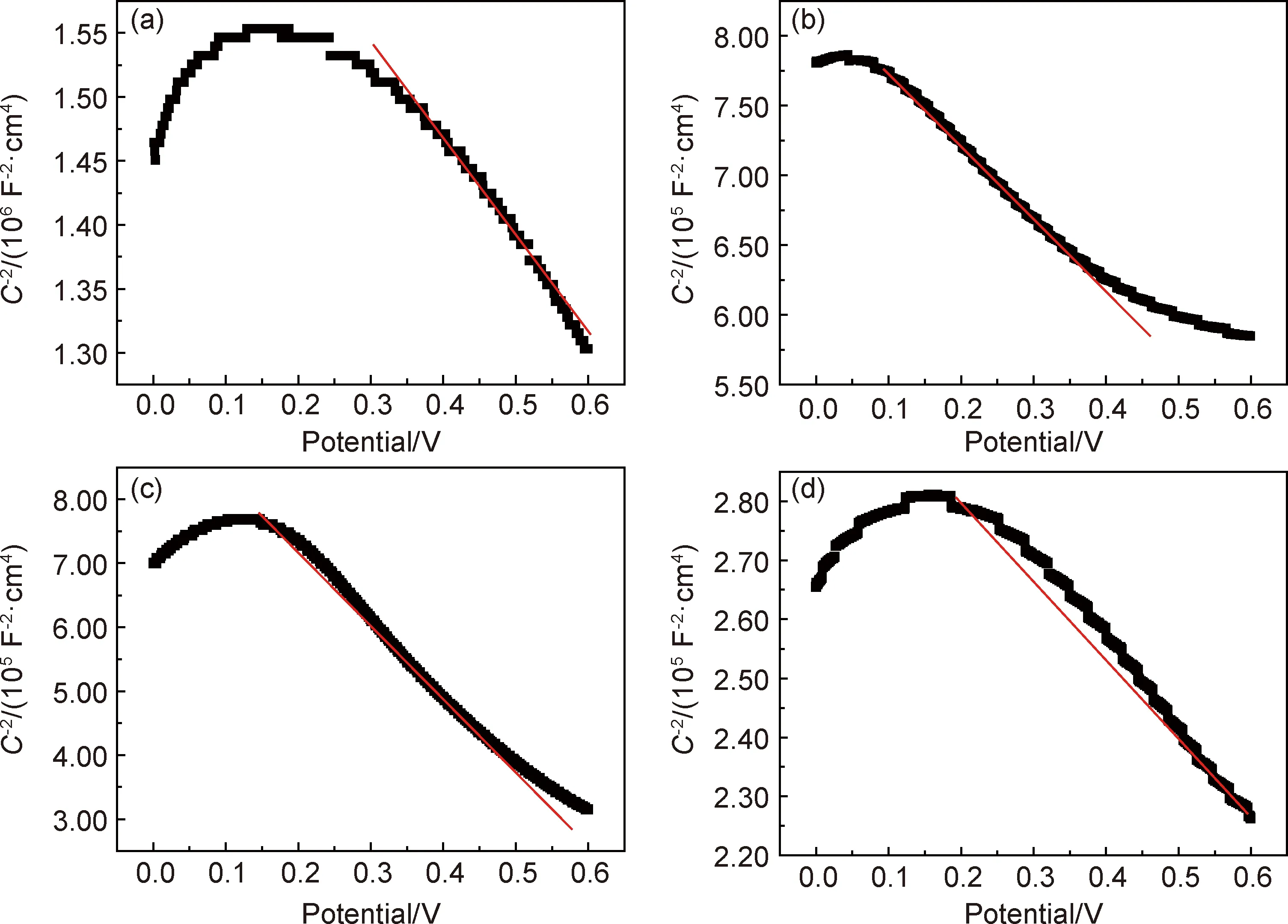
图10 扣式电容器在NaHCO3添加量为0(a),15(b),30(c),45 mmol·dm-3(d)时的莫特肖特基曲线Fig.10 M-S curves of button capacitors with NaHCO3 content of 0(a),15(b),30(c),45 mmol·dm-3(d)
利用莫特肖特基曲线的线性部分做直线,求出斜率,即可得到电极的载流子浓度Nd,计算公式为[33]:
Nd=(2/e0εε0)[d(1/c2)/dv]-1
(10)
式中:e0为电子电量;ε为Nb4N5介电常数;ε0为真空介电常数;[d(1/c2)/dv]是M-S曲线线性部分的斜率值。
各样品载流子浓度和斜率值的计算结果如表2所示。可以看出,随着NaHCO3添加量的增加,样品的载流子浓度升高,但当添加量为30 mmol·dm-3时,载流子浓度略有降低,这可能是由于随着NaHCO3浓度增加,电极表面形成铌酸钠,使电子转化困难,导致载流子浓度降低。当添加量增加到45 mmol·dm-3时,溶液中离子的扩散性能提高,导致载流子浓度增大,这与阻抗谱结论相一致。

表2 电极的载流子浓度及斜率Table 2 Carrier concentration and slope of electrode
循环稳定性是表现超级电容器电极材料在使用过程中的重要参数之一。图11是NaHCO3添加量为0,15 mmol·dm-3时,制备出的对称式电容器在50 mA·g-1下进行的循环稳定性测试。

图11 Nb4N5-0和Nb4N5-15扣式电容器的循环性能曲线Fig.11 Cycles performance curves of Nb4N5-0 and Nb4N5-15 button capacitors
可知,未添加NaHCO3时的比电容经5000次循环测试后出现32%的衰减,而加入15 mmol·dm-3的NaHCO3后,电容衰减达38%。这是因为,Na+的嵌入及脱出反应会导致铌酸钠的产生,使得氮化铌电极在长时间的循环稳定性测试中极易溶解,当加入NaHCO3后,Na+浓度的增大导致溶解反应加剧,电容衰减严重,保有率降低[34-36]。
3 结论
(1)采用静电纺丝结合氨气还原法制备出具有多孔结构的氮化铌纤维,物相为四方相氮化铌。纤维的平均直径为150 nm,存在平均孔径为20 nm的孔结构,这有利于离子快速传输,提高材料的电化学储能性能。
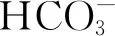
(3)当NaHCO3添加量为15 mmol·dm-3时,有效降低溶液电阻,加快离子的传输速率,提高离子电导率,比电容增大到187 F·g-1,弛豫时间为0.24 s,提高了电容器的储能性能。
