MoOx量子点的合成及其在Fe3+和F-检测中的应用*
2021-06-24王佳乐陈晓勇张泽宇吴义晗贾璋明
王佳乐, 陈晓勇, 张泽宇, 吴义晗, 贾璋明
(中北大学 化学工程与技术学院, 山西 太原 030051)
0 引言
近年来, 过渡金属氧化物(TMO)纳米材料因其独特的电、 光和机械性能而受到科学研究者的关注[1]. 在TMO中, 氧化钼(MoOx)纳米材料包括纳米带、 纳米棒、 纳米线、 纳米片等, 当MoOx横向尺寸小于100 nm时, 即可获得量子点. MoOxQDs除了保持其固有特性外, 还具有独特的特性, 例如新型光致发光(PL)等[2]. 然而, 只有少数报告提到了其在生物和制药领域中作为光致发光探针来用于检测物质.
MoOxQDs由于具有优异的荧光特性、 生物相容性及光、 化学稳定性, 越来越受到科学家们的青睐[2]. Xiao等人用二硫化钼(MoS2)和过氧化氢(H2O2)合成了高光致发光的MoOxQDs, 并且用于检测TNT[3]; 同时该课题组将利用相同体系(MoS2-H2O2)制成的MoOxQDs进一步作为新型的光致发光探针, 用于卡托普利的测定[4]; 随后此团队将MoOxQDs用于检测乙酰胆碱酶活性, 为筛选其抑制剂提供手段[5], 上述文献报道都体现出MoOxQDs在检测方面的应用前景.
铁是地壳中含量最高的金属元素, 在许多生物生命活动过程中发挥着关键的作用, 如氧气运输、 转录调控、 DNA复制和电子转移[6-8]. 铁摄入不足或过量会导致某些疾病, 例如关节炎, 糖尿病, 癌症. 衰老疾病如阿尔茨海默氏病和其他神经发生性疾病与缺乏Fe3+有关[9]. 摄入过量Fe3+会由于自由基的形成而导致组织损伤[10]. 因此, Fe3+的检测在临床上具有重要的意义. 氟(F-)是人体必不可少的元素, 氟化物是牙膏、 药物甚至饮用水中的常见添加剂, 然而, 异常含量的F-不仅会损害水生生物和植物, 还会给人类带来许多健康问题, 例如牙齿和骨骼氟中毒, 急性胃肾疾病和DNA损伤[11-13], 所以, 对于Fe3+和F-的检测显得尤其重要.
检测Fe3+和F-的方法有很多, 但是使用MoOxQDs检测的方法至今鲜见, 为此, 本文以MoS2和H2O2作为前体和氧化剂, 通过在水热过程中添加H2O2, 合成了MoOxQDs, 并用于检测Fe3+和F-.
1 实验部分
1.1 实验材料
无水乙醇, 二硫化钼(MoS2), 30%过氧化氢(H2O2), 氯化镁(MgCl2), 氯化汞(HgCl2), 氯化锌(ZnCl2), 氯化锰(MnCl2), 硫酸铜(CuSO4), 硝酸镉(Cd(NO3)2), 硝酸镍(Ni(NO3)2), 氟化钠(NaF), 硫酸铝(Al2(SO4)3), 氯化钴(CoCl2), 氯化铵(NH4Cl), 以上试剂均为分析纯, 生产厂家为天津市凯通化学试剂有限公司.
1.2 实验仪器及表征手段
实验仪器:电热鼓风干燥箱(DHG-9030A, 上海一恒科学仪器有限公司); 高速离心机(HC-3018, 安徽中科中佳科学仪器有限公司); 冷冻干燥机(FD-1A-50, 北京博医康实验仪器有限公司).
表征手段:量子点的尺寸测量采用(JEM2100F)透射电子显微镜; 采用X射线光电子能谱XPS(赛默飞 Escalab 250Xi)进行化合物元素组成的测定和键合结构的表征; 傅里叶变换红外光谱(FTIR)由Nicolet 5700红外光谱仪获得; 溶液的荧光光谱和紫外吸收光谱分别由荧光光谱仪F-7000(日本日立)和沃尔默(Lambda 35)来记录.
1.3 量子点的合成
称取3 mg的MoS2, 将其分散在45 mL的无水乙醇中, 随后加入2 mL H2O2并用超声混合均匀, 接着将悬浮液转移到100 mL不锈钢反应釜中, 在180 ℃恒温11 h, 最后经离心得到上清液, 即为产品.
1.4 Fe3+和F-的荧光测定
对Fe3+进行检测:取3 mL MoOxQDs分散液, 然后添加各种浓度的Fe3+标准品, 在室温下混合均匀, 1 min后记录溶液的荧光光谱. 其他离子的检测是在相同条件下进行的.
对F-进行检测:取3 mL MoOxQDs分散液, 先后加入30 μL 0.1 mol/L Fe3+, 不同浓度的F-标准品, 室温下混合1 min后, 记录溶液的荧光光谱.
2 结果与讨论
2.1 量子点的表征
图1 是MoOxQDs微观形貌的测定图(TEM图), 从图中可以看出, 合成的量子点具有很好的分散性, 尺寸分布均匀, 粒径分布窄. 同时, 对图中近200个点进行统计测量, 结果表明制备的量子点的平均尺寸为5.25 nm, 且在HRTEM下能清楚地看到量子点的晶格为0.26 nm.
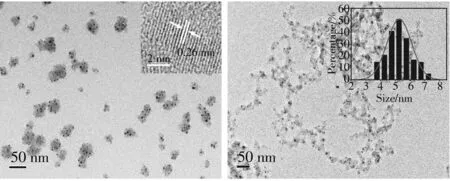
图1 MoOx QDs的TEM和HRTEM图像
图2 是MoOxQDs微观形貌的测定图(AFM), 从图中可以看出, 所制备的MoOxQDs是均匀的, 平均高度为5.33 nm, 这与TEM结果基本吻合.
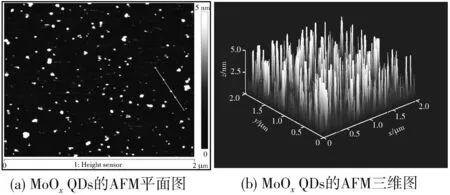
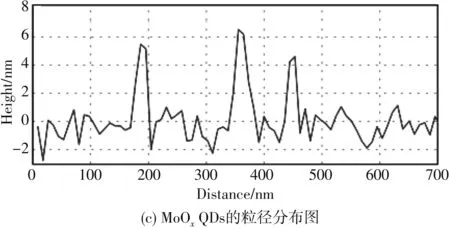
图2 MoOx QDs的AFM图像
XPS被用来研究合成的MoOxQDs中元素的化学状态, 图3(a) 为XPS的全谱, 可以清楚地看到Mo3d, O1s, S2p. 对Mo3d、 S2p进行了精细谱图分析, 其中图3(b) 为Mo3d的高分辨谱图, 在235.6 eV、 232.8 eV出现的特征峰分别对应Mo6+3d3/2和3d5/2, 说明给定足量的H2O2和足够长的反应时间, Mo4+价态会逐渐被 H2O2全部氧化为 Mo6+[14], 图3(c) 为S2p的高分辨谱图, 可以看出, 制备的MoOxQDs中S2s峰消失, S2p的结合能增加, 169.3 eV和170.1 eV对应的为SO42-中S元素的存在形式. 可以得出结论, 合成的MoOxQDs是MoO3. H2O2氧化MoS2的反应方程式为
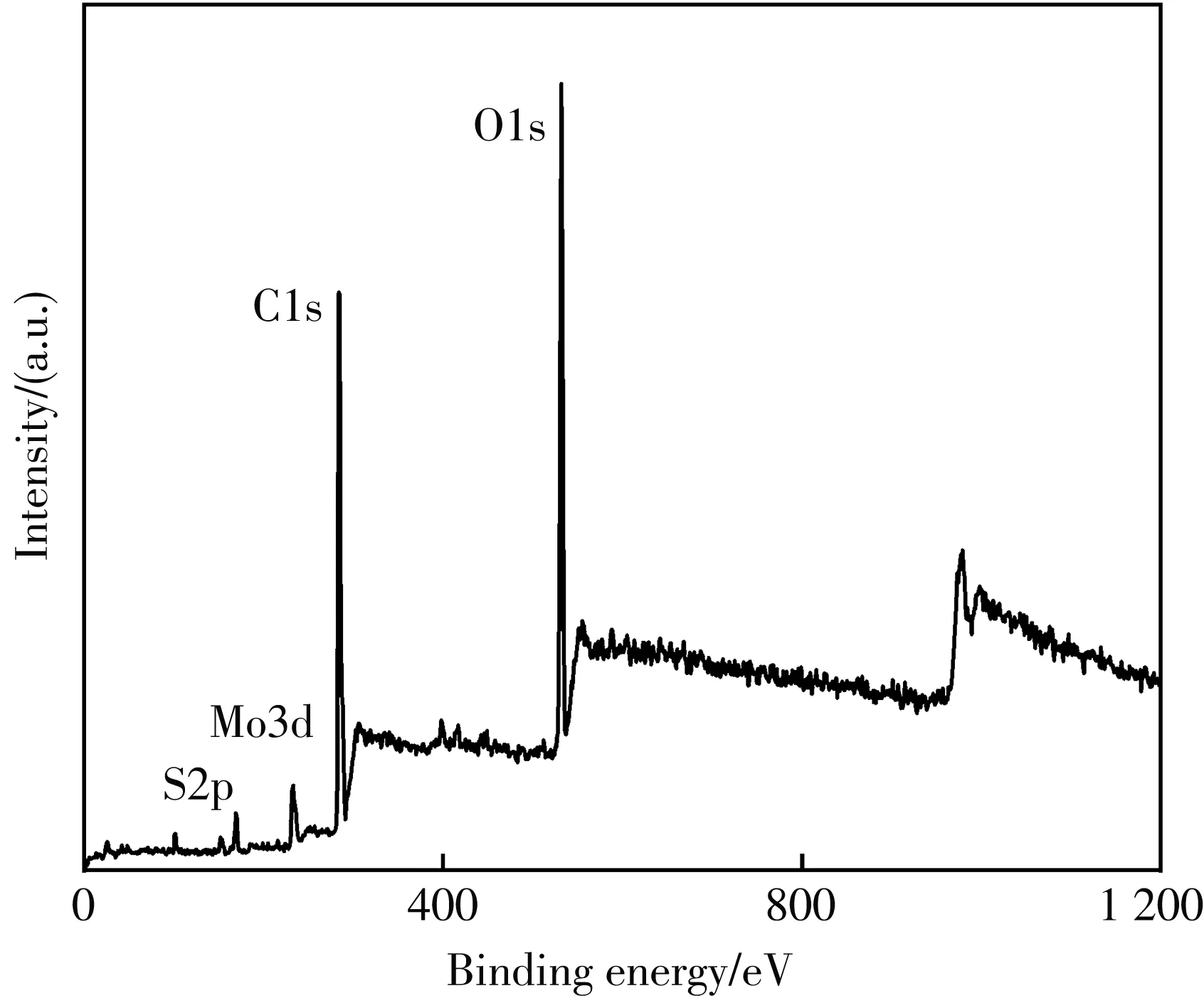
(a)MoOx QDs的XPS全谱

MoO3QDs有丰富的缺陷态(氧空位), 其形成的原因可能是在氧化的过程中, 越来越多的S原子不断地从 MoS2晶格中释放出来. 由于Mo-S 亲和力较Mo-O的亲和力低, H2O2提供的氧原子不断地填充MoS2晶格空穴, 随着反应的进行, 几乎所有的S原子都被O原子取代, 最终合成了MoOxQDs[15].

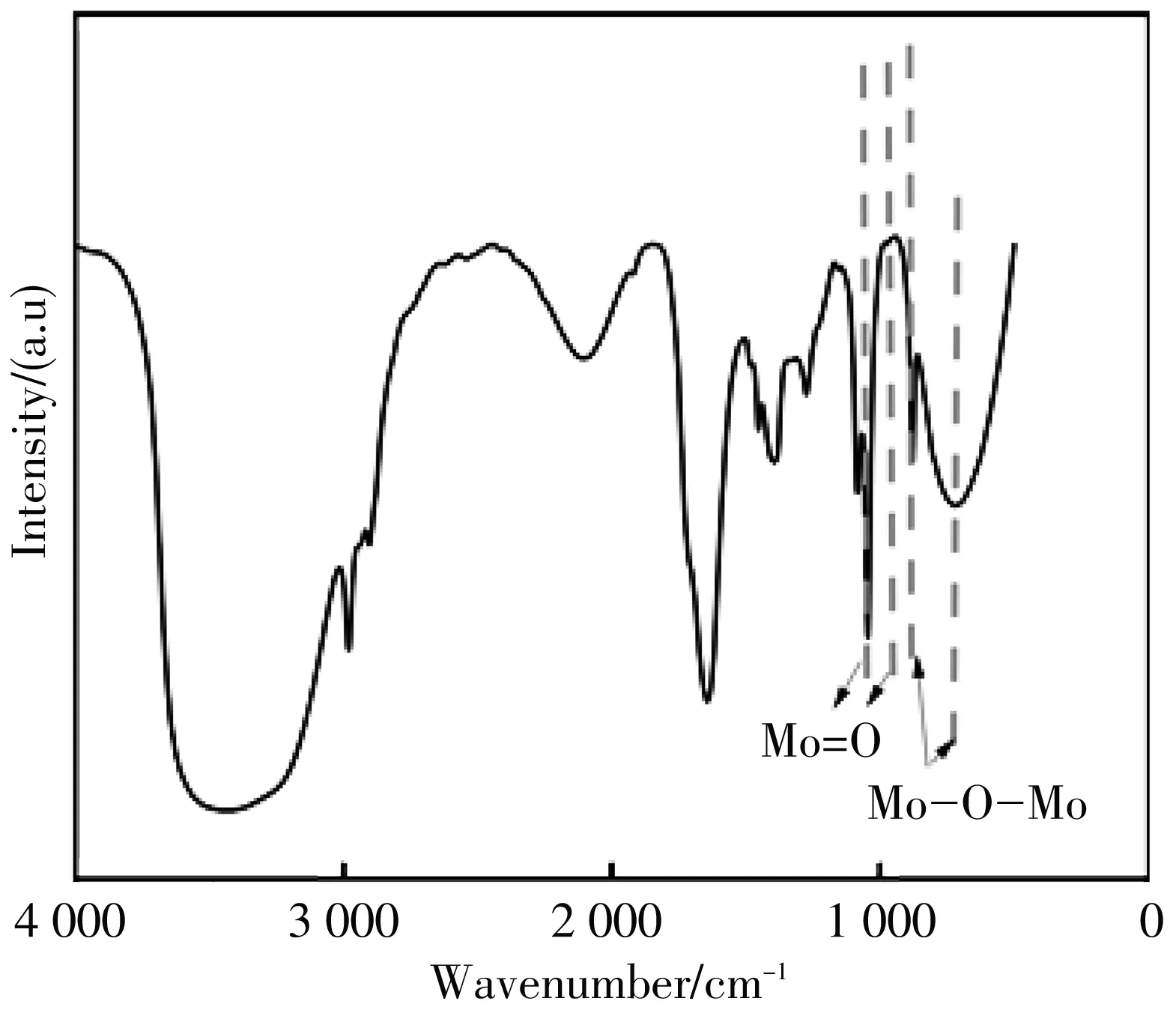
图4 MoOx QDs的红外谱图
制备的MoOxQDs具有良好的吸收和发射能力, 在图5(a) 给出了MoOxQDs的紫外吸收图谱和荧光图谱, 所制备的MoOxQD的紫外吸收光谱在315 nm达到最大值, 同时对制备的量子点进行了荧光光谱的测试, 得到λex=395 nm,λem=464 nm, 同时从图5(b) 可以看出, 随着激发波长的增大, 量子点的发射峰略微红移, 具有较强的激发波长依赖性.
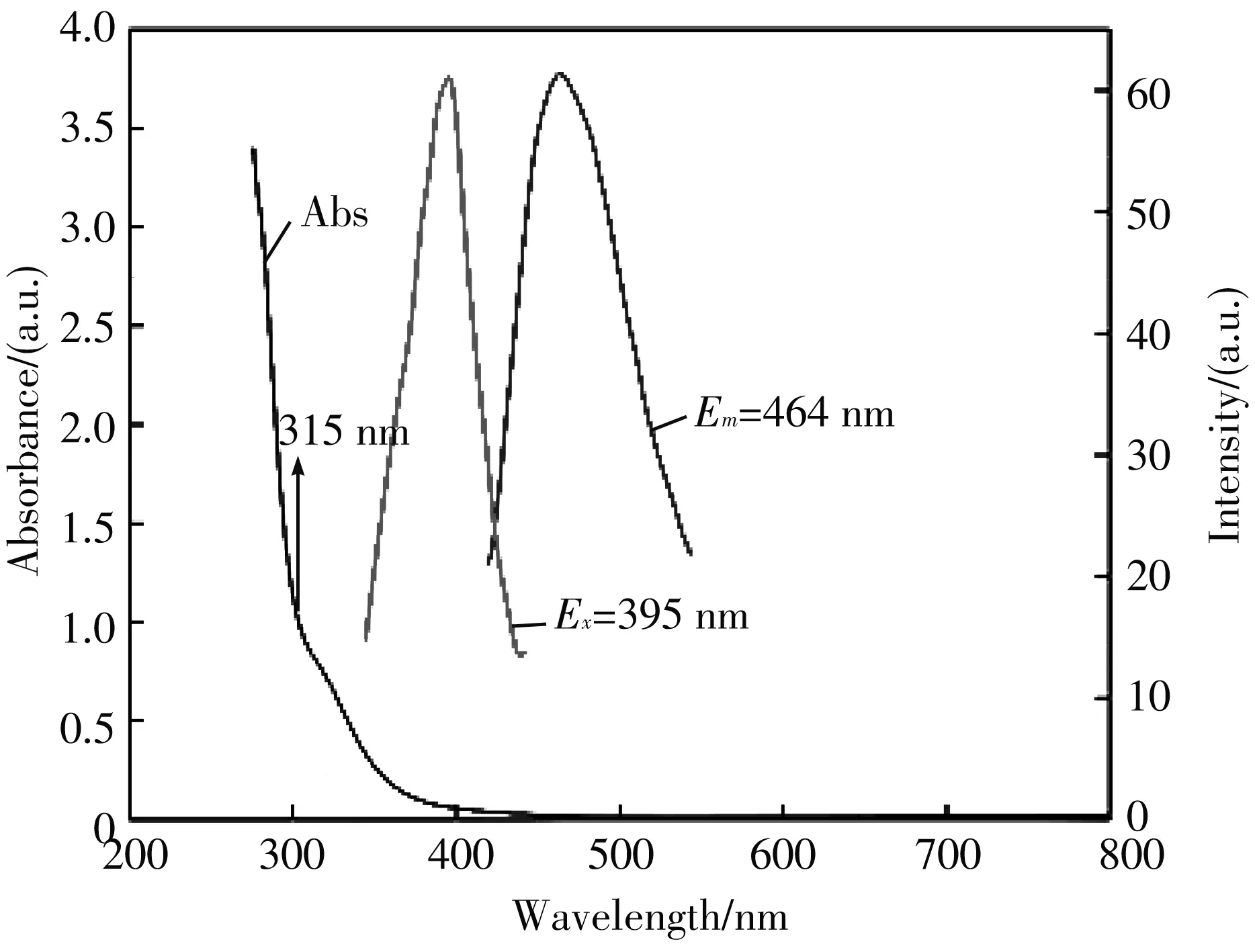
(a) 紫外吸收和荧光光谱
2.2 Fe3+和F-的检测
以MoOxQDs为荧光探针, 通过加入Fe3+使得荧光猝灭, 构建了Turn-off型荧光传感器来检测Fe3+. 如图6 所示, MoOxQDs于395 nm波长激发下, 在464 nm处发射的强的荧光能够随着Fe3+浓度的增加发生有效的猝灭, 且当Fe3+浓度8 μmol/L时, MoOxQDs表面的O原子与Fe3+结合达到饱和, 此时猝灭程度达到90%.
如图6(c) 所示, 当Fe3+的浓度处于1 μmol/L~5 μmol/L时, MoOxQDs的荧光恢复因子(I0-I/I0)和Fe3+的浓度存在良好的线性关系, 线性方程为y=0.168 46x-0.127 93(R2=0.994 39,n=13). 对Fe3+的检出限为178 nm(3σ/K)(σ为矫正空白信号后的标准偏差,K为拟合直线的斜率)
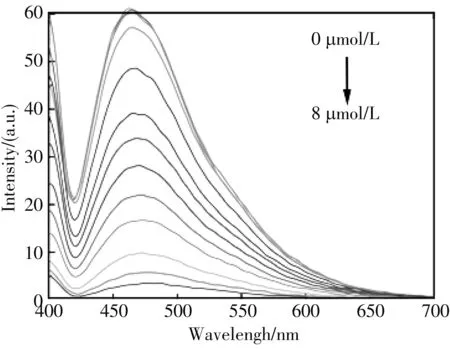
(a) 荧光图谱随Fe3+浓度的变化图
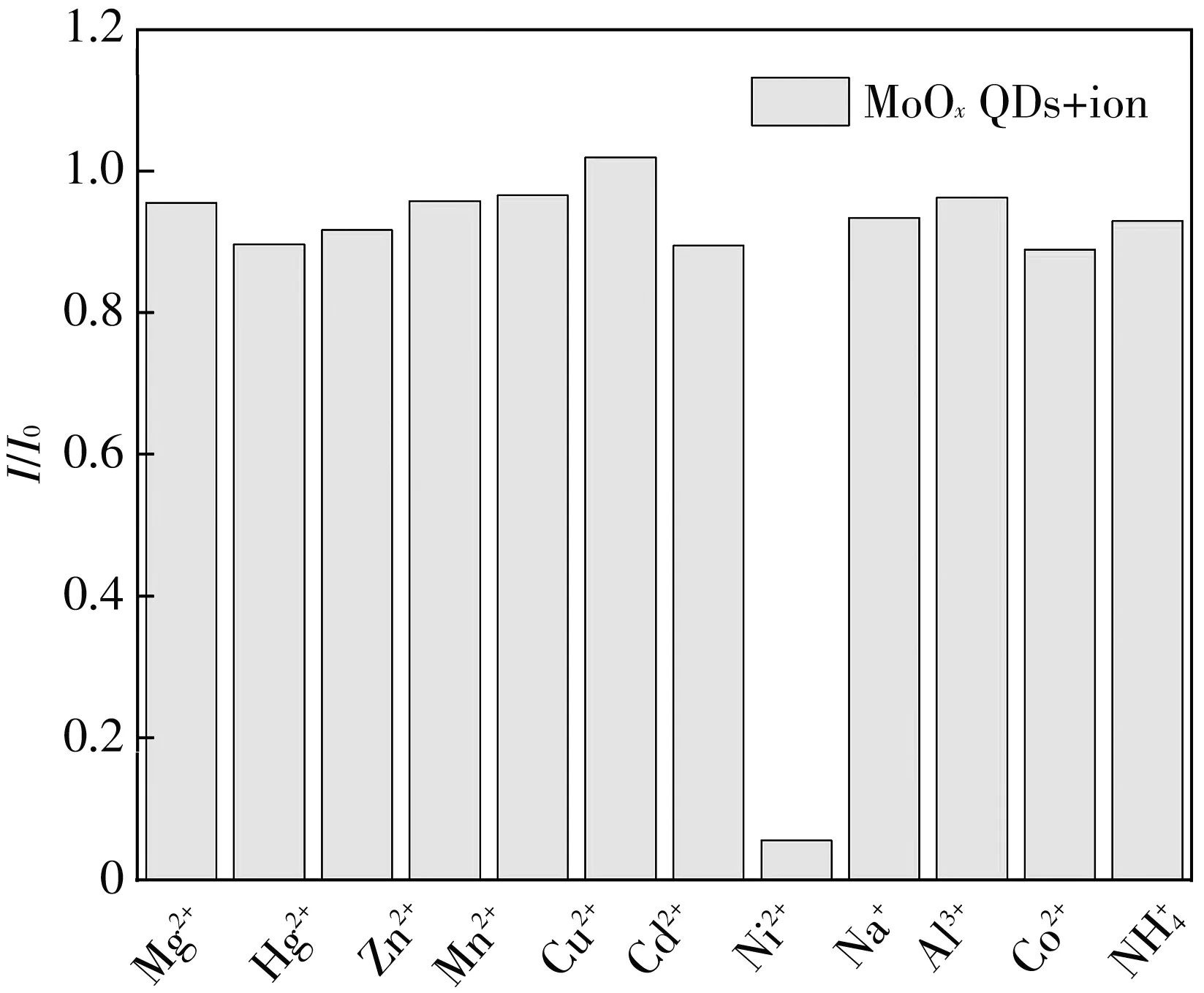
(a) MoOx QDs对不同离子的响应情况
F-的加入能够使Fe3+猝灭后的荧光得到恢复, 因此, 我们以MoOxQDs为荧光探针,开发了一种Turn-off-on型传感器用于F-的高灵敏高选择性的检测. 从图8 可以看出, 在经8 μmol/L Fe3+猝灭后的溶液中添加不同浓度的F-, 溶液荧光逐渐恢复. 当F-的浓度处于0 μmol/L~8 μmol/L时, (I-I0/I0)和F-的浓度存在良好的线性关系, 线性方程为y=0.212 01x+0.0224 2 (R2=0.994 99,n=13). 对F-的检出限为143 nmol/L.

(a) Fe3+猝灭后, 随着F-的加入荧光光谱的变化图
在MoOx中, 通过加入Fe3+使得荧光猝灭, 然后在猝灭后的溶液中加入F-, 荧光恢复, 可能的原因是:Fe3+的加入使得荧光猝灭, 根据Stern-Volme方程, 猝灭速率常数Kq为3.62×1011[L·(mol·s)-1], 大于2×1010[L·(mol·s)-1], 由此可以判断为静态猝灭, 根据Fe3+的紫外吸收图谱在300 nm~400 nm处有较强的吸收峰[17], 与MoOxQDs的荧光激发图谱存在较大程度的重叠, 可以推断Fe3+通过内滤效应猝灭MoOxQDs的荧光. 当加入F-时, 由于Fe3+与F-具有很强的结合能力, 从而生成复合物, 导致内滤效应消失, 从而使荧光恢复.
3 结 论
本文以MoS2为钼源, H2O2为氧化剂, 无水乙醇作为剥离剂, 合成了高质量的MoOxQDs, 所得的量子点平均尺寸为5.25 nm; 以MoOxQDs为荧光探针, 构建了Turn-off和Turn-off-on传感器, 并用于检测Fe3+和F-, 在最佳条件下, 检出限宽分别为1 μmol/L~5 μmol/L(178 nmol/L)和0 μmol/L~8 μmol/L(143 nmol/L), 能够在室温下实现对Fe3+和F-的快速检测.
