等离子诱变Trametes sanguinea WTFA5产漆酶培养基优化及酶学性质研究
2021-06-23杜杰克张川川袁海波刘洪玲王腾飞
杜杰克,张川川,李 沙,袁海波,刘洪玲,王腾飞*
1.齐鲁工业大学(山东省科学院) 生物基材料与绿色造纸国家重点实验室,济南 250353
2.山东富欣生物科技股份有限公司,淄博 256300
漆酶是一种可以氧化多种酚类和非酚类化合物的多铜氧化酶,广泛分布于高等植物、微生物、藻类、昆虫和无脊椎动物中[1-3]。漆酶因其催化反应的副产物只有水,从而作为一种绿色催化剂被应用于不同工业、环境和生物技术领域,如食品行业中的烘焙和饮料处理、造纸工业中的纸浆漂白和染料降解、生物燃料中的木质素降解、环境修复中的多环芳烃降解、生物传感器中的电子转移等[4]。
目前,担子菌是漆酶的主要生产菌株。然而,天然担子菌的漆酶发酵周期长,并且酶活高低因菌株而异[5]。因此,为了提高菌株的产漆酶效率,研究人员在不同的真菌中做了大量研究,例如诱变育种,培养条件优化,异源表达和共培养等。其中,异源表达和共培养得到的漆酶酶活较低,和天然担子菌相比仍具有较大差距[6-8]。与这两方法相比,对野生担子菌进行诱变育种和培养条件优化可以在短时间内提高漆酶酶活,因此受到研究者的青睐[9-12]。我们从白腐枯木样品中分离到一株产漆酶的血红栓菌(TrametessanguineaWTFA5)(以下简称为A5),随后对其进行了诱变育种,并对漆酶酶活较高的突变体进行了培养基优化,最后对漆酶进行了纯化并对其酶学性质进行研究。
1 材料与方法
1.1 材料
1.1.1 试剂
研究所用试剂,如2, 2′-联氮双(3-苯乙烯苯并噻唑啉-6-磺酸)二铵盐(ABTS)、愈创木酚和2, 5-二甲基苯胺等皆购自上海麦克林生化科技有限公司(特别说明的试剂除外)。恒温振荡器ZQZY-CS购自济南知学商贸有限公司,酶标仪Synergy Neo2购自BioTek公司。
1.1.2 培养基
初筛培养基为添加1 mmol/L愈创木酚的YPD固体培养基(葡萄糖20 g/L,蛋白胨20 g/L,酵母提取物10 g/L,琼脂粉20 g/L)。种子培养基为YPD液体培养基,250 mL摇瓶装有40 mL培养基及8个直径4 mm的玻璃珠。液体复筛培养基为:葡萄糖8.8 g/L,酒石酸铵0.24 mmol/L,氮基三乙酸0.15 g/L,2, 2-二甲基琥珀酸1.46 g/L,七水硫酸锌1 mg/L,磷酸二氢钾2 g/L,七水硫酸镁0.5 g/L,五水硫酸锰5 mg/L,二水氯化钙0.1 g/L,氯化钠10 mg/L,七水硫酸亚铁1 mg/L,维生素B1 1 mg/L,十二水硫酸铝钾0.15 mg/L,六水氯化钴1 mg/L,二水钼酸钠0.1 mg/L,五水硫酸铜0.1 mg/L,硼酸0.1 mg/L[13]。每250 mL摇瓶装有40 mL复筛培养基。所有培养基均在115℃下灭菌30 min。所有实验均重复3次。
1.2 方法
1.2.1 菌株筛选
将采自广西省南宁市青秀山风景区地表的枯木样品用无菌水洗涤后,过滤除去菌丝及杂物,然后稀释涂布于初筛培养基中,30 ℃培养5 d左右,直至观察到菌丝和红色氧化圈。将氧化圈较大的菌株接种到YPD固体培养基中,生长3 d左右,以修剪过的枪头在生长速度最快的菌丝边缘处打孔制作菌塞,菌塞直径约为3 mm,厚度约为5 mm。将菌塞接种到种子培养基中,30 ℃、200 rpm条件下培养36 h后,以5%(v/v)的接种量接种至液体复筛培养基中,30 ℃,200 rpm发酵测定漆酶酶活。
筛选到的白腐菌(A5)基因组DNA的分离和菌株鉴定由中国工业微生物菌种保藏管理中心进行。
1.2.2 菌株诱变
将菌株接种至YPD固体平板上,培养14 d左右产孢子。孢子悬液的制备和ARTP照射剂量均参照Liu等[14]。
为了有效地筛选到阳性突变菌株,将处理后的样品稀释涂布于初筛培养基中,挑取比对照显色圈更大的菌株。以1.1中的方法进行发酵实验,测量不同突变体的漆酶活性。以YPD平板培养突变体菌株产孢子,然后将孢子以同样的方式进行遗传稳定性的测定。
1.2.3 培养基优化
首先以单因素实验方法筛选了几种不同的真菌产漆酶常用碳源(麸皮水(市售)、纤维二糖、葡萄糖、麦芽糖和番茄汁(市售))、氮源(酵母提取物、蛋白胨、酒石酸铵、玉米粉(市售)和豆粕粉(市售))。然后确定了四种因素(碳源、氮源、铜离子、诱导剂)的浓度范围。其中诱导剂在发酵72 h时添加。
使用正交实验对碳源、氮源、铜离子和诱导剂浓度四个因素进行了三个水平的统计研究。
1.2.4 漆酶的表征
以1.2.3中优化后的培养基对诱变后的最优突变体进行培养,用所得发酵液进行漆酶的分离纯化。将发酵液过滤除去部分菌丝,然后12 000 rpm离心10 min收集上清液,向上清液中添加提前烘干并冷却的硫酸铵粉末,收集60%~80%硫酸铵浓度级分的蛋白沉淀。将沉淀物溶于100 mmol/L的pH 4.5的柠檬酸钠缓冲溶液中,在4 ℃下透析过夜。以12%非变性聚丙烯酰胺凝胶电泳分离漆酶和杂蛋白,以100 mmol/L愈创木酚对凝胶进行染色,均匀切下细小的漆酶条带,少部分用于蛋白质质谱分析(北京百泰派克生物科技有限公司),剩余部分在透析袋中继续电泳,将电泳结束后的样品离心,超滤浓缩,即为纯化后的漆酶溶液[15]。使用12%聚丙烯酰胺凝胶对纯化后的漆酶进行变性蛋白质电泳,上样量20 μL;5×蛋白上样缓冲溶液组成为:2 mL pH 6.8,0.1 mol/L Tris-HCl;1 mL 87%甘油;0.1 mg溴酚蓝;用双蒸水定容至10 mL。
漆酶酶活测定体系为:160 μL柠檬酸钠缓冲溶液(100 mmol/L,pH 3.0),20 μL漆酶溶液,20 μL 5 mmol/L的溶于柠檬酸钠缓冲液的ABTS。以酶标仪在25 ℃监测OD420处1 min的变化量。一个酶活单位定义为在1 min内氧化1 μmol ABTS所需的酶量。以ABTS为底物,在25 ℃下测定漆酶的最适pH,在不同温度(20~70 ℃)下测定其最适温度。在不同温度(20~80 ℃)下孵育,测定漆酶温度稳定性。
漆酶酶活计算公式为:
(1)
其中,Vt是总反应体系;Ve是酶体积;T为反应时间(1 min);n为稀释倍数;ΔOD420为1 min内420 nm处吸光值的变化量;d为光程(0.5 cm);εABTS为ABTS的摩尔消光系数(36 000 L· mol-1·cm-1)[16]。
蛋白浓度测定、动力学常数Km和催化常数Kcat按照Ramirez-Cavazos等的方法测定[17]。Vmax由origin 8.0计算得出。
2 结 果
2.1 产漆酶菌株Trametes sanguinea WTFA5的筛选和鉴定
2.1.1 菌株的筛选
通过初筛,有多株菌株在初筛培养基中显示出了红色显色圈,随后选取氧化圈较大的7株菌,分别命名为A1-A7。其中,A5在复筛培养基中展现出较高的漆酶酶活,为(123.2±4.7) U/L(图1)。A5菌株在YPD培养基中气生菌丝较少,而在愈创木酚-YPD培养基中气生菌丝较旺盛(图2)。

图1 A1-A7野生菌株在复筛培养基中的漆酶酶活

图2 野生菌株在复筛培养基中的漆酶酶活
2.1.2 菌株的鉴定
图1中菌株A5经中国工业微生物菌种保藏管理中心鉴定后命名为血红栓菌(TrametessanguineaWTFA5),保藏编号为:50181。该菌株的18S核糖体RNA序列,内部转录间隔1区,5.8S核糖体RNA序列和内部转录间隔2区完整序列已上传至NCBI,编号为MW262897。
2.2 等离子诱变提升T. sanguinea WTFA5的漆酶酶活
为了提高图1中A5菌株生产漆酶的效率,本研究采用ARTP对A5菌株进行了诱变。在处理后获得了比原始菌株显色圈较大的5株突变菌,分别命名为P1-P5。
随后,通过进一步发酵验证,有4株菌(P2-P5)的漆酶酶活比对照A5菌(123.4 U/L)更高,而P1菌株的漆酶酶活低于A5菌(图3)。P3菌株产酶时间比A5菌株提前1 d,且产酶速率较快,在第9 d时酶活达到最高值213.1 U/L。P4菌株在发酵前期产酶速率较慢,第8 d后产酶速率显著提高,在15 d时漆酶酶活达到最高值230.1 U/L。

注:A5:野生菌株;(P1,P2,P3,P4,P5):突变菌株
通过对图3中的P3和P4菌株的遗传稳定性进行分析,P3菌株及其子代S3具有基本一致的发酵产酶曲线,在发酵第9 d时,漆酶酶活分别达到213.2 U/L和214.1 U/L(图4);P4菌株在培养第15 d时漆酶酶活达到峰值(230.1 U/L),而P4菌株的子代S4在培养第9 d时漆酶酶活达到峰值(228.5 U/L),对S4继续传代培养后,遗传稳定,因此选择S4菌株用于进一步研究。

图4 不同突变株的发酵产漆酶曲线图
2.3 培养基优化提升T.sanguinea WTFS4的漆酶酶活
2.3.1 碳氮源种类的优化
首先以0.24 mmol/L的酒石酸铵为氮源进行碳源(10 g/L)种类的筛选。在使用的碳源中,以葡萄糖为碳源时,漆酶酶活达到了755 U/L(图5a)。当以纤维二糖、麦芽糖、麸皮水和番茄汁为碳源时,漆酶酶活分别为202.9 U/L、265.5 U/L、302.1 U/L和442.9 U/L。随后在10 g/L葡萄糖的基础上对氮源进行优化,当以豆粕为氮源时,漆酶酶活较高,达到了14 030 U/L(图5b);而以酒石酸铵、蛋白胨、酵母提取物和玉米粉为氮源时,漆酶酶活均较低,分别为2 230 U/L、4 408 U/L、7 625 U/L和9 361 U/L。

注:a)碳源种类对发酵的影响;b)氮源种类对发酵的影响;c)葡萄糖浓度对发酵的影响;d)豆粕粉浓度对发酵的影响;e)2,5-二甲基苯胺对发酵的影响;f)铜离子浓度对发酵的影响
2.3.2 葡萄糖、豆粕粉、铜离子和2,5-二甲基苯胺浓度的优化
首先以10 g/L的豆粕粉为氮源对葡萄糖进行了优化,结果如图5c所示,当葡萄糖浓度为30 g/L时,漆酶酶活较高,达到了14 950 U/L。随后以10 g/L的葡萄糖为碳源对豆粕粉的浓度进行了优化。当豆粕粉浓度为30 g/L时,漆酶酶活较高,达到了16 250 U/L(图5d)。在确定好葡萄糖(30 g/L)和豆粕粉(30 g/L)的浓度后,分别对铜离子和2,5-二甲基苯胺的浓度进行了优化。结果如图5e和5f所示,当铜离子浓度为5 mmol/L时,漆酶酶活较高,达到了23 900 U/L;当2,5-二甲基苯胺浓度为20 μmol/L时,漆酶酶活较高,达到了27 000 U/L。
2.3.3 四因素三水平正交实验优化培养基
基于上述单因素实验得到的包含产漆酶峰值的各因素浓度范围(表1)进行了正交实验。
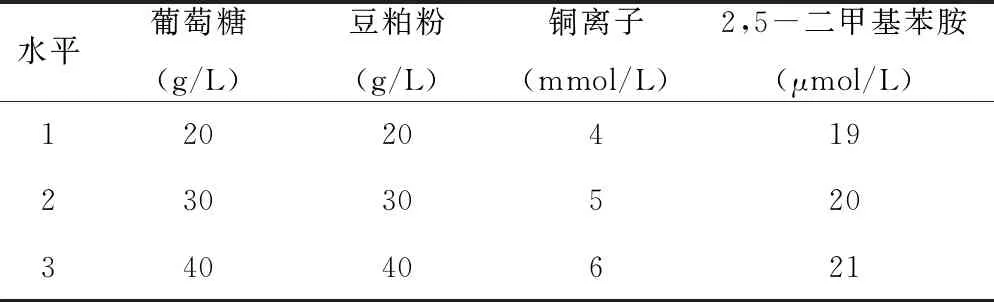
表1 营养条件参数正交试验表
由表2可知,四个因素对S4菌株产漆酶的影响程度依次是2,5-二甲基苯胺、葡萄糖、豆粕粉、铜离子。所有因素均不是显著性影响因子,在选取的范围内对漆酶的酶活影响均较小。实验最佳组合为葡萄糖40 g/L、豆粕粉20 g/L、铜离子6 mmol/L、2,5-二甲基苯胺20 μmol/L。

表2 正交试验结果
在最优培养基的条件下进行发酵实验,结果显示A5菌株在160 h时漆酶酶活达到峰值,为28 000 U/L;S4菌株在120 h时的漆酶酶活达到峰值,为40 000 U/L(图6)。

图6 A5和S4菌株在预测培养基中的发酵曲线图
2.4 漆酶的分离纯化及其酶学性质分析
2.4.1 漆酶的分离纯化和质谱鉴定
通过对发酵液样品进行活性电泳后,采用愈创木酚对凝胶进行染色,结果如图7所示,染色后的凝胶中呈现出单一漆酶条带。通过对图7中的蛋白条带进行质谱分析,结果显示该蛋白与来自Trametessanguinea的漆酶(ACZ37081.1)有18.1%的序列覆盖率,具有较高的同源性(表3)。随后,对该漆酶蛋白条带进行了纯化,并将纯化后的漆酶进行SDS-PAGE分析,结果显示出了单一蛋白条带,大小接近60 kD(图8)。

注:M:marker;泳道1:A5菌株发酵液样品;泳道2:S4菌株发酵液样品

注:M:marker;泳道1:发酵液;泳道2:纯化后的漆酶
2.4.2 漆酶的酶学性质分析
在获得纯的漆酶后,首先对漆酶的最适pH和最适温度进行了研究。结果如图9所示,漆酶酶活在pH2.0~6.0的范围内随着pH值的升高先增加后降低,当pH为3.0时,漆酶酶活最高;当pH高于6.0时,漆酶基本失去活性。漆酶酶活随着温度的升高先增加后降低,当温度为25 ℃时,漆酶酶活最高,且在25~35 ℃的范围内酶活变化不大(图10)。将漆酶在pH2.0~6.0范围内孵育5 h后,仍可保持95%以上的活性;在25 ℃下孵育6 h或30 ℃下孵育4 h或35 ℃下孵育2 h均可以保持95%的酶活性。通过对酶动力学参数的测定,该漆酶的Km和Kcat分别为(58.76 ±5.33) μmol/L和(13.89±0.01) s-1(表3)。

图9 漆酶在不同pH下的相对酶活

表3 以ABTS为底物的漆酶动力学参数
3 讨 论
在工业生产和科学研究中,诱变是一种提高菌株特性的有力工具[18]。对于尚未揭露漆酶调控途径的白腐菌,诱变育种可以在一定程度上提高漆酶酶活。在已往的报道中,紫外照射法是诱变白腐菌产漆酶的最常用方法。但是仅以紫外诱变得到的菌株,其漆酶提升能力有限。相较于单一诱变方法,复合诱变可以在更高程度上改善菌株特性。陈威以紫外-甲基磺酸乙酯复合诱变Pleurotusostreatus孢子,使漆酶酶活提升了126%[19]。刘晓丹等利用紫外线和硫酸二乙酯对Ganodermaapplanatum进行诱变,不仅将漆酶酶活提高了63.3%,还将发酵时间缩短了1 d[20]。本研究首次以血红栓菌孢子为诱变材料,通过ARTP诱变处理,使得漆酶酶活提升了87%,同时发酵时间缩短1 d。ARTP产生的等离子体中含有大量活性粒子,可以对DNA产生较大损伤,因此使得ARTP诱变法具有比紫外辐射和化学诱变剂更高的突变率。今后可以以突变株孢子为基础进行复合叠加诱变,以进一步提高漆酶酶活和缩短发酵时间。
不同菌株的营养需求不同,因此在发酵产漆酶时的最佳培养基成分也有所不同。在已有的报道中,葡萄糖是漆酶生产菌株(如Cerrenaunicolor和Marasmielluspalmivorus等)的最佳碳源。其他碳源,如纤维二糖、番茄汁、麸皮水和麦芽糖也分别是Trametespubescens、P.sanguineus、Trametesmodesta和Cynodondactylon菌株的最佳碳源。在本研究中,通过对不同碳源的筛选,葡萄糖可被血红栓菌直接利用,是其产漆酶的最佳碳源。而以纤维二糖、番茄汁、麸皮水和麦芽糖为碳源时,酶活均较低。在对氮源进行优化时,本实验采取了白腐菌产漆酶常用氮源如酵母提取物、蛋白胨、酒石酸铵、玉米粉和豆粕粉。从血红栓菌的发酵结果来看,以豆粕粉为氮源时,漆酶酶活最高。这是由于豆粕粉中含有大量蛋白质和少量天然芳香族化合物,大豆蛋白可为菌体提供良好的氮源,而芳香化合物可以作为天然诱导剂在菌株生长前期对血红栓菌进行诱导产漆酶[21]。在培养基中添加铜离子对于血红栓菌产漆酶也有一定的促进作用,这是因为铜离子和芳香族诱导剂都可以从转录水平增强真菌漆酶的表达[22]。A5菌株在优化后的培养基中漆酶酶活为24 650 U/L,与其在未优化的培养基中最高漆酶酶活123.2 U/L相比,提升了200倍。S4菌株在优化后的培养基中漆酶酶活为40 000 U/L,与其在未优化的培养基中最高漆酶酶活228.5 U/L相比,提升了175倍。与此同时,S4菌株的发酵时间进一步缩短了40 h,最终发酵时间为120 h。今后的工作应该以复合碳氮源进行优化,从而进一步提升血红栓菌的漆酶酶活,与此同时进行中试培养条件的优化,为进一步放大生产奠定理论基础。
4 结 论
我们分离并鉴定了一株产漆酶的白腐真菌T.sanguineaWTFA5。随后,首次通过对该菌株进行ARTP诱变并获得了具有遗传稳定性的S4菌株,该菌株产酶时间比原始菌提前了1 d并且酶活提高了1.87倍。随后通过培养基优化,获得最优培养基配方为:葡萄糖40 g/L、豆粕粉20 g/L、铜离子6 mmol/L、2,5-二甲基苯胺20 μmol/L。S4菌株在最优培养基中产酶效率进一步提高,发酵5 d时漆酶酶活达到40 000 U/L,比已报道最早的血红栓菌产漆酶时间提前1 d。在相同培养条件下,S4菌株最高漆酶酶活比A5菌株最高漆酶酶活(28 000 U/L)提高1.43倍。以A5在160 h达到酶活峰值的时间为标准,S4菌株在发酵88 h时即可达到。最后,通过Native-PAGE对漆酶进行了纯化和酶学性质分析,该漆酶为酸性漆酶,在酸性环境下具有较高酶活力,但在碱性环境下没有活性。
