五味子乙素对CCl4 诱导的肝损伤大鼠NF-κB/COX-2 的影响
2021-06-22孙惠萍张小芳
孙惠萍 王 剑 张小芳
肝纤维化损伤是各种新陈代谢、病毒和毒性刺激引起的肝脏急性或慢性损伤,最终会导致肝硬化和各种并发症,如门脉高压、肝衰竭和肝细胞癌等[1]。目前肝纤维化损伤发生发展机制尚不明确。核因子κB(nuclear factor kappa-B,NF-κB)是一种转录因子,控制参与多种生物过程,抑制NF-κB 信号通路可改善肝纤维化损伤[2-3]。在NF-κB 靶基因中,环氧合酶-2(Cyclooxygenase-2,COX-2)可促进包括肝细胞癌和肝纤维化在内的炎性疾病发生[4-5]。因此,抑制NF-κB 和COX-2 可能是肝损伤的潜在治疗策略。五味子乙素是五味子的主要活性成分,具有抗氧化、抗炎、抗肿瘤和保肝等多种药理活性[6-7]。研究表明,五味子乙素通过多种调节机制减轻四氯化碳(carbon tetrachloride,CCl4)诱导的肝损伤[1]。本研究探讨五味子乙素对CCl4诱导大鼠肝损伤的保护作用及其可能机制。
1 实验材料
1.1动物 雄性SPF 级Wistar 大鼠18 只,体质量(180±20)g,购自北京维通利华有限公司,动物合格证号:201907005,许可证号:SYXK(浙)2018-0017。本实验通过浙江省温州市温州医科大学伦理委员会审核,伦理审批号:WYDW2019-0232。所有大鼠在恒定温度(18~25℃)、湿度(40%~70%)和12h明/12h 暗循环的环境中,自由饮水和进食,饲养1周以适应环境。
1.2细胞 人肝癌HepG2 细胞系(批号HB-8065)购于美国模式培养物保存中心(ATCC)。
1.3主要试剂及仪器 Dulbecco 改良Eagle 培养基(DMEM)和胎牛血清(FBS,批号61870044)购自美国Gibco 公司。1,1-二苯基-2-三硝基苯肼(DPPH,批号257621) 购自Sigma 公司,五味子乙素(批号1910028)购自成都瑞芬思生物科技有限公司,CCl4(批号40006861)和橄榄油(批号69018028)购自国药集团化学试剂有限公司。NF-κB(批号sc-8008)、COX-2(批号sc-376861)和β 肌动蛋白(β-actin,批号sc-8432)购自美国Santa Cruz 公司,辣根过氧化物酶(HRP)标记的抗鼠二抗(批号#7076)购自美国Cell Signaling 公司。苏木精-伊红(HE,批号20190517)试剂盒购自北京博奥森生物科技有限公司)。细胞计数-8(CCK-8)试剂盒(批号20190414)、BCA 蛋白质分析试剂盒(批号20190405)、增强型ECL 化学发光试剂(批号20190528)、碱性磷酸酶(ALP,批号20190115)、丙氨酸氨基转移酶(ALT,批号20190517)、天门冬氨酸氨基转移酶(AST,批号20190606)试剂盒购自南京建成生物工程研究所。倒置光学显微镜(型号:AI09)购自日本奥林巴斯公司。酶标仪(Multiskan MS 型) 购自美国Thermo Scientific 公司,紫外可见分光光度计(UV-2800)购自上海舜宇恒平科学仪器有限公司。
2 实验方法
2.1细胞培养及细胞活力测定 人肝癌HepG2 细胞系在含有10% FBS 的DMEM 中培养,置于37℃的5%CO2环境下。使用CCK-8 测定法来测量HepG2 细胞活力,将细胞以每孔5×103个细胞接种在96 孔板中,并将细胞暴露于不同浓度(0、5、10、20、40 和80μM)五味子乙素24h。然后,将细胞与10μL CCK-8 在37℃下再孵育1h。使用酶标仪在450nm 下测量。
2.2五味子乙素的抗氧化活性 采用DPPH 自由基清除活性测量五味子乙素的抗氧化活性。采用文献[8]方法测定五味子乙素对DPPH 自由基的清除作用,称取DPPH 10mg,95%乙醇配制成0.2mmol/L 溶液备用。五味子乙素配制不同浓度(50、100、150 和200μM) 样品溶液备用。50μL 样品溶液和50μL DPPH 溶液加到96 孔板中,在避光处静置30min,UV-VIS 分光光度计于517nm 处测定其吸光值(Ai)。同一条件下,乙醇+样品溶液的吸光度为Aj,DPPH溶液+乙醇的吸光度为A0。DPPH 自由基清除率(%)=[1-(Ai-Aj)/A0]×100%,实验重复3 次。
2.3动物分组及给药 18 只大鼠根据随机数字表法分为对照组、模型组和五味子乙素组,每组6 只。模型组和五味子乙素组大鼠每周3 次腹腔注射溶于橄榄油(20%,2mL/kg)的CCl4处理,持续8 周以诱导肝损伤。8 周后五味子乙素组每天予50mg/kg 五味子乙素灌胃,对照组和模型组每天给予等体积0.9%氯化钠溶液,持续4 周。末次处理后,颈脱位处死,收集大鼠肝脏和血清样品用于生化和分子分析。
2.4组织学分析及肝功能指标检测 将肝组织在10%甲醛中固定,石蜡包埋切片(厚度3μm),并将其安装在载玻片上。将切片用HE 染色,通过倒置光学显微镜成像。使用比色法检测大鼠血清AST、ALT 和ALP 含量。
2.5蛋白质印迹 根据制造商的说明,使用裂解缓冲液试剂盒从肝脏组织和HepG2 细胞中制备总蛋白,并使用BCA 蛋白测定试剂盒测定蛋白浓度。在SDS-PAGE 凝胶上分离总蛋白,电转移到聚偏二氟乙烯(PVDF)膜上,5%脱脂牛奶封闭1h。将膜与一抗在4℃孵育过夜,一抗包括NF-κB、COX-2 和βactin(1∶1000),TBST 溶液洗膜3 次,加入抗鼠二抗在室温下孵育1h,使用ECL 试剂进行显像,条带灰度值通过Image J 软件进行分析,β-actin 为内参。
2.6统计学方法 应用SPSS 20.0 进行数据统计分析,实验数据以均数±标准差(±s),采用单因素方差分析(ANOVA)和LSD 事后检验确定组间差异,以P<0.05 为差异有统计学意义。
3 结果
3.1不同浓度五味子乙素的抗氧化活性 五味子乙素的抗氧化活性随浓度增加而增强(P<0.05),见表1。
表1 不同浓度五味子乙素的抗氧化活性(%,±s)
注:DPPH 为1,1-二苯基-2-三硝基苯肼;与50μM 组比较,aP<0.05;与100μM 组比较,bP<0.05;与150μM 组比较,cP<0.05
3.2不同浓度五味子乙素抑制HepG2 细胞活力五味子乙素(40 和80μM)处理可降低HepG2 细胞活力,且呈剂量依赖性(P<0.05)。见表2。
表2 不同浓度五味子乙素对HepG2 细胞活力影响(%,±s)

表2 不同浓度五味子乙素对HepG2 细胞活力影响(%,±s)
注:与0μM 组比较,aP<0.05;与40μM 组比较,bP<0.05
3.3三组大鼠体质量、肝脏重量和肝指数比较 与对照组比较,模型组大鼠体质量降低,肝脏重量和肝指数显著升高(P 均<0.05)。与模型组比较,五味子乙素组大鼠体质量升高,肝脏重量和肝指数降低(P均<0.05)。见表3。
表3 三组大鼠体质量、肝脏重量和肝指数比较(±s)

表3 三组大鼠体质量、肝脏重量和肝指数比较(±s)
注:对照组为健康大鼠,予生理盐水;模型组为肝损伤模型大鼠,予生理盐水;五味子乙素组为肝损伤模型大鼠,予50mg/kg 五味子乙素灌胃;与对照组比较,aP<0.05;与模型组比较,bP<0.05
3.4三组大鼠肝组织肝功能比较 对照组大鼠肝细胞具有正常结构,没有明显炎症迹象,在模型组中观察到炎性细胞浸润,提示五味子乙素处理可明显减轻CCl4引起的损害(见图1)。与对照组比较,模型组大鼠血清ALP、ALT、AST 水平均升高(P 均<0.05)。与模型组比较,五味子乙素组血清ALP、ALT、AST 水平降低(P 均<0.05),见表4。
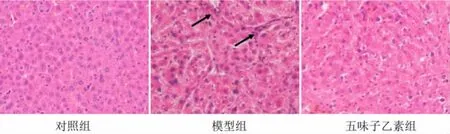
图1 三组大鼠肝组织病理切片(苏木精-伊红染色×100)
表4 三组大鼠血清ALT、AST 和ALP 水平比较(U/L,±s)
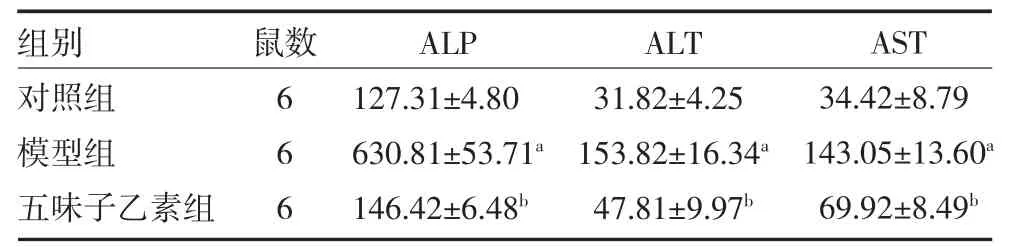
表4 三组大鼠血清ALT、AST 和ALP 水平比较(U/L,±s)
注:对照组为健康大鼠,予生理盐水;模型组为肝损伤模型大鼠,予生理盐水;五味子乙素组为肝损伤模型大鼠,予50mg/kg 五味子乙素灌胃;ALP 为血清碱性磷酸酶;ALT 为丙氨酸氨基转移酶;AST 为天冬氨酸氨基转移酶;与对照组比较,aP<0.05;与模型组比较,bP<0.05
3.5各组体外和体内NF-κB 和COX-2 蛋白表达水平比较 体外实验中,20、40μM 五味子乙素显著降低细胞NF-κB 和COX-2 的蛋白表达(见图2A、表5,P<0.05)。体内实验中,与对照组比较,模型组大鼠肝组织NF-κB 和COX-2 蛋白表达增强(P<0.05)。与模型组比较,五味子乙素组NF-κB、COX-2 蛋白表达减弱(P<0.05),见图2B、表6。

图2 各组体外和体内NF-κB 和COX-2 的蛋白表达
表5 不同浓度五味子乙素对外HepG2 细胞NF-κB和COX-2 蛋白表达的影响(±s)
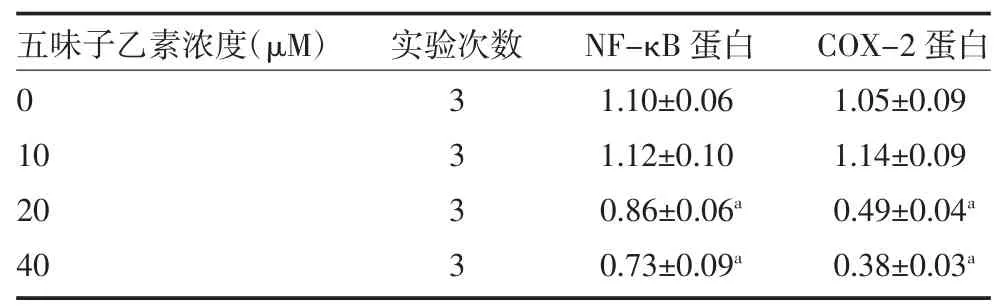
表5 不同浓度五味子乙素对外HepG2 细胞NF-κB和COX-2 蛋白表达的影响(±s)
注:NF-κB 为胞核因子-κB;COX-2 为环氧化酶-2;与0μM 组比较,aP<0.05
表6 三组大鼠肝组织NF-κB 和COX-2 蛋白表达水平比较(±s)
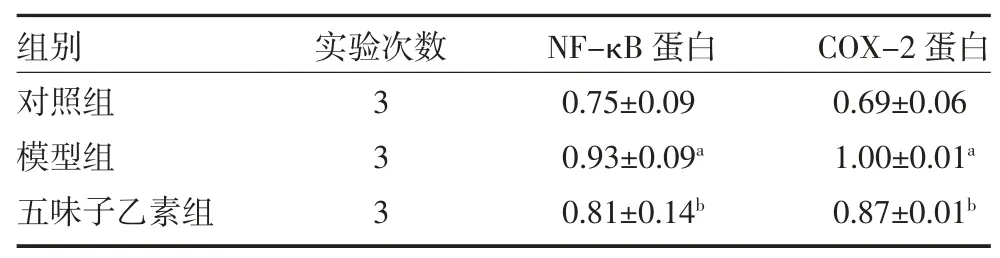
表6 三组大鼠肝组织NF-κB 和COX-2 蛋白表达水平比较(±s)
注:对照组为健康大鼠,予生理盐水;模型组为肝损伤模型大鼠,予生理盐水;五味子乙素组为肝损伤模型大鼠,予50mg/kg 五味子乙素灌胃;NF-κB 为核因子-κB;COX-2 为环氧化酶-2;与对照组比较,aP<0.05;与模型组比较,bP<0.05
4 讨论
炎症是免疫系统针对各种有害刺激(如病原体、毒素、辐射和创伤、有毒化学物质、矿物质和抗原)的自然保护机制[9]。但是,持续性急性炎症可能会导致心血管、肝脏、代谢类疾病和癌症[10]。本研究表明,在CCl4诱导的肝损伤模型中,使用五味子乙素可降低肝癌HepG2 细胞活力、炎性介质NF-κB 和COX-2的表达以及血清ALT、AST 和ALP 的水平,同样,形态学检查证实,五味子乙素处理可减少模型组炎症细胞浸润并改善肝损伤。这些结果表明,五味子乙素可以有效保护肝脏免受CCl4毒性的影响,其机制可能与其对炎症通路NF-κB/COX-2 的抑制作用有关。
肝炎、肝硬化、脂肪肝、肝癌等肝病的发生发展与自由基密切相关[8]。本研究通过使用DPPH 自由基清除活性来证实五味子乙素的体外抗氧化功效。CCl4因在动物和人类中表现出相似的病理变化,已被用作建立肝损伤实验模型[3,11]。研究表明,使用CCl4会增加炎症细胞因子,破坏免疫系统和淋巴器官,从而导致慢性炎症性肝纤维化[3]。此外,本研究中CCl4增加了血清ALP、AST 和ALT 水平,反映肝损伤的程度[12-13]。而五味子乙素治疗降低了这些酶的水平,表明五味子乙素可减轻CCl4诱导的肝损伤并改善肝功能。
NF-κB 在肝脏中产生促炎性细胞因子,并调控免疫应答,继而引起肝病,是炎症的主要调节剂[3]。CCl4诱导肝损伤大鼠肝组织NF-κB 及IκBα 蛋白表达[12],而五味子乙素处理可显著抑制CCl4诱导的NF-κB 活化。抑制NF-κB 诱导的促炎因子如肿瘤坏死因子-α(TNF-α)、白介素-6(IL-6)、前列腺素E2(PGE2)及诱导型一氧化氮合酶(iNOS)、COX-2 和基质金属肽酶的活化,可以改善肝功能。因此,阻断NF-κB/COX-2 途径的激活可以阻止炎症介质在肝脏疾病中的募集。此外,本研究中五味子乙素降低了CCl4诱导的COX-2 活化,从而减少炎症,坏死和纤维化。研究表明,五味子乙素能抑制NF-κB 活化及炎性细胞因子(TNF-α、IL-1β 和IL-6)来对抗炎症损伤[14],且对巨噬细胞中脂多糖诱导的炎症具有保护作用,主要通过抑制一氧化氮和PGE2 的产生及NF-κB 通路表达[15]。
综上所述,体外实验五味子乙素可降低体外肝癌细胞活力以及炎性介质NF-κB 和COX-2 表达,在体内,五味子乙素降低CCl4诱导的肝损伤大鼠血清ALT、AST 和ALP 水平及炎性介质NF-κB 和COX-2 表达,减少炎症细胞浸润,改善肝损伤,表明五味子乙素可能通过抑制NF-κB/COX-2 信号传导途径减轻炎症,从而减轻肝损伤发展。
