新型羊水细胞原位培养技术在产前诊断中的应用
2021-06-21郝娜田晓彤李萌萌常家祯周京戚庆炜蒋宇林周希亚刘俊涛
郝娜,田晓彤,李萌萌,常家祯,周京,戚庆炜,蒋宇林,周希亚*,刘俊涛
(1.中国医学科学院 北京协和医学院 北京协和医院妇产科,国家妇产疾病临床研究中心,北京 100730;2.中国医学科学院 北京协和医学院 北京协和医院 疑难重症及罕见病国家重点实验室,北京 100730)
羊水细胞染色体核型分析是产前诊断的核心项目[1]。北京协和医院产科遗传实验室从2000年开始使用原位法收获羊水细胞,沿用至今。原位法培养材料种类较多,除常规的细胞培养瓶之外[2],还使用过盖玻片培养皿、腔式载玻片培养盒、盒式载玻片培养盒、载玻片培养瓶等。2018年开始,本实验室采用新型(卡扣式)载玻片培养盒,并同时应用常规塑料培养瓶进行双线平行培养,分别行新型(卡扣式)载玻片培养盒原位法(以下简称载玻片原位法)收获和常规塑料培养瓶消化法(以下简称培养瓶消化法)收获,即载玻片原位法、培养瓶消化法同时对羊水细胞培养收获制片。2019年,采用两种方法对1 568例样本进行培养,比较培养成功率和有效的染色体核型数目,现总结分析如下。
资料和方法
一、研究对象
收集2019年1~12月在北京协和医院进行产前诊断的1 568例孕妇的羊水样本。产前诊断的指征包括高龄妊娠、血清学唐氏筛查高风险、无创产前检测(Noninvasive prenatal test,NIPT)高风险、胎儿超声异常及不良孕产史等。
二、仪器与试剂
1.仪器:离心机,恒温水浴箱,二氧化碳培养箱,烤箱,GSL120全自动扫片系统、Cytovision染色体核型分析系统(徕卡,德国)。
2.试剂与耗材:胰酶、D-hanks溶液、新型(卡扣式)载玻片培养盒(上海乐辰生物),羊水培养基(CHANG,美国),秋水仙素(上海沃凯),氯化钾、枸橼酸钠、冰乙酸(北京国药),Trypsin-EDTA(Gibco,美国),Giemsa染液(Sigma,美国),常规塑料培养瓶(Corning,美国)。其他试剂均为国产分析纯。
三、研究方法
1.标本采集:孕16~22+6周时,在B超引导下行经腹羊膜腔穿刺术,将15~20 ml羊水分别置于2个15 ml无菌离心管中,运送至实验室。
2.接种:羊水两管,平衡离心2 000 rpm×10 min,各管吸掉部分上清后留取1 ml混悬细胞,一管细胞加入2 ml羊水培养基,吹打混匀后直接接种在卡扣式载玻片培养盒;另一管细胞加入4 ml相同羊水培养基,吹打混匀后接种至塑料培养瓶内。置于37℃、5% CO2培养箱中培养。
3.换液:培养5~7 d后,倒置显微镜下观察细胞生长情况,细胞集落>5个/瓶,镜下可见透亮细胞较多时,倒出原培养液,转移至另一塑料培养瓶继续培养备用。在原卡扣式载玻片培养盒及塑料培养瓶中分别加入新鲜培养液4 ml,并于次日进行收获处理。
4.收获:(1)载玻片原位法收获:每盒加入秋水仙素工作液100 μl(终浓度为0.25 μg/ml),37℃培养箱孵育,45 min后吸掉培养液,加入预温的5 ml低渗液(0.2%氯化钾+0.2%枸橼酸钠),37℃培养箱低渗。25 min后加入1 ml 固定液(甲醇:冰乙酸按3∶1体积比配制),室温固定5 min。清除培养盒内液体,加入固定液4 ml,室温固定15 min。重复一次固定步骤,打开塑料卡扣,将载玻片从塑料方框上分拆下来,置烤片机上烤干后收入玻片架,80℃烤片3 h。(2)培养瓶消化法收获:在培养瓶中加入秋水仙素工作液100 μl(终浓度为0.25 μg/ml),置于37℃水浴箱中孵育15 min。将羊水上清液倒入离心管中,并在培养瓶中加入3 ml 0.05% Trypsin-EDTA,置于37℃水浴箱中孵育15 min。培养液终止消化,用吸管用力吹打细胞面,倒入离心管中,2 000 rpm离心5~10 min;弃上清,加入5 ml低渗液,吹打混匀后置入37℃水浴箱中孵育15 min;加入1 ml固定液,轻轻混匀,静置5 min,2 000 rpm离心10 min;弃上清,加入5 ml固定液,轻轻混匀,室温下作用15 min;2 000 rpm离心10 min后弃上清液。重复上述步骤,15 min后离心弃上清,依据细胞沉淀量调配悬液,在玻片上滴加2~3滴悬液,尽量保证悬液平铺在载玻片上。置烤片机上烤干后收入玻片架,80℃烤片3 h。
5.阅片分析:以人类细胞遗传学国际命名体制(ISCN 2016)G显带400条带水平为标准分析染色体核型,使用Cytovision分析系统扫描并采集图像,计数原位收获载玻片中至少5个克隆,分析5个细胞,核型配对2个细胞。计数消化收获载玻片中至少10个细胞,分析5细胞,核型配对2个细胞[3]。
四、统计学分析

结 果
一、一般情况
本研究共纳入1 568例孕妇,年龄19~48岁,平均年龄(34.9±4.5)岁,孕周为16~22+6周,平均孕周(18.6±1.8)周。产前诊断指征见表1。
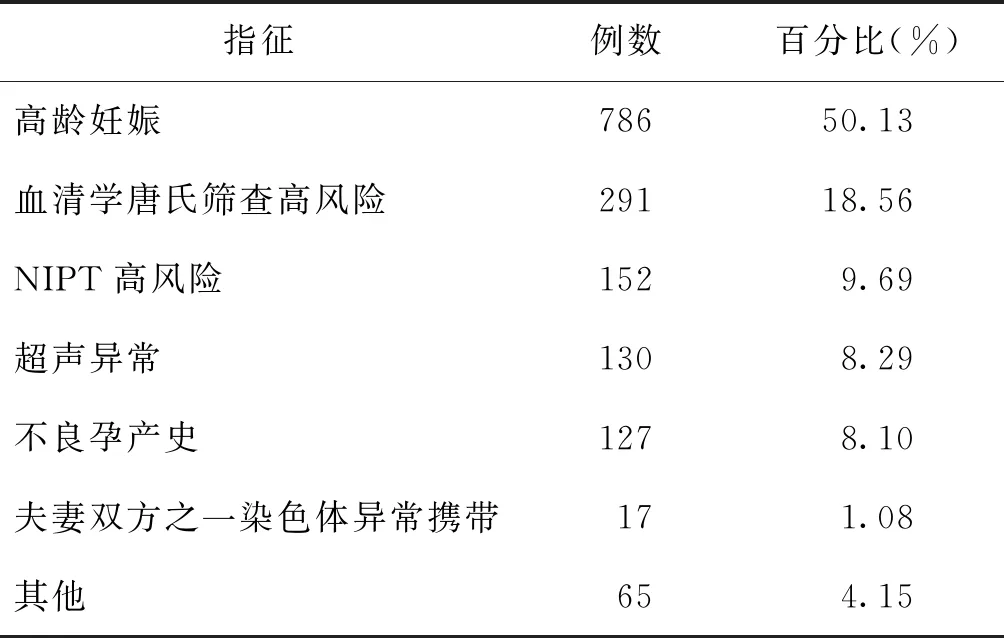
表1 1 568例受检者产前诊断指征
二、不同孕周组别培养结果比较
按不同孕周分组分别统计不同培养方法的成功率和失败率。1 568例羊水样本均为双线培养及制片,其中常规塑料培养瓶培养时有2例细菌污染,培养成功率99.87%(1 566/1 568)。新型(卡扣式)载玻片培养盒培养时有3例细菌污染,同时有2例因卡扣式培养盒密封处理不合格导致漏液,培养成功率99.68%(1 563/1 568)。两种方法的总培养成功率无显著差异(P=0.26)(表2)。

表2 不同孕周羊膜腔穿刺后羊水培养结果比较(%)
三、培养条件及有效核型比较
常规塑料培养瓶法所获得的贴壁细胞集落、可计数核型及可分析核型多于卡扣式培养盒法。但在培养液用量、培养时长、收获操作时间上,卡扣式培养盒法都要优于常规塑料瓶培养法(表3)。

表3 两种培养方法的培养条件及获得有效核型情况比较(-±s)
四、染色体核型分析
1 568例样本中共发现98例异常核型,包括30例结构异常和68例数目异常。数目异常包括29例21三体、12例18三体、2例9号三体嵌合、25例性染色体数目异常;染色体嵌合共8例,1例为结构异常嵌合,其余7例均为数目异常嵌合。
讨 论
近年来,随着分子生物学技术的迅猛发展,新技术不断被引入到临床应用中,产前诊断向更精确、更快速的方向发展,但染色体核型分析依然是产前诊断领域无可替代的重要手段,尤其对于嵌合体、平衡易位、复杂易位、倒位等染色体异常的检出具有重要意义。在我国,羊水细胞培养及染色体核型分析依然是绝大多数产前诊断中心的常规诊断方法。因此,提高细胞培养质量、获得满意的核型以供分析,对确保羊水产前诊断的准确性至关重要。
细胞遗传学领域中多种培养方式及全自动扫片系统、智能分析软件已广泛使用,在缓解技师镜下阅片压力的同时,提高了异常检出率及工作效率。核型分析自动化推动着前期培养及收获流程方法的改进。据文献报道,我国产前诊断实验室大部分均使用消化法进行收获处理,无法区分单细胞来源或多细胞来源[4-6]。少数实验室使用载玻片盒羊水细胞培养法,即原位法收获细胞[7-9],虽可鉴别细胞来源,但在接种环节中需要注意,首次接种要将羊水细胞悬液滴加在载玻片表面,不要溢出,以避免丢失细胞,并需在24 h后追加2~3 ml新鲜培养液。该方法通常采用普通载玻片培养盒,多次操作有增加污染的可能。因此,本研究对新型(卡扣式)载玻片培养盒进行了实验研究。
高质量染色体核型可以提高产前诊断准确率,每一个操作环节都会影响染色体核型质量[10]。本实验室多年来一直采用原位法培养细胞,并不断探索不同培养器皿及方法的成功率、获得核型情况及培养条件。首先,原位培养具有保留细胞克隆性、可追溯羊水中多胚层来源的细胞性质、且对嵌合体诊断具有明显的优势[11]。本研究共发现8例染色体数目或结构嵌合,嵌合比例均从新型(卡扣式)载玻片培养盒的原位培养系统中获得。相对准确的嵌合比例可以给临床诊断提供依据,为产前遗传咨询提供必要的的实验室信息[12]。其次,常规塑料培养瓶与新型(卡扣式)培养盒同步培养羊水细胞,两种培养材料的培养成功率无显著差异。常规塑料培养瓶因培养瓶底部面积大,所获得的贴壁细胞集落、可计数核型及可分析核型多于载玻片原位法。但在培养时间、培养液用量上,载玻片原位法均占优势。载玻片原位法使用的载玻片为玻璃材料,玻璃表面具有天然的正电荷,使细胞更容易贴壁生长。贴附生长细胞的生长过程要经过3个阶段:潜伏期、指数生长期和平台期。羊水细胞培养至6~7 d时已处于指数生长期,大量细胞进入分裂期[13]。本研究选择第5天换液处理,24 h后根据细胞生长状态进行收获制片。细胞收获流程结束打开塑料卡扣,将载玻片从塑料方框上分拆下来,直接将载玻片进行短暂熏蒸。在载玻片固定液蒸发过程中,染色体因吸水而显著膨胀,这是染色体伸长、染色体中期扩散以及高分辨率带纹出现的先决条件[14]。为了得到高质量的染色体核型,培养瓶消化法在滴片前需对玻片清洁并进行熏蒸处理,滴片过程中仔细观察水分蒸发情况并在滴片时转换样本标签。载玻片原位法收获过程中没有滴片步骤,可以减少此类错误的发生;另外,载玻片原位法培养的细胞一般在培养第7天即可收获制片,特殊病例可以在10 d内得到染色体核型结果,相比于培养瓶消化法培养第9天才可进行收获相关操作,缩短了产前诊断报告的发放时间。
产前诊断指征中,对于唐氏筛查高风险及NIPT高风险病例,相关指南规定均需有创操作获取胎儿样本进行产前诊断[15-17]。由于唐氏筛查及NIPT的检测孕周大多在中孕早期,高风险病例获得结果时往往不足18周甚至不足17周。本研究统计了小于孕18周的病例数据,发现两种培养方法的培养成功率及有效核型数目均与孕18~20周组一致。因此对于筛查高风险病例,可以适当提前穿刺时间。而对于超声异常的胎儿,产前诊断中微阵列分析及测序技术逐步被大家认可[18-19],但仍需羊水细胞染色体核型分析除外结构异常[20]。本研究中对胎儿超声异常或不良孕产史的孕妇分别留取10 ml羊水送检微阵列分析,15 ml羊水行染色体核型分析。因此双线培养仅允许分别将6 ml和9 ml羊水的沉淀细胞分别接种于新型(卡扣式)培养盒和常规塑料瓶。在羊水量仅为6 ml的情况下,载玻片原位法的有效核型多于培养瓶消化法,所获得的染色体核型有效解决了对染色体结构的判断。胎儿本身是否存在染色体结构变异对其决定此次妊娠结局及再次妊娠均有指导意义[21]。
本研究7例培养失败的病例中,5例为污染,不除外操作因素及耗材本身消毒问题。载玻片原位法2例漏液的病例原因为新型(卡扣式)培养盒密封问题,经和厂家沟通后再无此种情况发生。
综上所述,新型(卡扣式)载玻片培养法具有操作步骤简单、耗材用量少、羊水需求量小、可相应提前产前诊断时间等优势,对于嵌合体的嵌合比例确定可能具有优势,可以与常规塑料培养瓶培养法结合,提高羊水细胞染色体核型分析的效率。两种方法同时处理羊水细胞,可以及时有效地解决大片段结构异常及确定嵌合体比例,适合临床使用。
