胎膜早破极早产儿的临床特征和主要不良结局的预测因素分析
2021-06-16董会敏宋娟决珍珍位乐乐李文冬周竹叶
董会敏 宋娟 决珍珍 位乐乐 李文冬 周竹叶
(郑州大学第三附属医院新生儿科/河南省小儿脑损伤重点实验室/河南省儿科疾病临床医学研究中心,河南郑州 450052)
胎膜早破 (prelabor rupture of membranes,PROM)被定义为临产前发生的胎膜破裂,其中妊娠37周之前发生的胎膜早破被称为未足月胎膜早破 (preterm prelabor rupture of membranes,PPROM)[1]。研究显示妊娠<37周PPROM的发生率为2%~3%,妊娠<34周PPROM发生率低于1%[1-3]。PPROM主要引起早产儿宫内感染,也是早产儿发生呼吸道或神经系统并发症和死亡的危险因素[4]。既往研究表明,胎龄越小,出生体重越轻,生后72 h内发生早发型败血症(early-onset sepsis,EOS)的风险和病死率越高[5-9]。本研究回顾性分析了PROM极早产儿的临床资料,评估PROM极早产儿的临床特征及其发生EOS和死亡的预测因素,旨在为PROM极早产儿主要不良结局的临床防治提供循证医学依据。
1 资料与方法
1.1 研究对象
收集2018年1月至2020年5月我院新生儿重症监护室收治的PROM且胎龄<32周的早产儿的临床资料,除外疑似先天性染色体或遗传代谢性疾病、出生后因非感染性疾病3 d内放弃治疗和临床资料不完整的患儿,最终共399例患儿纳入研究。根据胎膜破裂至分娩的时间不同分为4组:PROM<18 h(107例)、PROM 18 h~<3 d(111例)、PROM 3 d~<14 d(144例)和PROM≥14 d(37例)。另外根据生后72 h内是否发生EOS分为EOS组(42例)和非EOS组(357例);根据出生后3个月内存活与否分为存活组(359例)和死亡组(40例)。
该研究已获得郑州大学第三附属医院医学伦理委员会批准[(2020)医伦审第38号]及患儿家属的知情同意。
1.2 诊断标准
PPROM的诊断标准参考《最新未足月胎膜早破临床指南解读》[2]。新生儿败血症的诊断标准参考《新生儿败血症诊断及治疗专家共识(2019年版)》[10],确诊诊断需要满足血培养或脑脊液培养中发现致病细菌。临床败血症的诊断要求有临床异常表现的情况下满足下列条件中任何一项:(1)血液非特异性检查≥2项阳性;(2)脑脊液检查呈化脓性脑膜炎改变。根据发生败血症的日龄,生后72 h内发生的为EOS,超过72 h发生的为晚发型败血症(late-onset sepsis,LOS)。
化脓性脑膜炎、新生儿肺炎、Ⅱ~Ⅲ期坏死性小肠结肠炎(necrotizing enterocolitis,NEC)、脑室内出血(intraventricular hemorrhage,IVH)、脑室周围白质软化(periventricular leukomalacia,PVL)、支气管肺发育不良(bronchopulmonary dysplasia,BPD)、早产儿视网膜病变(retinopathy of prematurity,ROP)的诊断均参考第5版《实用新生儿学》[11]。
1.3 资料收集
收集所纳入早产儿的临床资料,包括母孕期一般情况:发生PROM时孕周、PROM时间、羊水情况、胎盘早剥、前置胎盘、妊娠期合并症、胎盘病理检查等;新生儿一般情况:性别、胎龄、出生方式、出生体重、窒息史、宫内窘迫、机械通气史等;以及患儿住院期间并发症/合并症等。
1.4 统计学分析
采用SPSS 21.0统计软件进行分析。正态分布的计量资料用均数±标准差(-x±s)表示,组间比较采用两样本t检验。偏态分布的计量资料以中位数(四分位数间距)[M(P25,P75)]表示,组间比较采用Mann-WhitneyU检验。计数资料用频数及百分率(%)表示,组间比较采用χ2检验、连续性校正χ2检验或Fisher确切概率法。应用多因素logistic回归分析PROM极早产儿发生EOS和死亡的预测因素。P≤0.05为差异有统计学意义。
2 结果
2.1 PROM极早产儿的临床特征分析
共纳入符合入选标准的早产儿399例,其中男224例,女175例;胎龄25~31+6周,平均胎龄(29.8±1.5)周;出生体重700~2 490 g,平均出生体重(1 380±289)g。死亡40例,其中因RDS死亡16例,因肺出血死亡6例,因败血症死亡6例,因重症肺炎死亡1例,因重度窒息死亡2例,因重度IVH死亡2例,因持续性肺动脉高压死亡1例,因预后较差放弃治疗后死亡6例。
399例患儿中,较常见的并发症依次为:新生儿肺炎(126例,31.6%)、新生儿窒息(112例,28.1%)、BPD(73例,18.3%)、Ⅲ~Ⅳ级RDS(56例,14.0%)、血小板减少症(46例,11.5%)、IVH(45例,11.3%)、LOS(44例,11.0%)、EOS(42例,10.5%)、Ⅱ~Ⅲ期NEC(39例,9.8%)、化脓性脑膜炎(14例,3.5%)、ROP(12例,3.0%)和PVL(10例,2.5%)。
PROM<18 h、PROM 18 h~<3 d、PROM 3 d~<14 d及PROM≥14 d 4组间新生儿期各并发症发生率和病死率的比较差异均无统计学意义(P>0.05),见表1。
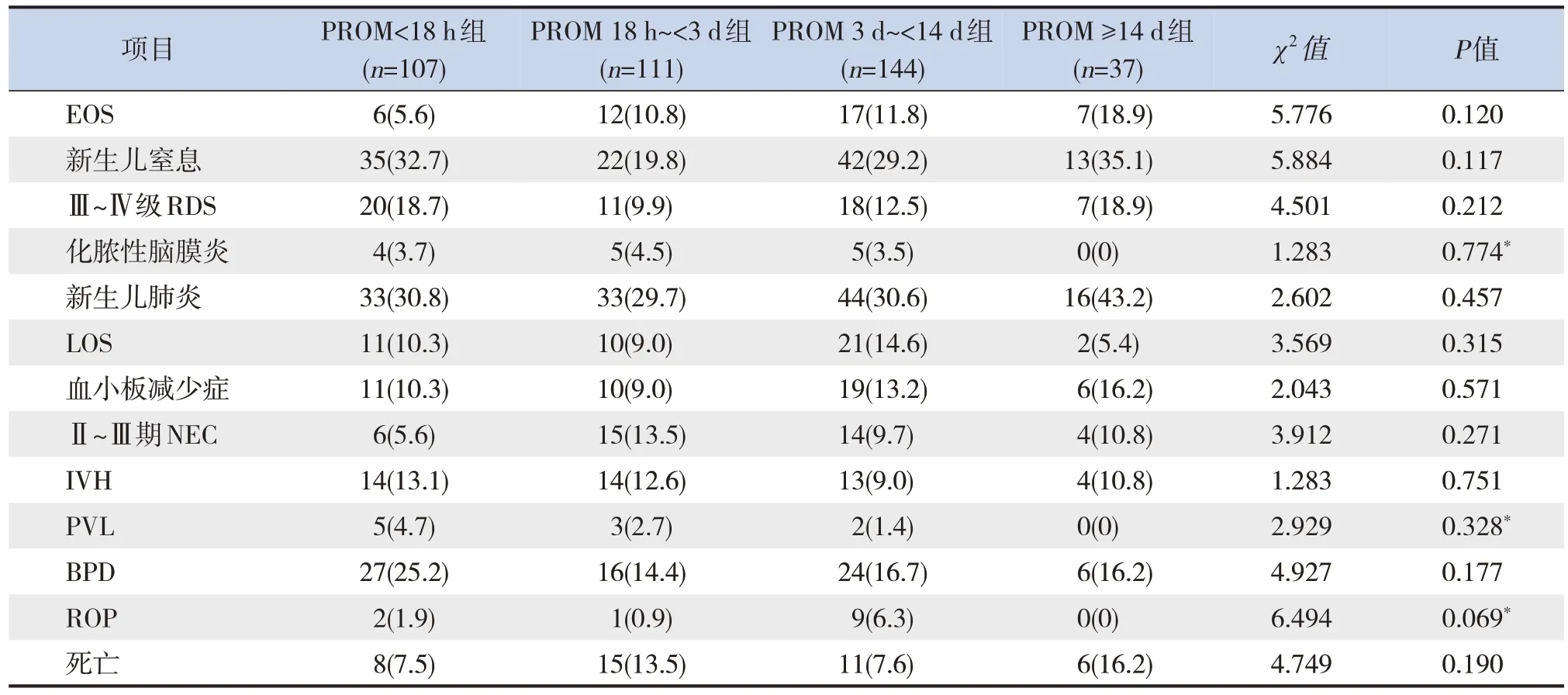
表1 PROM不同时间各组的临床特征比较 [n(%)]
2.2 PROM极早产儿发生EOS的单因素分析
单因素分析显示,与非EOS组相比,EOS组患儿胎龄较小,出生体重较低,Ⅲ度羊水污染比例较高,新生儿窒息和Ⅲ~Ⅳ级RDS的发生率较高,差异均有统计学意义(P<0.05),见表2。
2.3 PROM极早产儿死亡预测因素的单因素分析
单因素分析显示,与存活组患儿相比较,死亡组患儿出生胎龄较小,出生体重较低,新生儿窒息、Ⅲ~Ⅳ级RDS及新生儿败血症的发生率较高,机械通气≥7 d的比例较高,差异均有统计学意义(P<0.05),见表3。
2.4 PROM极早产儿发生EOS的多因素logistic回归分析
将单因素分析中有统计学意义的变量(胎龄、出生体重、Ⅲ度羊水污染、新生儿窒息和Ⅲ~Ⅳ级RDS)进行多因素logistic回归分析,显示出生体重<1 000 g、Ⅲ度羊水污染和Ⅲ~Ⅳ级RDS是PROM极早产儿发生EOS的预测因素 (P<0.05),见表4。
2.5 PROM极早产儿死亡预测因素的多因素logistic回归分析
将单因素分析中有统计学意义的变量(胎龄、出生体重、Ⅲ~Ⅳ级RDS、新生儿窒息、新生儿败血症、机械通气≥7 d)进行多因素logistic回归分析,显示出生体重<1 000 g、出生体重1 000~1 499 g、Ⅲ~Ⅳ级RDS及新生儿败血症是PROM极早产儿死亡的预测因素(P≤0.05),见表5。
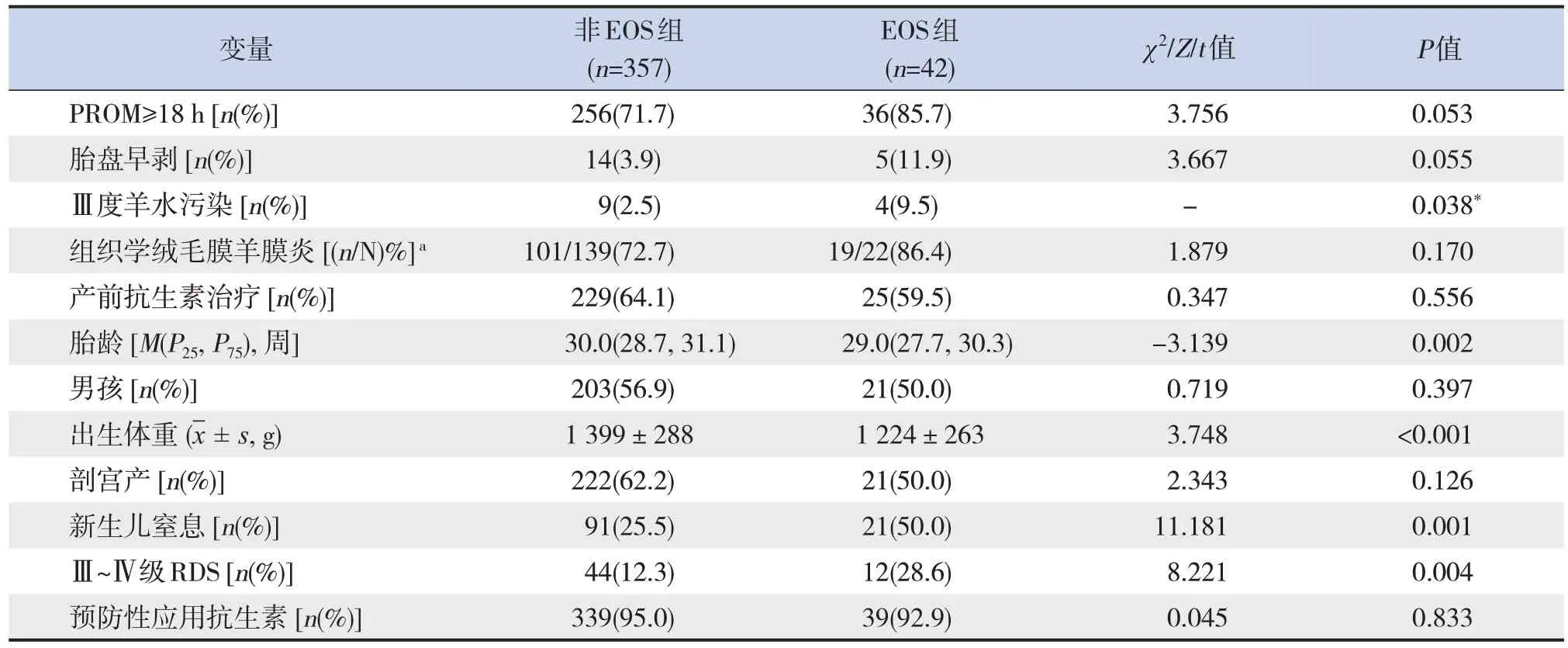
表2 PROM极早产儿发生EOS的单因素分析
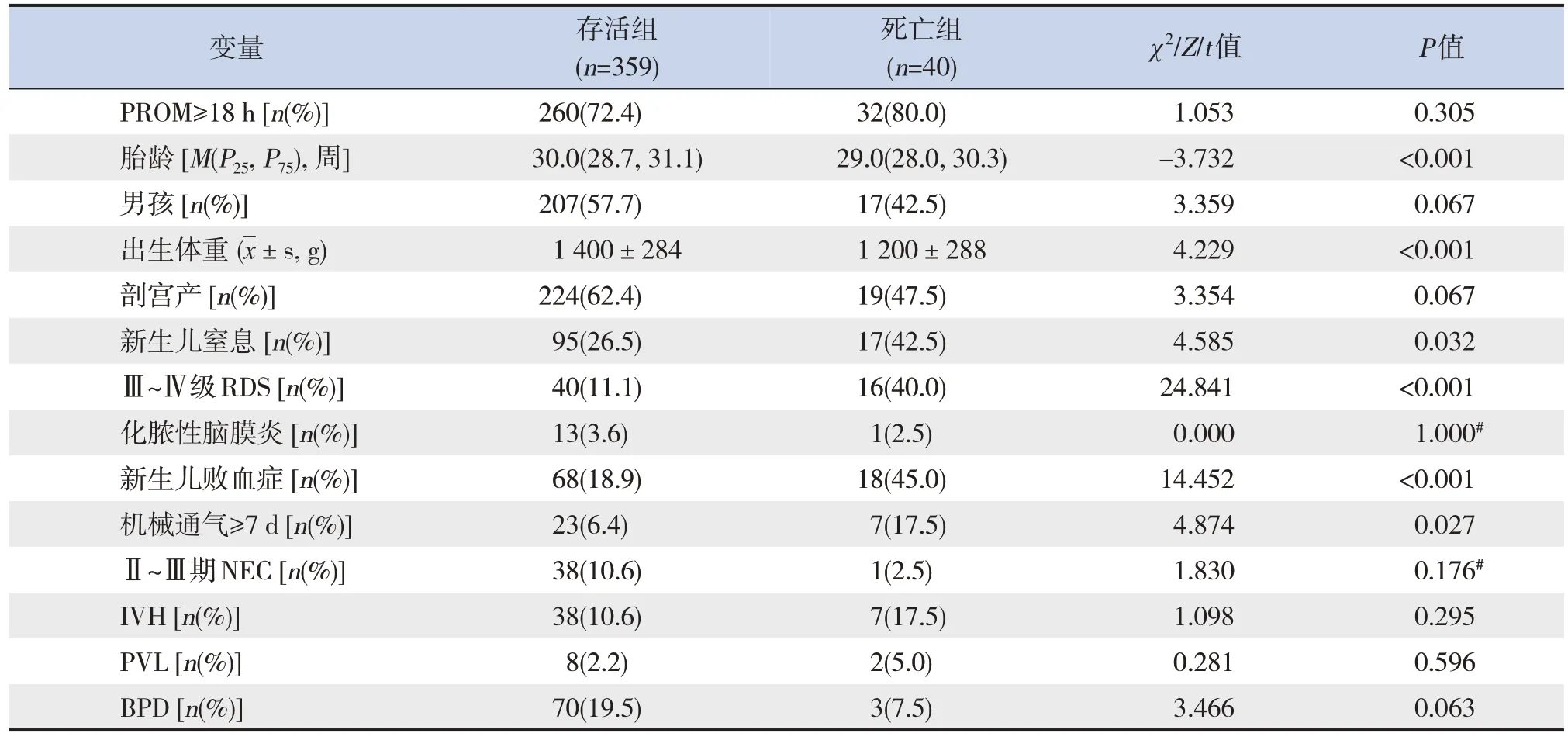
表3 PROM极早产儿死亡预测因素的单因素分析

表4 PROM极早产儿发生EOS的多因素logistic回归分析
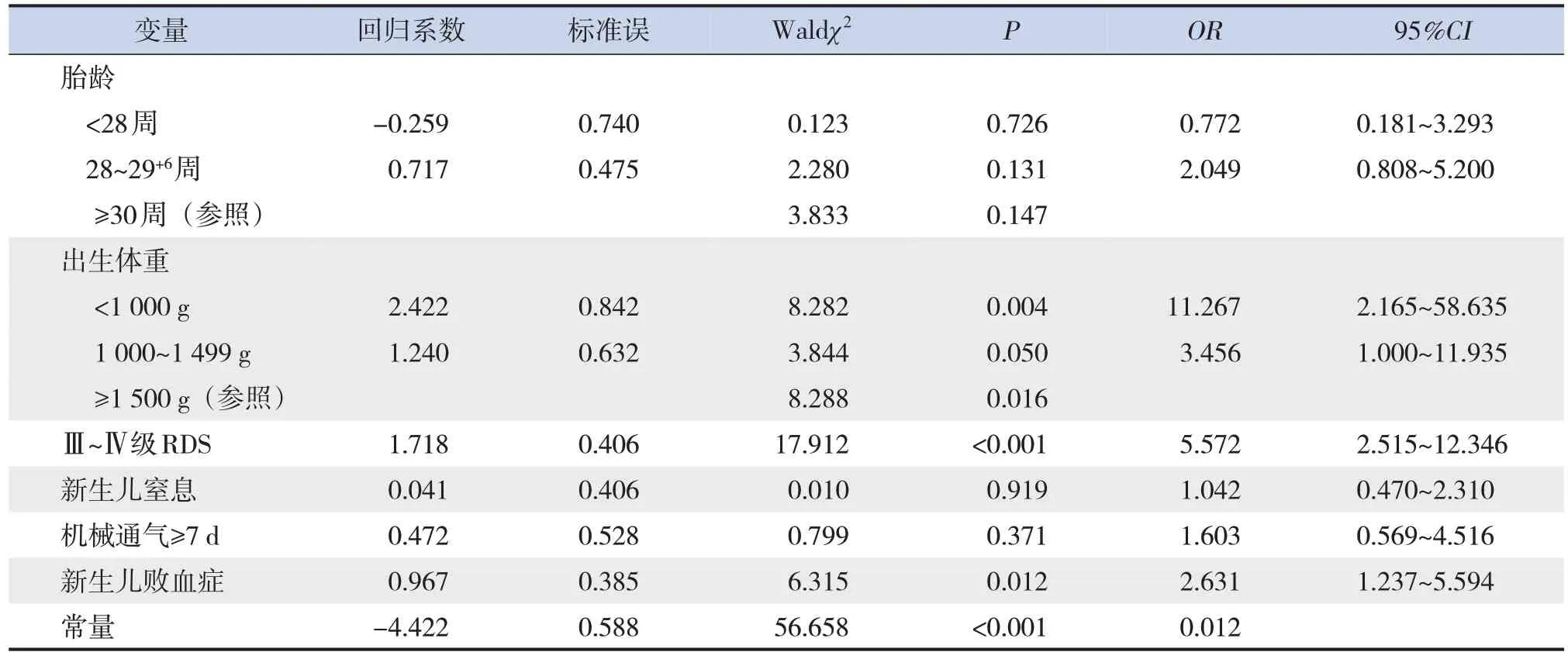
表5 PROM极早产儿死亡预测因素的多因素logistic回归分析
3 讨论
本研究显示,PROM极早产儿中,新生儿肺炎(31.6%)是最常见的并发症,其次是新生儿窒息(28.1%)、BPD(18.3%)、Ⅲ~Ⅳ级RDS(14.0%)、血小板减少症(11.5%)、IVH(11.3%)、LOS(11.0%)、EOS(10.5%)等。吴甜等[12]研究显示,331例PROM早产儿(胎龄<37周)中,肺炎发生率为51.1%,RDS为15.1%,窒息为14.2%,EOS为5.7%,BPD为2.4%。段顺艳等[13]的一项多中心研究显示,在2 889例PROM早产儿中,合并RDS 15.5%,败血症3.4%,BPD 2.9%。与之相比较,本研究中新生儿窒息、BPD及败血症的发生率较高,可能与研究对象纳入标准不同及区域差异有关。Ye等[14]研究显示,323例伴有PROM的24~34周的早产儿中,19.2%(62/323)合并有早产儿败血症,本研究结果与其一致。国外Gezer等[15]对288例PROM早产儿研究发现,在胎龄29~32周的早产儿中,RDS发生率为27.7%,败血症为10.8%,IVH为9.6%,病死率为8.4%;在胎龄≤28周的早产儿中,RDS发生率为75.0%,败血症为33.9%,IVH为26.8%,病死率为53.6%,可见随着胎龄的降低,PROM早产儿的并发症的发生率及病死率随之增加。因此,提示临床医生应加强PROM早产儿住院期间管理,特别关注胎龄较小的极早产儿或超早产儿,尽可能减少严重并发症及不良结局的发生。
另外,本研究发现PROM时间延长并不增加极早产儿的新生儿期并发症和死亡的发生率,与既往报道一致[16-17]。Lorthe等[16]通过对胎龄24~32的PROM早产儿的全国性调查,发现PROM时间延长并不恶化新生儿预后;Manuck等[17]也研究了306例胎龄22~33周的PROM的早产儿,发现PROM时间与围生期不良结局无相关性。此外,有学者认为PROM新生儿的不良结局很大程度上取决于胎龄[18],因此需要权衡早产与PROM时间延长带来的风险,在应用抗生素防治感染的同时,合理应用宫缩抑制剂,并给予糖皮质激素促进胎肺成熟,以期延长孕周,改善早产儿预后[2]。
本研究多因素logistic回归分析显示,超低出生体重、Ⅲ度羊水污染与Ⅲ~Ⅳ级RDS是PROM极早产儿发生EOS的预测因素。Palatnik等[19]研究发现,较低的出生体重是极早产儿发生EOS或死亡的独立危险因素,本研究结果与其相一致。吴芳芳等[20]研究显示,羊水污染是新生儿EOS的危险因素之一,可能的原因为羊水受到胎粪污染后,胎儿长时间处于污染的羊水中,增加了其宫内感染的发生。Baizat等[21]研究发现早产儿应用肺表面活性物质是EOS的预测因素,而肺表面活性物质为RDS的有效替代治疗方法,因此RDS与早产儿EOS的发生有一定的相关性。可能的原因是早产儿肺部发育不成熟,易引起肺部局部感染,因早产儿免疫系统欠完善,最终导致EOS的发生。
本研究多因素logistic回归分析显示,极低出生体重、Ⅲ~Ⅳ级RDS、新生儿败血症是PROM极早产儿发生死亡的预测因素,这与一项前瞻性研究[22]结果一致。早产所致的较低出生体重儿因全身各个脏器未发育成熟,功能不完善,其与死亡的相关性已成为共识[19,22]。国内吴繁等[23]与张雨生[24]的研究表明RDS是引起早产儿死亡的主要原因。张素娥等[25]对179例超早产儿的研究发现,PROM者使用肺表面活性物质的比例偏低,可能的原因是PROM引起宫内绒毛膜羊膜炎的发生率增高,宫内炎症反应有利于刺激胎肺成熟[25-26]。因此PROM一定程度上降低了RDS的发生,但是伴有PROM的早产儿,一旦发生严重的RDS,加上感染的潜在因素,可能会导致较严重的不良结局[27]。因此,合理应用产前糖皮质激素和生后外源性肺表面活性物质促进肺成熟,能够改善PROM早产儿RDS的严重程度,降低病死率[28]。此外,PROM被认为是引起早产儿宫内感染的主要因素,产妇生殖道细菌,如大肠埃希菌、链球菌等可通过上行性感染进入羊膜腔,刺激单核-巨噬细胞分泌炎性因子,诱发炎症反应,增加宫内感染的风险[29-30]。国外Corchia等[27]对意大利地区2 974例极早产儿的研究表明,PROM增加了因新生儿感染导致早产儿死亡的风险。可见,早产儿败血症也是引起早产儿死亡的主要原因之一[31]。针对合并PROM的早产儿,我国《新生儿败血症诊断和治疗专家共识(2019年版)》[10]推荐对PROM≥18 h或母亲确诊绒毛膜羊膜炎的新生儿预防性使用抗生素。本研究为单中心回顾性分析,且样本量有限,对研究结果可能会造成一定的偏倚。因此,有必要采用多中心的前瞻性队列研究来验证相关因素对疾病发生的风险。
综上所述,本研究显示,PROM时间延长不会增加极早产儿新生儿期并发症和死亡的发生率,但仍要高度重视PPROM对早产儿带来的潜在感染风险。极早产儿不良结局,如EOS和死亡的发生与较低的出生体重、肺发育不成熟和全身感染有着密切的关系,临床上对于有发生极早产风险的PROM产妇应在控制感染的同时,适当延长孕周,并促胎肺成熟,减少早产儿并发症和不良结局的发生。针对存在高危因素的患儿应早期识别并采取有效措施早期干预,提高早产儿生存率。
