《整形手术用交联透明质酸钠凝胶》行业标准中交联剂含量的检测方法研究
2021-06-16付海洋于浩李敏姜爱莉付步芳王召旭
付海洋 于浩, 李敏, 姜爱莉 付步芳 王召旭
0 引言
透明质酸(hyaluronan,hyaluronic acid,HA)最早应用于眼科手术、骨科手术,预防术后粘连以及起到缓释作用的药物载体等方面[1]。交联修饰之后的 HA通过提高分子量、改变水溶性、延长降解时间从而提高其临床效果[2]。交联后的成品因低免疫原性、较高安全系数、美容效果好、可在机体完全降解且不良反应发生概率低等优势,近年来在注射整形行业备受关注[3-4]。常见的交联剂有二乙烯基砜(divinyl sulfone,DVS)[5]和1,4丁二醇二缩水甘油醚(1,4-butanediol diglycidyl ether ,BDDE)[6]。其中BDDE交联剂因毒性较小、反应性好等优势,在整形手术用交联透明质酸钠凝胶中的应用十分广泛,然而它却具有易突变、易引起临床不良反应,以及致癌的潜在因素,因此其交联透明质酸中交联剂含量过高同样存在一定的安全性问题。BDDE的限量是BDDE-HA凝胶产品质量控制的关键指标之一,行业标准YY/T 0962—2014中规定BDDE交联剂含量不得高于2 μg/g。
现行的YY/T 0962—2014《整形手术用交联透明质酸钠凝胶》行业标准推荐使用酶标仪检测法和气相法对BDDE交联剂含量进行测定。但在常规的气相法中,由于交联透明质酸钠凝胶产品大多都是颗粒化物质,BDDE交联剂可能会残留在颗粒内部,会对检测结果造成干扰。在常规的酶标仪检测法中,由于对样品进行酶解所采用的透明质酸酶分子结构也含有环氧结构,会对检测结果造成假阳性的影响,因此需要排除透明质酸酶的干扰作用。
基于上述分析,本文提出:针对气相法首先采用透明质酸酶将样品酶解,并用有机溶剂乙酸乙酯进行萃取,将处理后的样品与2 μg/mL对照品溶液进行峰面积比较;酶标仪检测法考虑透明质酸酶的影响,对方法进行改进,在标准溶液中也添加透明质酸酶,使标准溶液和样品溶液都含有等量的酶,改进后的酶标法是一种更为精确测定交联剂残留量的检测方法。通过上述方法,拟弥补现行行业标准YY/T 0962《整形手术用交联透明质酸钠凝胶》中方法的检测缺陷,最后对这两种改进后的方法进行方法学验证,并组织多家实验室进行验证。
1 研究方法
1.1 现行检测方法
气相法:称取交联透明质酸钠凝胶样品4 g,置10 mL量瓶中,加丙酮适量后,过滤,取续滤液作为供试品溶液,未经过酶解处理,难以检测到样品颗粒内部可能残留的交联剂。
酶标法:采用纯化水配置0.5~80 μg/mL 的BDDE标准溶液,未考虑到透明质酸酶的干扰作用。
1.2 检测方法的改良
1.2.1 实验试剂与仪器
试剂:BDDE(含量95.0%)、苯乙酮(含量99.0%)、尼克酰胺(含量99.5%)、透明质酸酶(587 U/mg),以上试剂由SIGMA公司提供。氢氧化钾(含量>82%)、甲酸(含量>88%)、乙醇(含量>99.5%),以上均为分析纯,由国药集团化学试剂有限公司提供。乙酸乙酯(色谱纯),由国药集团化学试剂有限公司提供。交联透明质酸钠凝胶样品(样品1批号36923128、样品2批号20190102、样品3批号H190123B11A、样品4批号20181224D)。
仪器:气相色谱仪(岛津公司,FID检测器,型号GC-2010 Plus);荧光酶标仪(Molecular Devices公司,型号Spectra Max M5);电子分析天平(Mettler-Toledo公司,型号XSE205DU);恒温水浴锅(天津泰斯特仪器有限公司,型号SHHW21.420AII);漩涡混合器(上海创萌生物科技有限公司,型号XW-80A);冷冻离心机(日立公司,型号日立CR21G)。
1.2.2 气相法
(1) 色谱条件 DM-17(30 m×0.32 mm×0.25 μm)毛细管柱,进样口温度260 ℃,分流比5∶1,检测器温度300 ℃,载气为N2,流速为2.48 mL/min,柱温采用程序升温,初温200 ℃,保持5 min,以20 ℃/min升至280℃,保持5 min,进样体积2.0 μL。
(2) 溶液的配制 称取25.56 mg的587 U/mg透明质酸酶用纯化水定容至10 mL,配置1 500 U/mL的透明质酸酶溶液。
(3) 空白溶液和2 μg/mL BDDE标准溶液 分别将1.0 mL水、1.0 mL 2 μg/mL BDDE标准溶液转移至一个10 mL的试管中,加入0.4 mL HAse溶液0.1 mL的水和1.0 mL乙酸乙酯,并充分混匀。将该溶液分装在两个微量离心管中,涡旋振荡1 min,以14 000 r/min的转速离心5 min,并将上清液转移至自动进样瓶中。
(4) 样品溶液 在10 mL的试管中精密称取大约1.0 g样品,加入0.4 mL HAse溶液,再加0.1 mL的水,并置于37℃条件下水浴3 h,可每隔30 min定时进行涡旋振荡,待样品完全溶解,冷却至室温,加入1.0 mL乙酸乙酯。再按照1.2.2(3)条件处理样品。
(5) 测定方法及指标 按照空白溶液、2 μg/mL BDDE标准溶液、样品溶液的顺序进样,分别记录色谱图,按下式计算供试品中BDDE残留量X。
(1)
式中:Cs为标准溶液BDDE浓度,μg/mL;Ai为供试品溶液中BDDE峰面积;As为标准溶液中BDDE峰面积;Wi为供试品称样量,g。
(6) 专属性 专属性指样品中可能存在其他成分的情况下,所用分析方法能够准确地、选择性地检测识别被测组分的能力。主要用于考察杂质及其他成分对待测组分测定结果的影响,可通过空白实验来考察。
测试方法为分别量取空白溶液和10 μg/mL BDDE对照品溶液2 μL注入气相色谱仪,按照1.2.2(1)色谱条件进行测定,记录色谱图。在待测组分出峰位置处,空白溶液并无干扰即为专属性高。
(7) 精密度 取2 μg/mL BDDE标准溶液按照1.2.2(1)色谱条件连续测定6次,计算BDDE峰面积的RSD。
(8) 稳定性 48 h内每隔8 h量取2 μg/mL BDDE标准溶液2 μL注入气相色谱仪,按照1.2.2(1)色谱条件进行测定,记录色谱图,考察BDDE峰面积随时间的变化趋势,并计算RSD。
(9) 重复性 分别称取6份1.0 g样品1,按照1.2.2(1)色谱条件进行测定,记录色谱图,测定样品中的BDDE残留,并计算RSD。
(10) 定量限与检出限 取10 μg/mL BDDE标准溶液,逐级稀释成不同浓度的对照品溶液,依次测定,记录BDDE峰的信噪比,以S/N=10时对应的浓度作为定量限,以S/N=3时对应的浓度作为检出限。
(11) 回收率实验 分别称取3份1.0 g样品1,加入0.4 mL HAse溶液,再分别加入0.1 mL浓度分别为10 μg/mL、20 μg/mL和40 μg/mL的BDDE溶液,并置于37℃水浴3 h,然后按照1.2.2(4)样品处理方法进行操作并进行测定,计算加样回收率及RSD。
(12) 样品测定 分别称取样品1、样品2、样品3和样品4各1.0 g,按照1.2.2(4)样品处理方法进行操作,测定样品中BDDE残留。
1.2.3 酶标仪检测法
(1) 溶液的配制 2.0 mg/mL BDDE标准储备液,125 mmol/L尼克酰胺溶液,15%苯乙酮溶液,1 mol/L氢氧化钾溶液,1 500 U/mL透明质酸酶溶液。
(2) 标准曲线的制作 实验最佳条件的选择,将透明质酸酶添加到标准溶液中。
标曲1(加酶):取BDDE标准储备液,用纯化水精确配制浓度分别为16.0、8.0、4.0、2.0、1、0.5 μg/mL的BDDE溶液,分别取0.8 mL各浓度标准溶液加入等体积的1 500 U/mL透明质酸酶溶液,得到8.0、4.0、2.0、1.0、0.5、0.25 μg/mL的BDDE标准溶液。
标曲2(不加酶):取BDDE标准储备液,用纯化水精确配制浓度分别为8.0、4.0、2.0、1.0、0.5、0.25 μg/mL的BDDE标准溶液。
(3) 样品溶液 称取0.8 g样品(根据交联透明质酸钠凝胶的密度(1.01 g/mL)计算所取样品的体积),加入等体积的透明质酸酶溶液,37 ℃水浴摇床振荡,24 h后获得待测样品酶解液。
(4) 测定方法及指标 量取各浓度标准溶液和待测样品酶解液200 μL,加100 μL的125 mmol/L尼克酰胺溶液混合,在37℃下水浴120 min后,向其中加入1.0 mL的15%苯乙酮溶液和1.0 mL的1 mol/L氢氧化钾溶液,混匀后置冰浴10 min。加入5.0 ml甲酸溶液,在60℃下水浴5 min,随后在冰浴冷却。在室温下10~15 min后,用带荧光检测的酶标仪测定荧光值,激发和发射波长分别为370 nm和430 nm。记录荧光强度检测数据,然后以BDDE标准溶液浓度为横坐标,荧光值为纵坐标,进行线性回归。并按照1.2.3(2)标曲1进行方法学的验证。
样品溶液中交联剂残留量的浓度Ci计算:
Ci(μg/g)=MiV总/m
(2)
式中:Mi为根据标准曲线计算出的样品溶液中BDDE的量,μg/mL;V总为样品加酶液的总体积,mL;m为样品的称样量,g。
(5) 精密度 取2.0 μg/mL对照品溶液按照1.2.3(4)方法并连续进行6次测定,记录荧光强度,计算RSD。
(6) 稳定性 取2.0 μg/mL对照品溶液按照1.2.3(4)方法,分别在0.25、0.5、1和2 h时测定荧光强度,计算RSD。
(7) 重复性 分别称取6份0.8 g样品1,按照1.2.3(4)方法连续进行6次测定,记录荧光强度,计算RSD。
(8) 检出限 连续进行10次空白测试,并按公式计算检出限:
(3)
式中:QL为检出限;S0为 10次空白测定的标准偏差;b为标准曲线斜率。
(9) 回收率实验 分别称取3份0.8 g样品1[根据注射用交联透明质酸钠凝胶的密度(1.01 g/mL)计算所称取样品的体积],分别加入20、40和60 μg/mL BDDE标准溶液各0.1 mL,然后加等体积的透明质酸酶溶液,水浴摇床37℃,转速70 r/min,24 h后获得注射用交联透明质酸钠凝胶酶解液,平行制备3份。然后按照1.2.3(4)测定方法进行试验,计算加样回收率。
(10) 样品测定 分别称取3份样品1、样品2、样品3和样品4各0.8 g,按照加酶的处理方法进行操作,分别依据标曲1和标曲2对样品的BDDE含量进行计算,并取平均值。
1.3 实验室验证
由中国食品药品检定研究院进行方法建立,组织国内多家具有检测资质的实验室对该方法进行验证,其中组织北京蒙博润生物科技有限公司(实验室M)和杭州协合医疗用品有限公司(实验室X),对本文提出的改良气相测试方法进行验证,按照1.2.2(1)~(5)的步骤开展重复工作,对同批次样品1、样品2进行交联剂残留量的测定,数据结果统一进行比较。组织实验室M和上海其胜生物制剂有限公司(实验室Q)采用酶标仪检测法,按照1.2.3(1)~(4)的步骤开展同一方法的验证工作,对同批次样品1、样品4进行交联剂残留量的测定,采用Minitab 16对数据结果进行统计学处理,对其进行双因子方差分析。
2 实验结果
2.1 气相法
(1) 专属性 图1为本单位BDDE专属性结果,显示空白溶剂进样,在BDDE出峰处无干扰峰,表明方法专属性高。
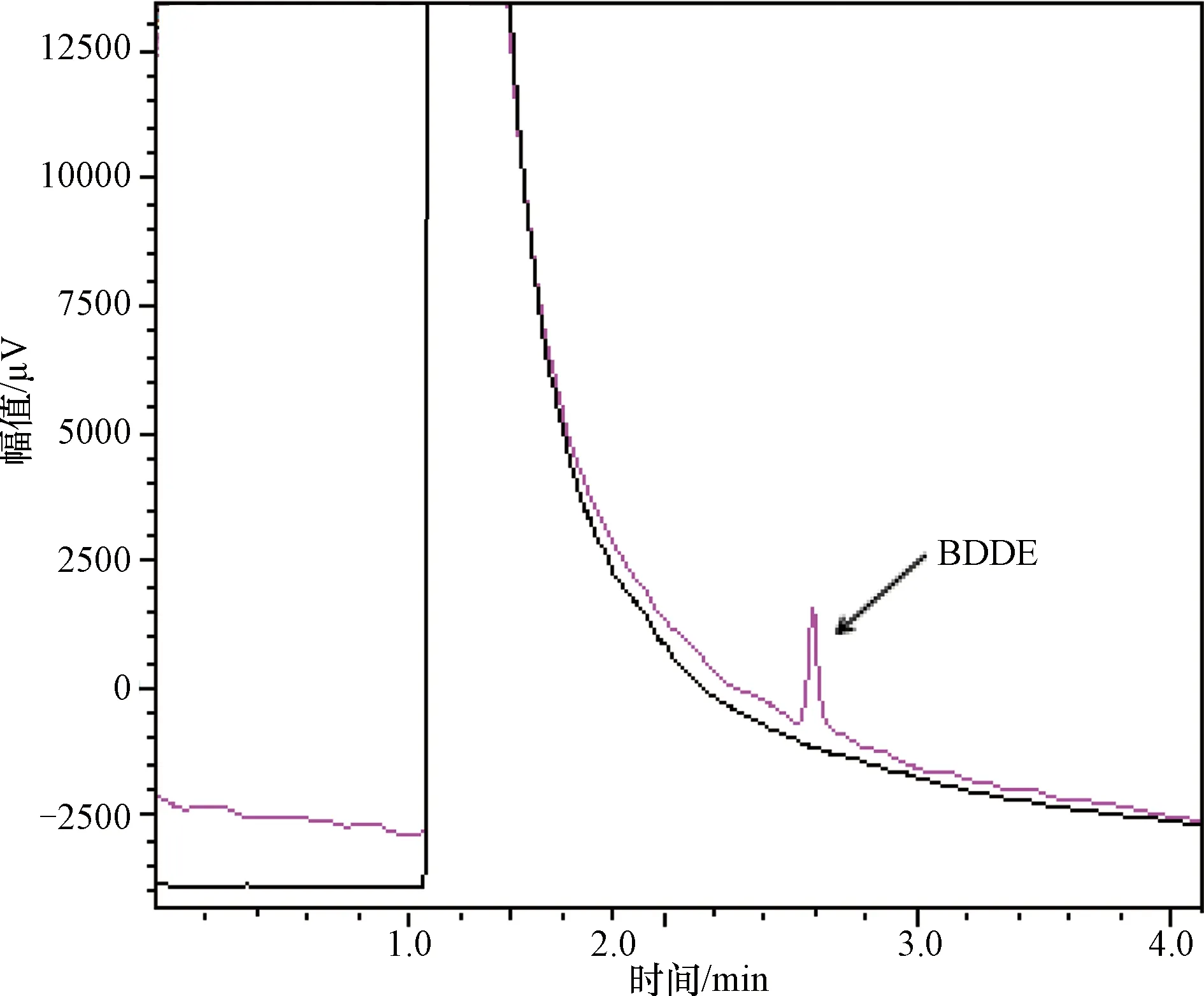
图1 空白溶剂及BDDE对照品溶液色谱图
(2) 精密度 2 μg/mL BDDE标准溶液连续测定6次,BDDE峰面积RSD为6.62%(n=6),可知方法精密度良好。
(3) 稳定性 48 h内测定2 μg/mL BDDE标准溶液6次,BDDE峰面积无明显变化趋势,BDDE峰面积RSD为3.86%(n=6),表明在该时间段内,配制的BDDE对照品溶液为稳定状态。
(4) 重复性 同一批次样品按照该方法进行测定6次,均未检测出BDDE残留。
(5) 定量限与检测限 BDDE定量限为1.80 μg/mL,检出限为0.65 μg/mL。
(6) 回收率实验 回收率均值为105.02%(n=6),RSD为9.15%。
(7) 样品测定 4个批次的样品中均未检出BDDE。
(8) 多家实验室验证结果 3家实验室按照1.2.2(1)~(5)的方法对样品1、2进行交联剂含量测定。测定结果均是未检出。
2.2 酶标仪检测法
(1) 线性关系 标曲1(加酶)的回归方程为y=36.89x+2.135(r=0.9989),标曲2(不加酶)的回归方程为y=35.518x-0.349(r=0.9990),见图2。结果显示,是否在标准溶液中加酶并不干扰BDDE含量与荧光值的线性关系,加酶与不加酶都有很好的线性关系,都可以通过标准曲线进行计算。从标准曲线上看,加酶的方法可行。
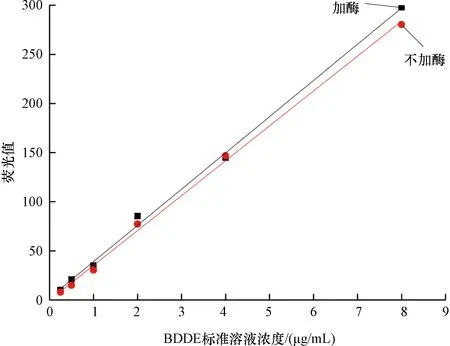
图2 对照品BDDE与荧光强度的线性关系
(2) 精密度 2 μg/mL BDDE标准溶液连续测定6次,荧光强度重复测定结果RSD为2.42%(n=6),可知方法精密度良好。
(3) 重复性 样品1按照该方法进行测定6次,重复测定结果RSD为2.19%(n=6),可知重复性良好。
(4) 检出限 10次空白测定荧光值分别为117.63、117.09、118.67、117.25、119.30、119.52、118.07、120.54、116.28、118.99,空白测定标准偏差为1.3020,标准曲线斜率为36.89,根据公式(3)计算检出限,计算结果为0.106 μg/mL。
(5) 回收率实验 根据标曲1(加酶),得出回收率均值为97.43%(n=6),RSD为8.22%;标曲2(不加酶),回收率均值为107.23%(n=6),RSD为8.32%。
(6) 样品测定 由表1可见,根据标曲1(将酶添加到标准溶液)计算出的样品含量明显低于标曲2(不加酶),这是因为此时扣除了样品中透明质酸酶的影响,并且根据回收率实验对比得出,将酶液添加到标准溶液中的最终测定结果更接近真实值。
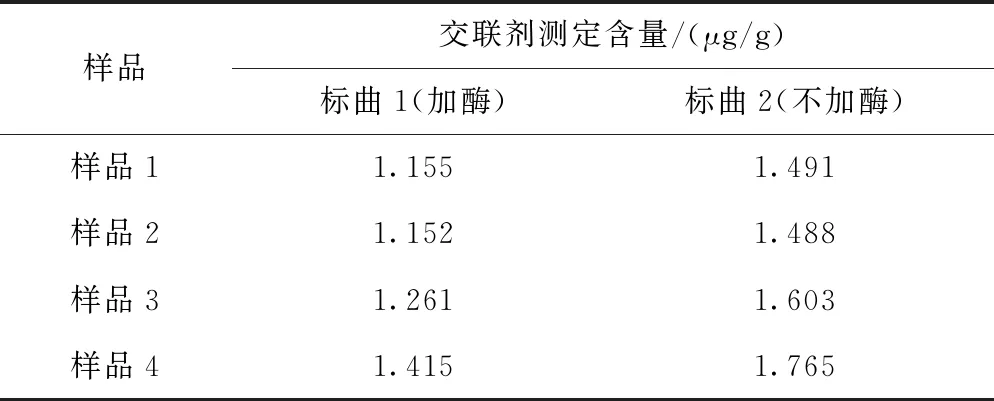
表1 样品中交联剂含量
2.3 多家实验室验证结果
实验室M和实验室Q按照1.2.3(1)~(4)的实验方法对样品1、4进行BDDE残留量测定(表4),采用Minitab 16 对数据进行统计学处理,采用双因子方差分析,显著水平P=0.113>0.05,因此得出多所实验室对样品1、4的测定结果不存在显著性差异,结果表明该方法测定整形手术用交联透明质酸钠凝胶产品中的交联剂含量具有可行性和可靠性。
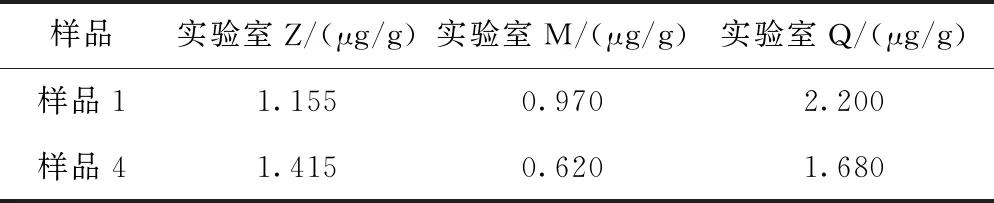
表2 多所实验室BDDE含量测定结果
3 讨论
人体内将近一半的HA存在于皮肤的真皮内,为胶原纤维和弹性蛋白的分布提供空间,机体衰老的过程中,结缔组织中的胶原蛋白和弹性纤维的网络会分解,含量显著下降,然而经过向真皮层注射HA后,胶原纤维的含量明显升高,由此证明注射HA可以调控胶原的合成,从而达到美容效果[7]。通过先进的交联技术,改变HA凝胶的物理和化学性以达到预期目的,相较天然的HA,交联后的凝胶衍生物结构强度以及抗酶解能力增强,从而延长在体内的维持时间。改性后的透明质酸生物膜还可以联合氯雷他定片治疗特应性皮炎[8]。本文采用气相法和酶标仪检测法对交联剂BDDE的含量进行测定。
气相法:BDDE交联的透明质酸钠凝胶产品,为不溶性凝胶状,无法直接进样,且产品大多都是颗粒化物质,BDDE可能残存在颗粒内部,所以在进样前首先需要对样品进行酶解处理,然后添加乙酸乙酯萃取,高速离心后取上清液进行分析测定。设置低、中、高3个加标梯度,平均回收率为105.02%,RSD为9.15%,通过3家实验室开展同一方法的验证工作,测定结果均是未检出。本文曾采用交联产品中间体进行实验,得到BDDE残留量为4.84 μg/g,但由于交联透明质酸钠凝胶成品中BDDE含量很低,并且气相法的定量限1.80 μg/mL十分接近最高标准要求,只能通过测定结果与2 μg/mL对照品溶液的色谱图进行比对,进而确定残留量小于2 μg/g。该方法操作简单、快捷,为半定量测定方法,可作为标准检测方法推广应用。
酶标仪检测法:该方法具有检测灵敏度高、特异性强的优势。检测原理为烟酰胺特异性地与BDDE中的环氧化合物的三元环发生反应,生成具有荧光吸收的有色物质,在一定的浓度范围内,荧光强度与其含量呈一定线性相关性,通过荧光强度可计算成品中交联剂的含量。然而透明质酸酶的分子结构中也含有环氧结构(本实验使用的透明质酸酶来源于牛睾丸型),这是检测结果产生假阳性的原因,因此需要将透明质酸酶添加到标准曲线中,进而排除酶的影响,否则会造成检测结果偏高。实验过程中比较了是否添加透明质酸酶到标准溶液的数据结果,明显得出考虑透明质酸酶的影响(将透明质酸酶添加到标准溶液)时,扣除酶对检测结果的影响,计算交联剂残留量偏低,平均回收率为97.43%,RSD为8.22%,数据结果更为真实可靠。通过3家实验室开展同一方法的验证工作,对其检测数据进行双因子方差分析,测定结果不存在显著性差异,得出本文建立的整形手术用交联透明质酸钠凝胶产品中交联剂含量的酶标仪检测法也具有可行性和可靠性,可作为标准检测方法推广应用。
4 结论
于2015年实施的YY/T 0962—2014 《整形手术用交联透明质酸钠凝胶》行业标准中推荐采用气相法和酶标仪检测法对交联剂含量进行测定,两种方法各有特点:气相法操作简单快捷,可作为BDDE的日常测定方法;酶标仪检测法特异性更高,数据更为真实精确,可根据实际情况选择具体采用哪种方法。
致谢:在此,十分感谢北京蒙博润生物科技有限公司、上海其胜生物制剂有限公司和杭州协合医疗用品有限公司以及相关领域专家对行业标准《整形手术用交联透明质酸钠凝胶》行业标准交联剂残留量方面的修订内容和补充验证情况做出的努力。
