红枣多糖对小鼠肠道免疫屏障的保护作用及机制研究
2021-06-16牛佳卉张晓富张慧芳贾金玉
牛佳卉,袁 静,魏 然,张晓富,张慧芳,贾金玉,赵 文
(河北农业大学食品科技学院,河北省农产品加工工程技术中心,河北保定 071001)
红枣(ZizyphusjujubaMill.)是我国的特产水果,富含多糖、多酚、三萜酸、环核苷酸等多种生物活性成分[1],具有药食两用的特点。我国枣资源丰富,2018年产量达880多万吨[2],但高产低值问题严重。多糖是红枣中含量较高的功能性营养成分,具有抗肿瘤、降血脂、抗氧化、护肝、提高免疫力、调节肠道菌群等生物学作用[3-7],但有关保护肠道屏障的功能与机制研究较少。
肠道,作为最大的身体黏膜层,暴露在大量的外来物质中,是人体的一道天然屏障,分为物理屏障、化学屏障、免疫屏障和生物屏障,可以防止食物中的有毒有害物质进入血液[8]。肠道屏障一旦被破坏会导致大量的细菌和内毒素经门静脉和淋巴系统侵入机体循环,引起肠源性脓毒血症和内毒血症,不仅加重原发疾病,甚至会诱发全身严重反应和多器官功能障碍综合征,进而危及生命[9]。因此,研究红枣多糖对肠黏膜受损小鼠肠道屏障的保护作用,对于进一步挖掘红枣的营养功能、开发相关功能性产品、解决我国红枣高产低值问题具有重要意义。
本文重点研究红枣多糖对小鼠肠道免疫屏障的保护作用及机制,首先建立肠道粘膜受损小鼠模型,然后观察肠道病理切片中肠道的形态结构,其次根据肠道免疫相关指标和肠道蛋白表达情况来评价JPS对肠道免疫屏障的保护作用及作用机制,以期进一步挖掘枣的药食两用功能,促进中国枣产业的发展,推动相关产品创新开发。
1 材料与方法
1.1 材料与仪器
红枣多糖(Jujube Polysaccharides,JPS,多糖含量为70.44%±1.82%) 本实验室制备(原料为产自保定阜平县的婆枣,提取方法为:将枣烘干后粉碎成粉末,按照料液比为1∶10 (g∶mL)添加蒸馏水,加入0.3%的纤维素酶,在55 ℃下水浴5 h,将水浴后的溶液4000 r/min离心10 min,合并提取溶液过滤并浓缩至原始体积的一半,然后加入4倍体积的95%(v/v)乙醇沉淀2 d,放置4 ℃,醇沉2次,4000 r/min离心10 min,将沉淀冻干得到样品多糖);SPF级雄性ICR小鼠 70只,体重约18~22 g,购于北京华阜康生物科技股份有限公司,许可证号:SCXK(京)2014-0004;溶菌酶(Lysozyme,LZM)、酸性磷酸酶(Acid phosphatase,ACP)、分泌型免疫球蛋白A(Secretory immunoglobulin A,SIgA)、免疫球蛋白A(Immunoglobulin A,IgA)、环磷酰胺(Cyclophosphamide,CTX) 上海源叶生物科技有限公司;BCA蛋白定量试剂盒、Western Blot loading buffer 上海索莱宝生物科技有限公司;Rabbit Anti-NF-κB p65 antibody、Rabbit Anti-MyD88 antibodyCell Signaling Technology;Rabbit Anti-IL-1 beta antibodyAbcam;Anti-β-actin antibody、Goat Anti-Mouse IgG、Goat Anti-Rabbit IgG 北京博奥森生物技术有限公司;组织蛋白抽提试剂盒、eECL化学发光显影液 北京康为世纪生物科技有限公司。
1500-823型全波长扫描酶标仪 Thermo Scientific公司;电泳仪(JY600E)、电泳槽、电转槽 北京君意东方电泳设备有限公司;Tanon-4600SF全自动数码凝胶/化学发光图像分析系统 上海天能科技有限公司;Scientz-ⅡD型超声细胞破碎仪 宁波新芝生物科技股份有限公司;RM2235型组织病理切片机 德国Leica公司;4590型石蜡包埋机 日本SAKURA精密技术公司;CKX41型奥林巴斯倒置电子荧光显微镜 长恒荣创科技有限公司。
1.2 试验方法
1.2.1 动物分组与建模 将70只雄性ICR小鼠购入后适应性喂养2~3 d,按体重随机分为5组,每组14只,分为阴性对照组、模型组、JPS 150、300和600 mg/kg·bw三个剂量组,将小鼠连续灌胃28 d。其中阴性对照组和模型组用蒸馏水等体积灌胃,剂量组灌胃不同剂量的多糖提取物,剂量设置依据相关文献[10-12]和前期预试验结果可知JPS 300 mg/kg的效果较好,因此为中剂量,低、高剂量分别设为150、600 mg/kg·bw,连续灌胃到第28 d,实验第28 d进行造模的准备,具体操作方法为模型组和红枣多糖剂量组按照剂量100 mg/kg·bw腹腔注射给予小鼠环磷酰胺,阴性对照组则按照等体积法用生理盐水进行腹腔注射。
1.2.2 动物处理及样本采集 末次给药造模后,将各组动物禁食12 h,然后称重记录体重。颈椎脱臼法处死动物,解剖取其脾脏、胸腺并称重记录,取部分肠道组织,制成10%肠道匀浆,3000 r/min离心5 min取上清待测。再取各肠段组织放置10%的福尔马林溶液中充分固定,石蜡包埋,HE染色,制作病理切片,进行病理组织形态学检查。最后将剩余的肠道组织放入-80 ℃冰箱冷冻备用。
1.3 指标测定
1.3.1 免疫器官指数的测定
脾脏指数=脾脏质量(mg)/小鼠体重(g)
胸腺指数=胸腺质量(mg)/小鼠体重(g)
1.3.2 小鼠肠道派伊尔结(Peyer’s Patch,PP结)的计数 将小鼠解剖后取出的小肠放入含有PBS液的培养皿中,将肠黏膜表面的脂肪组织清除干净,在小肠的最外层,位于肠系膜的对侧的麦粒状的圆形突起为派伊尔结。肉眼观察计数小肠的派伊尔结的数目,每组小鼠的派伊尔结取平均值。
1.3.3 肠道生化指标的测定 取制备好的肠道匀浆,严格按照ELISA试剂盒说明书分别测定SIg A、IgA、LZM、ACP等生化指标。
1.3.4 肠道病理组织形态学观测及免疫细胞计数 用甲醛溶液与蒸馏水按体积比1∶10的比例配制福尔马林溶液,室温下备用。将小鼠各肠段取出后,放入10%的中性福尔马林溶液中,固定24 h,然后进行常规包埋,用于HE染色。在光学显微镜下计数肠道绒毛中肠上皮内淋巴细胞和杯状细胞的数量。
1.3.5 肠道中MyD88、NF-κB p65、IL-1β蛋白的表达测定 采用Western Blotting的方法测定肠道MyD88、NF-κB p65、IL-1β蛋白的表达。按照组织蛋白抽提试剂盒中说明书的要求提取肠道组织蛋白,最终蛋白样品以4∶1的比例加入缓冲液,然后将样品沸水浴5 min使蛋白变性,最后将蛋白样品保存于-80 ℃冰箱中备用。进行SDS-PAGE,用预染蛋白质Marker对比分子质量,用湿转的方法进行转膜。用5%的脱脂奶粉封闭2 h,在4 ℃下一抗孵育过夜,然后用TBST清洗3次,再用二抗孵育1 h,用TBST清洗5次,最后配置HRP显色液,在膜上均匀滴显色液,获得图像并分析。

表1 JPS对小鼠免疫器官指数的影响Table 1 Effect of JPS on immune organ index in mice
1.4 数据处理
运用ImageJ-win64分析Western Blot图像,试验数据运用SPSS 18.0进行统计分析。首先进行正态性检验,若数据符合正态分布,采用单因素方差分析(One-way ANOVA)。本试验中所有数据均以平均数±标准差(X±S)表示。P<0.05,表示显著差异;P<0.01,表示极显著差异。

图1 JPS对小鼠肠道病理切片的影响Fig.1 Effect of JPS on intestinal pathological sections of mice 注:a:十二指肠;b:空肠;c:回肠。
2 结果与分析
2.1 红枣多糖对小鼠肠道形态结构的影响
小鼠十二指肠、空城、回肠的形态变化如图1所示。由图1可以看出,各肠段阴性对照组小肠绒毛整齐排列,纤长,绒毛之间的间隙较小。与阴性对照组相比,模型组各肠段小肠绒毛形状不规则,绒毛长度低于阴性对照组,此外,小肠绒毛排列松散,绒毛之间的间隙增大,一些绒毛甚至断裂和脱落,表明模型造模成功。与模型组比,JPS低剂量组与模型组相比改善不明显;中、高剂量组绒毛形态改善较大,绒毛长且排列紧密,绒毛断裂、脱落的现象减轻,绒毛间隙变小。因此,环磷酰胺对小鼠肠道的绒毛形态具有破坏作用,而JPS可以改善环磷酰胺对小肠绒毛结构的损伤,保护肠道屏障,此结果与李学敏[13]等人的研究一致。
2.2 红枣多糖对小鼠免疫器官指数的影响
由表1可以看出,与阴性对照组相比,模型组胸腺和脾脏指数极显著下降(P<0.01)。与模型组相比,JPS低、中剂量组的脾脏指数和胸腺指数没有显著性差异,但中剂量组的脾脏、胸腺指数有所提高。JPS高剂量组脾脏指数增加,但差异不明显,胸腺指数显著增加(P<0.05)。
机体的免疫功能与免疫器官的发育情况密切相关,免疫器官是免疫细胞形成、分化及生成的重要场所,胸腺和脾脏是机体的重要免疫器官,其生长发育与机体的免疫功能具有直接联系[14-15]。本研究表明JPS对环磷酰胺造成的小鼠胸腺指数和脾脏指数具有正调节作用,其结果与蕨类多糖和黄芪多糖[16-17]均能提高免疫抑制小鼠脏器指数,缓解环磷酰胺诱导的免疫抑制结果相似。
2.3 红枣多糖对小鼠肠道PP结的影响
派伊尔结又称派尔集合淋巴结,是肠黏膜免疫系统的重要组成部分。PP结的大小、数量可以反应肠道黏膜免疫的状态[18-19]。表2表明了JPS对小鼠肠道PP结的数量变化。可知与阴性对照组相比,模型组中PP结的个数显著减少(P<0.05),与周华等[20]研究环磷酰胺对小鼠Peyer’s结和肠道粘膜相关淋巴细胞的影响结果一致。与模型组相比,JPS各剂量组的肠道PP结数量明显增加,其中JPS低剂量组显著增加(P<0.05),中、高剂量组极显著增加(P<0.01)。研究结果表明JPS可改善环磷酰胺导致的肠道粘膜免疫功能损伤的情况,增加肠道PP结的数量,增强肠道免疫功能。
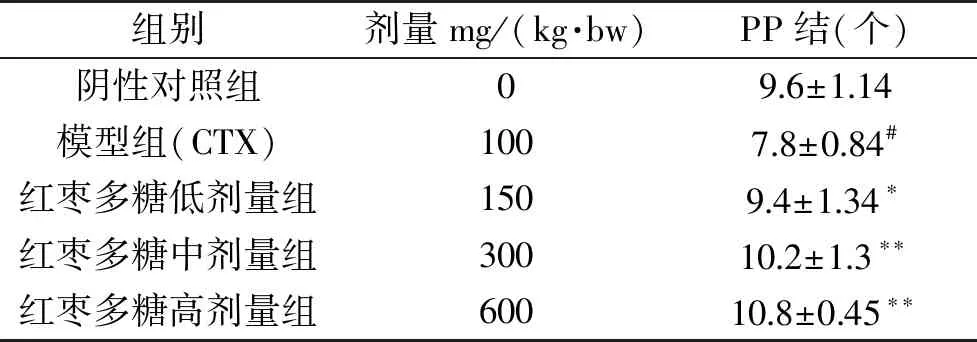
表2 JPS对小鼠肠道PP结的影响Table 2 Effect of JPS on intestinal PP node in mice
2.4 红枣多糖对小鼠肠道免疫指标的影响
由表3可知,与阴性对照组比较,模型组小鼠肠粘膜SIgA、IgA分泌不同程度的下降,差异极显著(P<0.01),说明环磷酰胺可明显损害肠道上皮细胞分泌抗菌物质,此实验造模是成功的;与模型组相比,JPS低剂量组SIgA含量显著增加(P<0.05),IgA含量无显著性变化,中剂量组的SIgA和IgA含量显著增加(P<0.05),高剂量组的SIgA和IgA含量极显著增加(P<0.01),且呈现剂量和依赖关系,表明JPS对SIgA和IgA的分泌有显著的改善的作用。与阴性对照组相比,模型组的溶菌酶和酸性磷酸酶的酶活性均显著降低(P<0.05);与模型组相比,JPS组低剂量组的溶菌酶和酸性磷酸酶的活性没有显著性的变化(P>0.05)。而JPS中、高剂量组的溶菌酶和酸性磷酸酶的酶活均显著增加(P<0.05)。
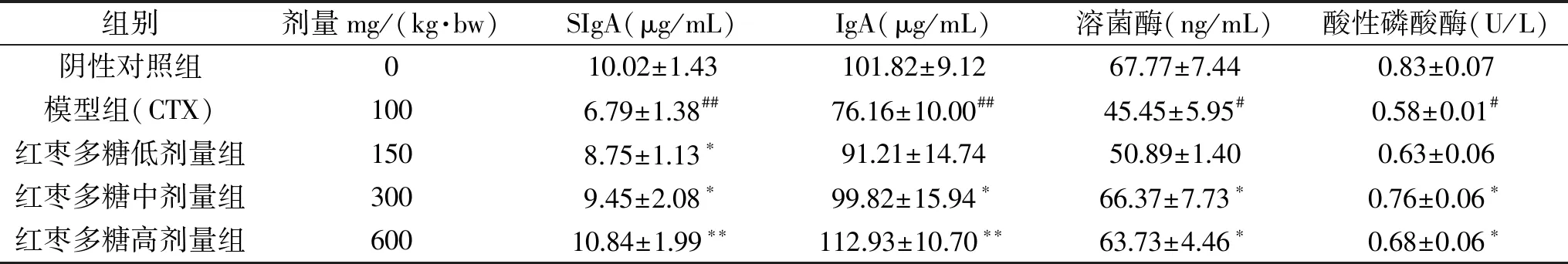
表3 JPS对小鼠小肠肠道免疫指标的影响Table 3 Effect of JPS onimmune index in small intestine of mice
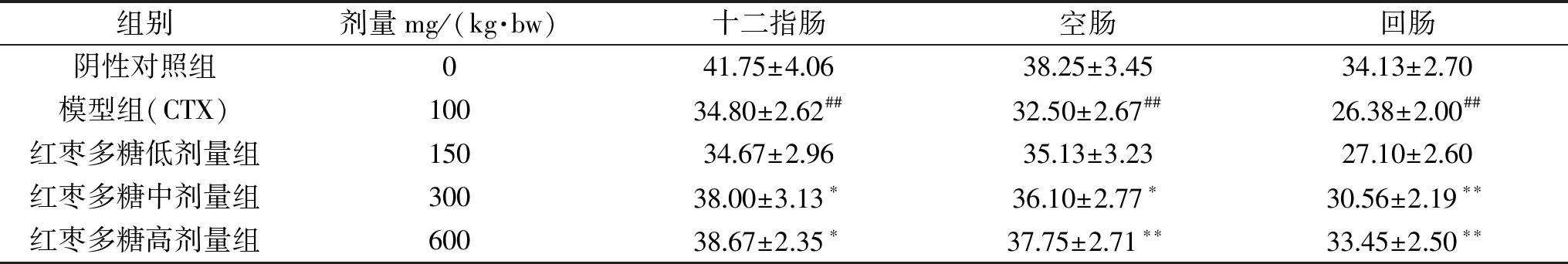
表4 JPS对小鼠肠道上皮内淋巴细胞数量变化的影响Table 4 Effects of JPS on the number of lymphocytes in the intestinal epithelium of mice
SIgA是由肠黏膜固有层浆细胞分泌的免疫球蛋白,是肠道免疫屏障的主要效应因子,在肠道黏膜表面起到重要的免疫保护作用,能够增强肠道的免疫功能[21-22]。IgA是黏膜免疫的主要抗体,是维持肠道黏膜稳态的重要物质[23-24]。本研究结果说明JPS可以加快小鼠中肠黏膜SIg A的分泌量的速度,在一定程度上拮抗环磷酰胺对肠道SIg A的分泌抑制作用。
溶菌酶由巨噬细胞分泌,其能够改善增强巨噬细胞的吞噬功能,结合细菌脂多糖,减轻内毒素作用,进而增强机体的抵抗力,还有抗菌、抗炎和抗病毒的作用[25-26]。酸性磷酸酶是溶酶体的标志酶,而溶酶体大量存在于巨噬细胞中,因此,酸性磷酸酶水平反映了巨噬细胞的激活程度[27]。本试验研究结果类似与黄秀芳等人的研究[28],表明红枣多糖能够通过提高肠道的溶菌酶和酸性磷酸酶的活力来增强肠道的免疫功能,进而保护肠道免疫屏障免受环磷酰胺对其造成的损伤。
2.5 红枣多糖对小鼠肠道免疫细胞的影响
上皮内淋巴细胞是存在于小肠粘膜上皮的一类独特的淋巴细胞群,在肠道免疫过程中最先与抗原接触,发挥免疫屏障作用,可反映肠黏膜免疫屏障的完整性及免疫防御功能的完善程度[29]。由表4可知,与阴性对照组相比,模型组中十二指肠、空肠和回肠中的上皮内淋巴细胞的数量极显著下降(P<0.01);与模型组相比,JPS中剂量组的十二指肠、空肠中上皮内淋巴细胞显著增加(P<0.05),而回肠中极显著增加(P<0.01)。JPS高剂量组中十二指肠的上皮内淋巴细胞显著增加(P<0.05),而空肠和回肠中极显著增加(P<0.01)。研究结果表明,JPS能促进肠道内上皮内淋巴细胞的增殖,在一定程度上缓解环磷酰胺对小鼠肠道造成的粘膜免疫损伤,此结果与廖吕燕的研究类似[30]。同时还发现肠道上皮内淋巴细胞的数量从十二指肠到回肠逐渐减小,有可能是因为不同肠段接触不同种类和数量的病原微生物及抗原有关,这一变化特点与有关报道一致[31]。
杯状细胞分布于肠绒毛柱状细胞之间,是一种分泌高度糖基化黏蛋白的细胞,通过有效隔离宿主上皮细胞、免疫细胞与肠道微生物接触,抑制肠道过度炎症反应,进而维持肠道免疫屏障稳态[32-33]。由表5可知,杯状细胞从十二指肠到回肠其数量呈逐渐增加趋势。与阴性对照组相比,模型组中十二指肠、空肠和回肠的杯状细胞的数量极显著下降(P<0.01);与模型组相比,JPS中剂量组十二指肠和空肠中杯状细胞的数量极显著增加(P<0.01),回肠中杯状细胞数量显著增加(P<0.05)。高剂量组中十二指肠、空肠和回肠中杯状细胞的数量分别极显著增加(P<0.01)。研究结果表明,JPS能够促进肠道中杯状细胞的增殖,调节环磷酰胺所导致小鼠肠道免疫细胞下降的趋势,增加小鼠肠道免疫细胞的数量。

表5 JPS对小鼠肠道杯状细胞数量变化的影响Table 5 Effects of JPS on the number of intestinal goblet cells in mice
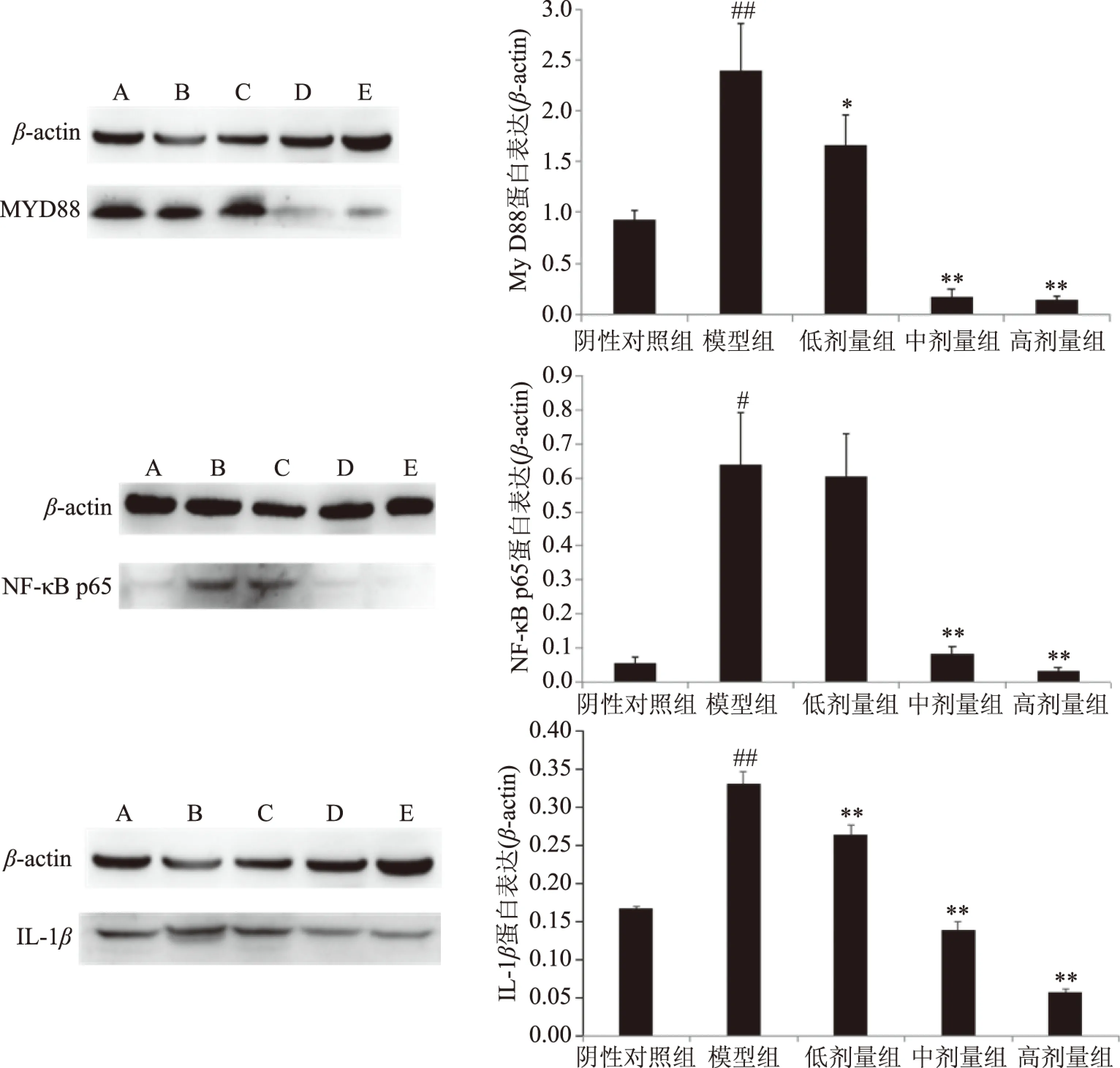
图2 JPS对小鼠肠道MyD88、NF-κB p65和IL-1β蛋白表达的影响Fig.2 Effects of JPS on MyD88,NF-B p65 and Il-1 protein expression in intestinal tract of mice注:A为阴性对照组,B为模型对照组,C为红枣多糖低剂量组,D为红枣多糖中剂量组,E为红枣多糖高剂量组。 与阴性对照组相比,#P<0.05,##P<0.01;与模型组相比,*表示P<0.05,**表示P<0.01。
同时发现,肠道杯状细胞的数量从十二指肠到回肠逐渐增加,这与文献[34]报道的一致,可能因为回肠作为小肠、大肠的交界,更容易受到微生物的侵害,免疫屏障较弱,所以回肠的杯状细胞数量较多。
2.6 红枣多糖对小鼠肠道蛋白表达的影响
图2显示了JPS对小鼠肠道中MyD88、NF-κB p65和IL-1β蛋白的表达情况。由图2可知与阴性对照组相比,模型组极显著上调MyD88和IL-1β蛋白的表达(P<0.01),显著上调NF-κB p65蛋白的表达(P<0.05);与模型组比,JPS低剂量组显著下调MyD88蛋白的表达(P<0.05),极显著下调IL-1β蛋白的表达(P<0.01),对NF-κB p65蛋白的表达无显著性影响(P>0.05),JPS中、高剂量组均极显著下调MyD88、NF-κB p65、IL-1β蛋白的表达(P<0.01)。
MyD88是TLRs信号通路的关键接头分子,在启动核转录因子NF-κB依赖的信号级联反应中发挥着重要的作用[35]。NF-κB作为重要的转录调节因子,广泛参与炎性介质和前炎性介质的调控,在机体的先天性免疫应答和获得性免疫应答中起着关键作用,调节多种炎症因子和免疫效应蛋白的表达,而NF-κB p65蛋白是启动NF-κB途径的关键蛋白[36]。研究表明,黄芩苷[37]可通过对NF-κB信号通路的调控,从而减少炎性因子(IL-1β,TNF-α)的分泌,发挥抗炎作用,保护免疫屏障。中药单体盐酸小檗碱[38]可通过降低UC小鼠体内的TNF-α、IL-1β水平,升高IL-10表达水平来改善UC小鼠的结肠炎症,减少肠壁通透性。而本试验结果表明红枣多糖通过下调MyD88、NF-κB p65的表达,导致少量的NF-κB释放,少部分的从胞浆转运至细胞核,从而调控淋巴细胞中炎性因子的合成和释放,抑制IL-1β的分泌,进而提高肠道免疫功能,保护肠道屏障。
3 结论
本试验通过建立环磷酰胺所致肠道黏膜损伤小鼠的模型,研究JPS对其肠道免疫屏障的保护作用。结果表示JPS能够缓解环磷酰胺对小鼠肠道造成的损伤,维持其正常的的肠道形态结构,保护肠道屏障;通过增加肠道PP结的数量,增强肠道SIgA、IgA的分泌以及溶菌酶和酸性磷酸酶的活性,增加肠道免疫细胞的数量,来增强机体肠道免疫屏障。机制可能与下调肠道黏膜损伤小鼠肠细胞MyD88、NF-κB p65和IL-1β蛋白的表达,抑制NF-κB通路的激活,降低炎症因子的分泌有关。
