miR-145-3p靶向HDAC4调控人牙周膜成纤维细胞的自噬机制研究
2021-06-15杨正祥谢陆莉邓琳王瑜
杨正祥 谢陆莉 邓琳 王瑜
正畸牙齿时移动的基础是牙周组织进行改建,在该过程中牙周膜发挥桥梁的重要作用,其最先能够感受到外界的作用力并且将该力传导至牙槽骨。牙周膜成纤维细胞(periodontal ligament fibroblasts,PDLFs)是牙周膜中最主要的一种细胞,是牙周组织的再生以及形成新的附着的一种重要成分[1]。但是在牙周遭受创伤或者炎症时,牙周膜的再生细胞数量的减少以及其生物学功能的减弱阻碍了该牙周组织完全再生的能力[2]。自噬(Autophagy)即Ⅱ型程序性死亡,是一种新的细胞程序性死亡方式,对维持细胞内环境的稳定有重要作用。在该过程中,细胞中多余的或功能障碍的细胞器、蛋白质等经过溶酶体进行降解[3]。MicroRNAs(miRNA)是一种长度约22 nt的内源性表达的非编码RNA,在转录调控的过程中具有重要作用,能够与靶基因互相作用而调控基因的表达,参与细胞的生物学过程[4]。miR-145是新发现的一种miRNA,包括miR-145-3p和miR-145-5p两种结构,可以调控多种细胞的生物学过程[5]。本研究探讨miR-145-3p对HPDLFs细胞自噬过程的影响及其可能存在的作用机制。
1 材料与方法
1.1 HPDLFs的采集及培养 收集12~18岁因正畸需要减数而拔除的健康前磨牙,立即放入含有青-链霉素的预冷的DMEM培养液中。取牙根1/3处的牙周膜组织,加入4 ml含0.5 g/L胰蛋白酶的DMEM培养液于37℃恒温培养箱中消化20 min。然后用不含血清的DMEM培养液洗1次弃去上清,将组织块置于35 mm的培养皿中,并加入含有200 ml/L胎牛血清的DMEM培养液,将组织块上覆盖一片无菌盖玻片保证组织块与盖玻片之间的培养液充盈。37℃ CO2培养箱孵育4 h后,加1~2 ml培养液,继续培养,每3天换1次液。待细胞铺满培养皿底大约80%时,进行首次传代。按1∶3细胞计数传代,取第5代HPDLFs用于后续实验。
1.2 材料与仪器
1.2.1 材料:DMEM培养基购自美国Hyclone公司;胎牛血清(fetal calf serum,FBS)购自美国Gibco公司;miR-145-3p-mimic、miR-145-3p-inhibitor和miR-145-3p-NC由广州锐博生物公司合成;Lipofectamine 2000购自美国Invitrogen公司;青-链霉素、胰蛋白酶购自美国Sigma公司;蛋白定量试剂盒、Western Blot发光液购自美国Thermo公司;兔抗波形蛋白、鼠抗泛细胞角蛋白、兔抗Beclin-1、P62、LC3、HDAC4以及鼠抗GAPDH均购自美国Abcam公司;免疫组织化学试剂盒购自武汉博士德生物。
1.2.2 仪器:双人水平超净工作台(上海巴玖实业有限公司);二氧化碳细胞孵育箱(美国Thermo公司);低温高速离心机(美国Thermo公司);DYC-p32型电泳仪(上海巴玖实业有限公司);转膜仪(南京生兴生物经济技术有限公司);倒置荧光显微镜(DMIL LED Fluo;德国Leica公司);荧光显微镜(日本Olympus,BX63)、BIO-RADChemiDOC凝胶成像系统(美国BIO-RAD公司)。
1.3 HPDLFs的鉴定 将HPDLFs的第5代细胞用2.5 g/L胰蛋白酶消化,消化的细胞以2×104个/ml接种在培养皿中的盖玻片上,待盖玻片上长满单层细胞后取出备用。用无菌的PBS溶液洗去盖玻片上的培养液,用0.4 g/L的多聚甲醛固定液固定20 min,然后用PBS溶液洗3次,吹干,免疫组织化学染色法鉴别波形丝蛋白(vimentin)和角蛋白(Keratin),倒置荧光显微镜观察、拍照。
1.4 细胞转染 取上述消化好的HPDLFs以2×104个/ml接种在6孔板中,继续培养4 h,用Lipofectamine 2000转染试剂盒将miR-145-3p类似物(miR-145-3p-mimics)、miR-145-3p抑制物(miR-145-3p-inhibitor)和阴性对照(miR-145-3p normal control,miR-145-3p-NC)转染至HPDLFs,转染48 h。
1.5 质粒转染 按照Lipofectamine 2000转染试剂盒说明书,在上述1.4转染好的细胞中进行带有GFP-LC3的质粒转染,加样后避光静置15 min,然后加入到盛有400 μl新鲜无血清DMEM培养液的6孔板中,转染4 h后再加入完全培养基500 μl,24 h后观察荧光。对10个不同视野的200个细胞计数进行统计分析,Student’st-检验分析显著性差异。每组设置3个复孔,取平均值。
1.6 免疫荧光染色方法检测细胞自噬 将转染后的细胞用预冷多聚甲醛在4℃下固定30 min,用质量分数为0.1%的吐温处理10 min,PBS洗涤,室温下封闭30 min,加入LC3一抗(1∶100),4℃孵育过夜,PBS洗涤细胞后,加入二抗(1∶1 000),室温孵育1 h,荧光封片剂封片,显微镜下观察LC3阳性细胞占细胞总数的百分比。每个切片任意选取5个视野。
1.7 Western Blot检测细胞内相关蛋白表达 将各组细胞转染48 h后,RIPA裂解液提取总蛋白,将蛋白样品加入SDS-PAGE凝胶的加样孔进行电泳,使蛋白转移至PVDF膜,5%脱脂奶室温封闭2 h,TBST温和洗涤3 min后加入相对应的一抗,4℃孵育过夜,TBST洗涤10 min×3次,加入二抗,室温下孵育1 h,TBST洗涤10 min×3次,加入配制好的ECL发光液,避光孵育5 min,化学发光凝胶成像仪中采集图片信息,图片用Image pro plus 6.0软件进行灰度分析。每个实验结果独立重复3次。
1.8 靶基因预测及双荧光素酶报告基因分析 利用miRanda、TargetScan数据库预测miR-145-3p的潜在靶基因,其中HDAC4在miR-145-3p的3’-UTR上有结合位点。将第5代细胞以2×104个/ml接种于24孔板,用LipofectamineTM2000将荧光素酶报告载体(HDAC4-3’-UTR-WT或HDAC4-3’-UTR-Mut)与miR-145-3p-mimics/inhibitor/NC共转染细胞,以Renilla荧光素酶质粒(100 ng/孔)为对照,与载体共转染。转染24 h后,用双荧光素酶报告分析系统(Promega)检测荧光素酶活性。
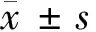
2 结果
2.1 HPDLFs的鉴定 免疫组化染色结果表明,成纤维细胞标记物波形蛋白为阳性染色,在胞质内阳性颗粒均匀分布,胞浆染为棕黄色,胞核清晰并无染色;而来源于中胚层的角蛋白呈阴性染色,证明其为间质细胞,且无混杂上皮来源细胞。见图1。

波形蛋白阳性染色 角蛋白阴性染色
2.2 MiR-145-3p过表达诱导HPDLFs自噬 带有GFP-LC3的质粒在细胞中转染成功后,细胞中表达的自噬小体标记物LC3蛋白会发出绿色荧光。结果显示,miR-145-3p-inhibitor组细胞内有极其微弱的荧光,Blank和miR-145-3p-NC组细胞内荧光强度强于miR-145-3p-inhibitor组(P<0.05),而转染miR-145-3p-mimics的细胞内荧光强度最高,有大量自噬体形成。见图2,表1。

图2 MiR-145-3p诱导HPDLFs自噬
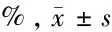
表1 GFP-LC3阳性细胞百分比
2.3 4组转染细胞内Beclin-1、P62和 LC3的蛋白表达 P62蛋白在miR-145-3p-inhibitor组细胞内表达显著高于其他3组(P<0.05),而在Blank组、miR-145-3p-mimics组和miR-145-3p-NC组间蛋白表达差异无统计学意义(P>0.05);miR-145-3p-mimics组细胞内Beclin-1和LC3蛋白表达显著高于其他3组(P<0.05),而在Blank组、miR-145-3p-NC组和miR-145-3p-inhibitor组间蛋白表达差异无统计学意义(P>0.05)。见表2,图3。
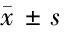
表2 Western Blot检测细胞内Beclin-1、P62和 LC3的蛋白表达

图3 Western Blot检测细胞内Beclin-1、P62和 LC3的蛋白表达
2.4 MiR-145-3p靶基因预测 为确定MiR-145-3p在HPDLFs中发挥生物学功能的靶向作用点,我们使用TargetScan、miRanda等筛选MiR-145-3p潜在的下游靶向蛋白,预测发现MiR-145-3p与HDAC4在3’-UTR可能具有靶向调节关系,HDAC4是MiR-145-3p的一个潜在作用靶点。使用双荧光素酶报告系统研究MiR-145-3p能否与去乙酰化酶4(histone deacetylase 4,HDAC4)的3’-UTR位点结合,结果显示,MiR-145-3p能够与HDAC4基因3’-UTR结合,并抑制荧光素的表达,而在转染突变载体的细胞内没有观察到明显的荧光素酶活性改变,表明HDAC4是MiR-145-3p的直接靶向蛋白。同时,我们用Western Blot检测了4组转染MiR-145-3p基因的细胞内HDAC4蛋白表达情况,结果显示,转染miR-145-3p-mimics的细胞内HDAC4的表达显著低于其他3组(P<0.05),而Blank组、转染miR-145-3p-NC和miR-145-3p-inhibitor组细胞内HDAC4的表达无显著性差异。见表3、4,图4、5。
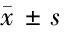
表3 免疫荧光活性
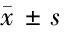
表4 Western Blot检测细胞内HDAC4蛋白表达

图4 生物信息软件检测HDAC4和MiR-145-3p潜在的结合位点

图5 Western Blot检测转染MiR-145-3p基因的蛋白表达
3 讨论
作为miRNA基因家族的成员之一,miR-145也是抑癌基因,在细胞的转移、侵袭、分化、增殖及凋亡等过程中发挥调控作用[6]。研究表明,人皮肤鳞癌的A431细胞中,miR-145通过靶向中性粒细胞胞浆因子2和IL-2调控JAK/STAT通路从而调节表皮生长因子诱导凋亡[7]。再者,miR-145能够靶向BNIP3(Bcl-2/E1B-19kDa 相互作用蛋3)以调控细胞的凋亡、线粒体功能异常、ROS等,最终调控线粒体的凋亡信号通路[8]。任明亮等[9]研究表明,miR-145-3p在多发性骨髓瘤中呈现出低表达的趋势,可能是通过靶向激活P21以及抑制ULK1/LAMP2通路而促进多发性骨髓瘤细胞的自噬、凋亡作用。但是miR-145-3p在人牙周膜成纤维细胞中的作用机制尚不清楚。本研究中,我们首先鉴定了提取的原代细胞,以保证HPDLFs细胞系无其他来源细胞,确保后续实验顺利进行。实验结果表明,miR-145-3p在HPDLFs细胞中可调控自噬,这种作用可能是通过靶向抑制HDAC4表达实现的。
自噬是在真核生物中广泛存在的维持自身稳定的机制,通过和溶酶体的互相作用,在自噬有关基因和信号分子参与下,进行降解自身过多或受损的细胞器、蛋白质等从而为细胞的生物合成提供原料和能量,对细胞分化、发育以及内环境的稳定提供重要的保障[10]。Wu等[11]曾证实miR-145-3p能够通过靶向HDAC4抑制增殖并促进骨肉瘤细胞凋亡和自噬,但对HPDLFs细胞的自噬是否有调控作用尚未可知。LC3(Microtubule-associated protein light chain 3)蛋白位于自噬小体细胞质表面,是自噬小体形成的标志,也是自噬研究中常用的标志物[12]。本研究中体外实验,miR-145-3p-inhibitor、miR-145-3p-NC、miR-145-3p-mimics分别和带有GFP-LC3的质粒共转染后,结果发现miR-145-3p-mimics组细胞中绿色荧光强度最高,而抑制miR-145-3p表达后,几乎无荧光产生,这提示在促进miR-145-3p表达的HPDLFs细胞中,LC3大量分泌,表明有大量的自噬小体形成,自噬活性升高,维持了HPDLFs细胞内环境稳态。这与Wu等[11]关于miR-145-3p能够促进细胞自噬的研究结果基本一致。同时,本实验表明,在抑制miR-145-3p表达的细胞内,自噬溶酶体数量很少,LC3蛋白表达很弱,而促进miR-145-3p表达后,自噬溶酶体大量生成,LC3蛋白表达显著增加。以上实验结果提示,miR-145-3p可能是通过提高人牙周膜成纤维细胞的自噬活性,为牙周组织再生能力提供原料和能量等保障。
为进一步探讨miR-145-3p促进人牙周膜成纤维细胞的自噬活性的可能的作用机制,我们检测其他组蛋白HDAC4是否存在靶向关系。HDAC4是一种无DNA结合活性的组蛋白去乙酰化酶,主要是通过和其他的蛋白质结合成有调解活性的抑制转录的复合物,并且还能够使组蛋白去乙酰化使染色体凝聚最终抑制转录[13]。Shao等[14]研究表明,miR-138通过HDAC4/PGRN或HDAC4/NF-kB调节类风湿关节炎中相关的炎性细胞因子,并揭示了类风湿关节炎可能通过靶向该机制来加速治疗策略的发展。Park等[15]报道在人类乳腺癌TAMR/MCF-7细胞中用HDAC抑制剂MHY218处理后自噬标记物beclin-1和LC3-Ⅱ的表达水平明显增加。本研究中我们通过靶基因预测和双荧光素酶报告系统发现,HDAC4是MiR-145-3p的直接靶向蛋白,并且二者之间具有负反馈调节作用。结果表明,在miR-145-3p基因高度表达的细胞中自噬相关蛋白Beclin-1显著升高,而抑制miR-145-3p表达后,Beclin-1表达明显下降;而P62蛋白在该2组细胞中的表达呈现出相反的趋势。提示miR-145-3p在人牙周膜成纤维细胞中促进自噬的作用可能是通过靶向抑制HDAC4的表达而实现的。
综上所述,miR-145-3p在人牙周膜成纤维细胞中发挥促进自噬的作用,可能是通过抑制靶向基因HDAC4,从而促进自噬相关蛋白Beclin-1、LC3表达并减少P62的表达而实现的。
