ADPGK-AS1调控miR-1301-3p基因表达影响胃癌细胞增殖和凋亡的机制研究
2021-06-15周鉴基王山王太洪
周鉴基 王山 王太洪
胃癌是最常见的恶性肿瘤之一,严重威胁人类生命健康。因此,探明胃癌发生发展的机制并寻找有效治疗靶点对改善胃癌患者预后十分重要。长链非编码RNA(long non-coding RNA,Lnc RNA)和微小RNA(microRNA,miRNA)是两类小分子单链非编码RNA,二者均参与调控细胞的增殖、凋亡、分化等生命过程,在肿瘤发生发展中起重要作用[1,2]。研究表明,Lnc RNA与miRNA间存在相互作用,共同影响肿瘤发生发展[3]。二磷酸腺苷依赖葡糖激酶反义RNA1(adenosine diphosphate dependent glucokinase antisense RNA 1,ADPGK-AS1)是一种新型的lncRNA。有报道,ADPGK-AS1在胃癌组织和细胞系中增加,其表达增加的胃癌患者预后较差,沉默ADPGK-AS1可抑制GC细胞增殖和迁移,可能为胃癌患者提供了新的预后生物标志物和治疗靶标[4]。但目前,ADPGK-AS1对胃癌细胞增殖、凋亡等恶性生物学行为影响的作用机制还未明确。DINAN生物信息学软件预测显示,ADPGK-AS1与miR-1301-3p的核苷酸序列存在互补配对位点,miR-1301-3p可能是ADPGK-AS1的靶基因。miR-1301-3p是一种miRNA,参与结直肠癌[5]、乳头状甲状腺癌[6]等肿瘤的发生发展。但目前,miR-1301-3p在胃癌中的作用及ADPGK-AS1与miR-1301-3p在胃癌中的相互作用笔者还未见相关报道。本研究首先检测胃癌细胞系AGS、HGC-27和Hs-746T中ADPGK-AS1和miR-1301-3p表达水平,并以HGC-27细胞为研究对象,观察沉默ADPGK-AS1、过表达miR-1301-3p及抑制miR-1301-3p对HGC-27细胞增殖和凋亡的影响。
1 材料与方法
1.1 细胞与试剂 人胃黏膜上皮正常细胞系GES-1和胃癌细胞系AGS,HGC-27和Hs-746T(中国科学院上海细胞库),胎牛血清(fetal bovine serum,FBS)、RPMI 1640培养基和LipofectamineTM2000试剂盒(北京索莱宝科技有限公司),四甲基噻唑蓝(methylthiazoletrazolium,MTT)(美国Sigma公司),Trizol试剂、逆转录试剂盒和PCR试剂盒(深圳晶美生物工程有限公司),PCR引物和兔抗剪切型聚腺苷二磷酸-核糖聚合酶(cleaved-poly adenosine diphosphate ribose polymerase,Cleaved PARP)多克隆抗体抗体(上海生工生物工程股份有限公司),小鼠抗人增殖细胞核抗原(proliferating cell nuclear antigen,PCNA)单克隆抗体和兔抗人Ki-67单克隆抗体(广州安必平医药科技公司),兔抗剪切型半胱天冬酶-3(Cleaved caspases-3)、磷酸化p38(phosphorylated p38,p-p38)和磷酸化p53(phosphorylated p53,p-p53)多克隆抗体(北京中杉金桥生物试剂公司),ADPGK-AS1小干扰RNA及乱序无意义阴性序列、miR-1301-3p 模拟物(mimcs)及阴性序列、miR-1301-3p 抑制剂及阴性对照、ADPGK-AS1过表达载体及空载体(美国Ambion公司),荧光素酶报告载体(美国Promega公司),二喹啉甲酸(bicinchoninicacid,BCA)蛋白检测试剂盒、膜联蛋白V(annexin V)-异硫氰酸荧光素(FITC)/碘化丙啶(propidium iodide,PI)细胞凋亡试剂和双荧光素酶活性检测试剂盒(上海碧云天生物技术有限公司)。
1.2 实验方法
1.2.1 细胞培养:人胃黏膜上皮正常细胞系GES-1和胃癌细胞系AGS、HGC-27和Hs-746T均用含10 % FBS的RPMI 1640培养基培养,培养箱环境为37℃、CO2体积分数5%、湿度97%。每2~3天更换1次新鲜培养基。待细胞融合至80%~90%时,0.25%胰蛋白酶溶液消化细胞,以1∶3比例进行传代培养。
1.2.2 实时荧光定量PCR(RT-qPCR)检测细胞中ADPGK-AS1和miR-1301-3p表达:收集细胞,加入Trizol试剂,提取细胞中总RNA。参照逆转录试剂盒说明书,将RNA逆转录为cDNA。然后以cDNA为模板,进行扩增。扩增程序:95℃预变性1 min,95℃变性15 s,60℃退火30 s,72℃延伸30 s,共45个循环。引物序列:ADPGK-AS1上游5’-G GCTTGCCGGCCAAGTGCAGTAGT-3’,下游5’-CGTGACGCGCCAATGCGCGATGCT-3’;GAPDH上游5’-GGCCGCAAAGCTGGCGCGTGC-3’,下游5’-CGTGCGAACGCTGACGTGACG-3’;miR-1301-3p上游5’-GTGCGTGCAAACGCTGCGTG-3’,下游5’-GCAACGTAAGCTG CAGCTCG-3’;U6上游5’-CGTGCAACGTACGTCGTAGT-3’,下游5’-CGTAACCCGTGTCAC GTACC-3’。ADPGK-AS1以GAPDH为内参,miR-1301-3p以U6为内参,2-△△Ct法计算miR-1301-3p和 mRNA的相对表达水平。
1.2.3 细胞转染与分组:对数增殖期的HGC-27细胞,以每孔1×105个细胞接种于6孔板中。待细胞融合至60%时,分别将ADPGK-AS1小干扰RNA(si-ADPGK-AS1组)、乱序无意义阴性序列(si-con组)、miR-1301-3p mimcs(miR-1301-3p组)、mimcs阴性对照(miR-con组)、与ADPGK-AS1过表达载体(pcDNA-ADPGK-AS1组)及空载体(pcDNA组)、ADPGK-AS1小干扰RNA与miR-1301-3p抑制剂(si-ADPGK-AS1+anti-miR-1301-3p组)、ADPGK-AS1小干扰RNA与miR-1301-3p抑制剂阴性对照(si-ADPGK-AS1+anti-miR-con组)转染至HGC-27细胞。具体转染过程参照LipofectamineTM2000试剂盒说明书。同时设置空白对照组(NC组):HGC-27细胞正常培养,不进行任何操作。转染24 h后,收集细胞用于后续实验。
1.2.4 MTT检测细胞增殖:各组HGC-27细胞,以每孔5×103个细胞接种于96孔板中。每组设置3个复孔。培养箱中培养24 h,每孔加入20 μl的MTT(5 mg/ml)。培养箱中继续孵育4 h后,吸弃培养基,加入150 μl二甲基亚砜。振荡溶解结晶紫后,混匀,于全自动酶标仪490 nm处测定各孔吸光度值(absorbance,A)。细胞存活率(%)=A实验组/A空白对照组×100 %。实验重复3次。
1.2.5 流式细胞仪检测细胞凋亡:各组HGC-27细胞,以每孔2.5×104个细胞接种于24孔板中。每组设置3个复孔。培养24 h后,胰蛋白酶消化,收集细胞。参照Annexin V-FITC/PI试剂盒说明书,取1.0×106个细胞,加入500 μl结合缓冲液,移液器轻轻吹打,混悬细胞。加入10 μl Annexin V-FITC,混匀,避光孵育10 min。加入5 μl PI,混匀,避光孵育5 min,上流式细胞仪检测。细胞凋亡率(%)=(早期凋亡细胞数+晚期凋亡细胞数)/总细胞数×100 %。实验重复3次。
1.2.6 Western blot法检测蛋白表达:收集各组细胞,加入蛋白裂解液,置于冰上裂解30 min。12 000 r/min离心10 min,上清液即为提取细胞总蛋白。BCA蛋白试剂盒测定蛋白浓度后,进行定量。取适量蛋白溶液,加入上样缓冲液,100℃煮沸5 min。然后以每孔30 μg蛋白行十二烷基磺酸钠-聚丙烯酰胺凝胶电泳。电泳后,用转膜仪将分离蛋白湿转至聚偏乙烯二氟膜,并置于5%脱脂奶粉中封闭2 h。洗膜后,分别置于PCNA、Ki-67、Cleaved PARP、Cleaved caspases-3、p-p38和p-p53抗体孵育液中,4℃孵育过夜。洗膜后,置于二抗孵育液中,37℃孵育1 h。洗膜后,滴加显影液避光显影,凝胶成像系统曝光拍照。以β-actin为内参,Image J软件分析目的蛋白条带灰度值。
1.2.7 双荧光素酶报告基因检测实验:采用LipofectamineTM2000试剂盒将荧光素酶报告载体psiCHECK2-ADPGK-AS1-野生型(WT)和psiCHECK2-ADPGK-AS1-突变型(MUT)分别与miR-1301-3p mimic、mimic阴性对照转染至HGC-27细胞。转染24 h 后,收集细胞。参照双荧光素酶活性检测试剂盒操作说明,检测荧光素酶活性。
2 结果
2.1 胃癌细胞中ADPGK-AS1和miR-1301-3p表达 与GES-1细胞比较,胃癌细胞AGS、HGC-27和Hs-746T中ADPGK-AS1表达水平升高(P<0.05),miR-1301-3p表达水平降低(P<0.05)。由于胃癌细胞HGC-27中ADPGK-AS1和miR-1301-3p表达差异最显著,因此选择HGC-27细胞进行后续实验。见表1。
表1 胃癌细胞中ADPGK-AS1和miR-1301-3p表达
2.2 沉默ADPGK-AS1抑制HGC-27细胞增殖和诱导胃癌细胞凋亡 与si-con组比较,si-ADPGK-AS1组ADPGK-AS1、HGC-27细胞存活率及PCNA、Ki-67和Cleaved caspase-3蛋白表达降低(P<0.05),细胞凋亡率和Cleaved PARP蛋白表达升高(P<0.05)。NC组与si-con组各检测指标差异无统计学意义(P>0.05)。见图1,表2。
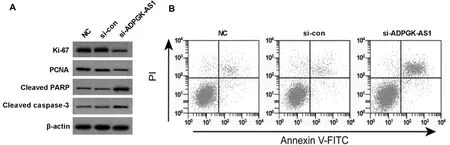
图1 Western blot检测HGC-27细胞PCNA、Ki-67、Cleaved PARP和Cleaved caspase-3蛋白表达和流式细胞术检测HGC-27细胞凋亡
表2 沉默ADPGK-AS1对HGC-27细胞增殖和凋亡的影响
2.3 ADPGK-AS1 靶向调控miR-1301-3p表达 DINAN生物信息学软件预测显示,ADPGK-AS1与miR-1301-3p的核苷酸序列存在互补配对位点。与miR-con组比较,miR-1301-3p组共转染ADPGK-AS1-WT 的细胞荧光素酶活性降低(P<0.05),而共转染ADPGK-AS1-MUT的细胞荧光素酶活性无显著变化(P>0.05)。si-ADPGK-AS1组miR-1301-3p水平高于si-con组(P<0.05),pcDNA-ADPGK-AS1组miR-1301-3p水平低于pcDNA组(P<0.05)。见图2,表3、4。
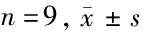
表3 双荧光素酶报告实验

图2 ADPGK-AS1与miR-1301-3p核苷酸序列存在的互补配对位点
2.4 过表达miR-1301-3p抑制HGC-27细胞增殖和诱导HGC-27细胞凋亡 与miR-con组比较,miR-1301-3p组HGC-27细胞存活率及PCNA、Ki-67和Cleaved caspase-3蛋白表达降低(P<0.05),miR-1301-3p、细胞凋亡率和Cleaved PARP蛋白表达升高(P<0.05)。NC组与miR-con组各检测指标差异无统计学意义(P>0.05)。见图3,表5。
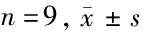
表4 ADPGK-AS1调控miR-1301-3p的表达
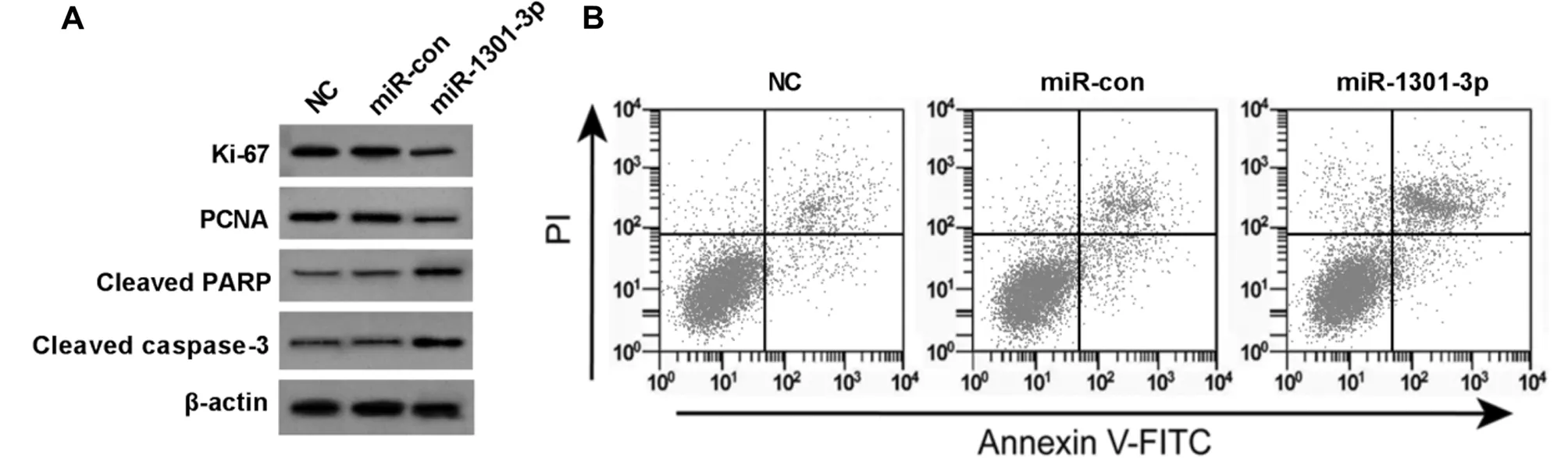
图3 Western blot检测HGC-27细胞PCNA、Ki-67、Cleaved PARP和Cleaved caspase-3的表达和流式细胞术检测HGC-27细胞凋亡
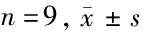
表5 过表达miR-1301-3p对HGC-27细胞增殖和凋亡的影响
2.5 抑制miR-1301-3p降低沉默ADPGK-AS1对HGC-27细胞增殖和凋亡的影响 与si-ADPGK-AS1+anti-miR-con组比较,si-ADPGK-AS1+ anti-miR-1301-3p组HGC-27细胞存活率及PCNA、Ki-67和Cleaved caspase-3蛋白表达升高,差异有统计学意义(P<0.05),miR-1301-3p、细胞凋亡率和Cleaved PARP蛋白表达降低,差异有统计学意义(P<0.05)。见图4,表6。
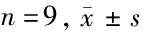
表6 抑制miR-1301-3p降低沉默ADPGK-AS1对HGC-27细胞增殖和凋亡的影响
2.6 ADPGK-AS1调控miR-1301-3p对HGC-27细胞p38MAPK信号途径的影响 与si-con组比较,si-ADPGK-AS1组p-p38和p-p53蛋白表达升高(P<0.05)。与si-ADPGK-AS1+anti-miR-con组比较,si-ADPGK-AS1+ anti-miR-1301-3p组p-p38和p-p53蛋白表达降低(P<0.05)。si-ADPGK-AS1组与si-ADPGK-AS1+anti-miR-con组p-p38和p-p53蛋白表达比较差异无统计学意义(P>0.05)。见表7,图5。
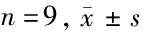
表7 抑制miR-1301-3p对沉默ADPGK-AS1的HGC-27细胞p-p38和p-p53蛋白的影响
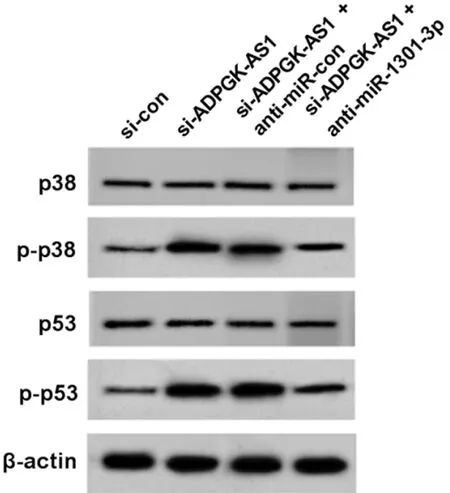
图5 Western blot检测HGC-27细胞p-p38和p-p53蛋白表达
3 讨论
Lnc RNA在肿瘤的发生发展中发挥重要调控作用,是肿瘤治疗的潜在靶点。ADPGK-AS1是近年来新发现的一种Lnc RNA,参与多种肿瘤的发展进程。Song等[7]研究显示,ADPGK-AS1在胰腺癌组织和细胞系中表达升高,沉默ADPGK-AS1表达通过靶向上调miR-205-5p表达抑制肿瘤细胞增殖、迁移和侵袭及上皮-间质转化过程。Luo等[8]研究显示,骨肉瘤组织和细胞中ADPGK-AS1表达升高,抑制ADPGK-AS1可通过靶向上调miR-542-3p表达降低骨肉瘤细胞增殖、迁移和侵袭能力,并促进骨肉瘤细胞凋亡,为骨肉瘤治疗提供了新的治疗靶点。
本研究显示,胃癌细胞系中ADPGK-AS1表达升高,沉默ADPGK-AS1表达可抑制胃癌HGC-27细胞增殖,并诱导HGC-27细胞凋亡,与报道结果[4]一致,提示ADPGK-AS1是胃癌治疗的潜在靶点,但其作用机制还有待探讨。DNA损伤与肿瘤的发生发展密切相关。细胞受损后,DNA进行修复,以恢复原来的结构和功能。当DNA修复过程受阻时,会导致其结构或功能发生改变,从而引起细胞死亡或肿瘤细胞异常增生[9]。PCNA是真核细胞DNA复制过程中的一个关键因子,参与DNA修复,其还可与多种蛋白因子结合参与细胞周期调控、细胞凋亡等生命过程,与肿瘤的恶性程度正相关[10]。Ki-67是增殖细胞相关的核抗原,其表达越高,肿瘤细胞生长越快[11]。PARP参与细胞DNA修复和细胞凋亡。Caspases级联反应在诱导细胞凋亡过程中起重要作用。caspases-3是caspases级联反应的关键调控分子,可放大级联反应,是细胞凋亡的执行者。本研究显示,沉默ADPGK-AS1表达后,HGC-27细胞中PCNA、Ki-67和Cleaved caspase-3蛋白表达降低,Cleaved PARP蛋白表达升高,提示沉默ADPGK-AS1表达可能通过抑制PCNA、Ki-67和Cleaved caspase-3蛋白表达并促进Cleaved caspases-3蛋白表达来抑制HGC-27细胞增殖和诱导细胞凋亡。
为探讨ADPGK-AS1影响胃癌细胞增殖和凋亡的分子机制,本研究通过生物信息学软件预测显示,miR-1301-3p可能ADPGK-AS1的靶基因。研究显示,miR-1301-3p在前列腺癌细胞和组织中呈高表达,其通过抑制GSK3β和SFRP1并激活Wnt途径来促进前列腺癌干细胞的扩增,发挥致癌基因作用[12]。然而,miR-1301-3p在乳腺癌组织和细胞系中表达降低,其靶向抑制ICT1表达诱导乳腺癌细胞周期停滞和凋亡来抑制细胞增殖,发挥抗乳腺癌作用,可能是乳腺癌的治疗靶点[13]。上述研究表明,miR-1301-3p在不同肿瘤中发挥的作用不同。目前,miR-1301-3p在胃癌中发挥的作用还未知。
本研究显示,胃癌细胞系中miR-1301-3p表达降低,过表达miR-1301-3p可抑制胃癌细胞增殖,并诱导细胞凋亡,提示其作为抑癌基因参与胃癌发生发展。双荧光素酶活性检测结果显示,miR-1301-3p mimics可降低ADPGK-AS1野生型细胞的荧光素酶活性,且上调细胞中ADPGK-AS1表达后,miR-1301-3p 表达降低,而下调ADPGK-AS1表达后,miR-1301-3p 表达升高,证实了ADPGK-AS1在胃癌HGC-27细胞中靶向负调控miR-1301-3p表达。与胃癌细胞系中ADPGK-AS1表达降低,而miR-1301-3p表达升高一致。本研究还显示,抑制miR-1301-3p表达降低了沉默ADPGK-AS1对HGC-27细胞增殖、凋亡及相关蛋白PCNA、Ki-67、Cleaved PARP和Cleaved caspases-3表达的影响,提示沉默ADPGK-AS1通过靶向上调miR-1301-3p表达抑制HGC-27细胞增殖,并诱导细胞凋亡。
p38MAPK信号通路是丝裂素活化蛋白激酶(MAPK)家族的重要成员,参与细胞生长、分化和凋亡等过程,在肿瘤发生发展中起重要作用。p38MAPK活化后,可使p53磷酸化,进而诱导肿瘤细胞凋亡。研究显示,p38MAPK信号通路的激活可抑制胃癌细胞增殖,并诱导细胞凋亡[14]。本研究显示,沉默ADPGK-AS1可促进HGC-27细胞中p-p38和p-p53蛋白表达,提示沉默ADPGK-AS1可能通过激活p38MAPK信号通路抑制HGC-27细胞增殖,并诱导细胞凋亡。本研究还显示,抑制miR-1301-3p表达降低了沉默ADPGK-AS1对HGC-27细胞p-p38和p-p53蛋白表达的促进作用,提示沉默ADPGK-AS1通过靶向上调miR-1301-3p表达进而激活p38MAPK信号通路发挥抗胃癌作用,p38MAPK信号通路的激活可能是沉默ADPGK-AS1通过靶向上调miR-1301-3p表达抑制胃癌细胞增殖并诱导细胞凋亡的作用机制之一。
综上所述,ADPGK-AS1在胃癌细胞中呈高表达,沉默其表达可抑制胃癌细胞增殖,并诱导细胞凋亡,作用机制可能与靶向上调miR-1301-3p表达进而激活p38MAPK信号通路有关。
