新形势下中国猪场的非洲猪瘟防控
2021-06-10陈维谭涛
陈维 谭涛

摘 要:自2018年我国首次确诊非洲猪瘟疫情以来,各规模化猪场纷纷进行了非洲猪瘟防控的探索,根据非洲猪瘟病毒通过接触传播且传播速度慢的流行特点,有关猪场发明了精准清除策略,推广后得到了业内人员的广泛认可。然而随着非洲猪瘟病毒弱毒株和基因缺失株(又称为“疫苗株”)的出现,这一方法已经不如之前那样有效。本文通过对非洲猪瘟病毒的病原学、流行病学、实验室诊断以及精准清除策略的回顾,分析了当前猪场存在非洲猪瘟病毒强毒株、弱毒株和基因缺失株并存和干扰等现状,总结了非洲猪瘟诊断与防控策略。根据目前的情况,生物安全依然是预防非洲猪瘟最根本的方法,精准清除需要更加严格的采样和检测,对感染非洲猪瘟病毒弱毒株和疫苗株的猪群进行更专业的精准清除,同时需要加强对各种应激因素的控制,提高猪的抵抗力,减少非洲猪瘟病毒弱毒株潜伏感染猪的排毒量。希望本文能为我国防控和根除非洲猪瘟提供有益的参考。
关键词:非洲猪瘟;弱毒株;基因缺失株;精准清除;应激;综合防控
中图分类号:S851.33 文献标志码:A 文章编号:1001-0769(2021)02-0106-10
1 非洲猪瘟病毒介绍
1.1病毒和基因组
非洲猪瘟(African Swine Fever,ASF)是由非洲猪瘟病毒(African Swine Fever Virus,ASFV)感染猪后引起的一种急性、热性、高度传染性和高致死性烈性传染病[1],迄今为止尚无有效疫苗和药物可以预防与控制。目前已知的ASFV有8个血清群[2]和24种基因型[3],我国主要流行的是基因Ⅱ型[4]。ASFV的基因组大小约170 kb~190 kb,能够编码200多种蛋白质,其中包括50多种结构蛋白。电镜下ASFV粒子呈正二十面体,直径约为200 nm,主要由囊膜、衣壳、内膜、内核心壳和基因组五部分组成[5]。
1.2 感染机理
ASFV主要通过直接接触途径侵入猪的呼吸道或消化道,病毒侵入猪体后在鼻咽部或扁桃体等部位进行增殖,随后大量增殖的病毒随着血液和淋巴感染全身组织和器官,引起组织器官出血、血栓、浆液性渗出,甚至急性坏死。有研究表明,单核-巨噬细胞表面的CD163分子与ASFV的感染相关[6],ASFV感染机体主要通过内吞作用实现,ASFV进入猪的机体后立即侵染机体的单核-巨噬细胞,在胞饮泡或内吞体内完成内体成熟过程,随之启动病毒的增殖。病毒粒子脱去病毒囊膜后,暴露的病毒内膜与体内膜融合,释放出病毒基因组,基因组在细胞质中完成复制、转录和翻译等一系列过程,最后,基因组和蛋白质组装完成后通过动力蛋白的运输作用,将组装完整的病毒粒子释放到细胞外[7],进行下一次感染。
1.3 理化特性
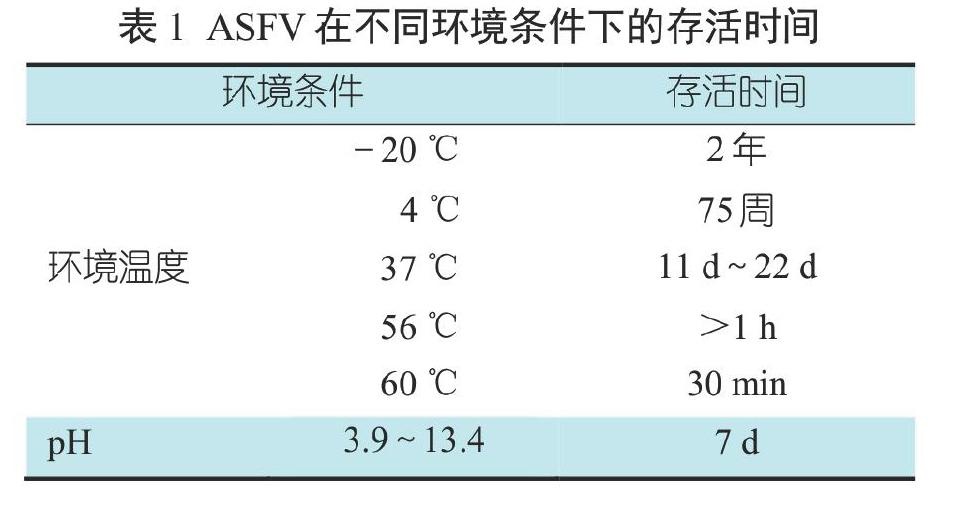
ASFV是囊膜病毒,不耐热、不耐强酸和强碱,可耐受的pH范围为3.9~11.5。在不同环境中,ASFV存活时间不同(表1)。ASFV在低温下稳定,对高温敏感,56 ℃ 70 min或60 ℃ 20 min可灭活。该病毒在血清中较稳定,在含25%血清温度为37 ℃的溶液中半衰期为24 h,在血清中耐酸碱性也增强,如在pH 13.4下仍可存活;在血液中,ASFV在低温条件下可存活6年,在室温下可存活数周。ASFV在猪的粪便和尿液中存活时间较短,在空气中的存活时间为25 d~30 d(表2),在猪肉制品中可长时间存活(表4),在猪的冷冻组织器官中可存活 6~12个月[8](表3)。
ASFV对常规消毒剂敏感,常见的消毒剂如果正确使用,均能有效杀灭该病毒(表5)。
2 非洲猪瘟的流行情况
2.1 非洲猪瘟的流行历史
ASF疫情最早在1921年被肯尼亚报道,随后长时间在撒哈拉以南地区的猪群中流行;该病于1957年首次传入葡萄牙等欧洲国家,随后在法国、荷兰、比利时、意大利等国家的猪群中蔓延;1971年相继感染古巴、多米尼加、海地和巴西等南美洲国家的猪群。随着国际贸易越来越频繁,ASFV在2007年传入格鲁吉亚、亚美尼亚和阿塞拜疆,在2009年远距离传播到俄罗斯,2012年传入乌克兰,2013年传入白俄罗斯,2014年传入立陶宛、波兰、拉脱维亚、爱沙尼亚等欧盟国家,2016年传入摩尔多瓦,2017年传入捷克、罗马尼亚。2018年8月,我国首次报道了ASF疫情[9]。2019年,老挝、越南、柬埔寨、朝鮮、蒙古国、缅甸、韩国、菲律宾、印度尼西亚等很多国家的猪群先后暴发了ASF疫情。截至2019年底,世界动物卫生组织公告了全球有25个国家和地区的猪暴发了ASF疫情[10],给这些地区的养猪业造成了巨大损失。
2.2 非洲猪瘟在我国流行情况
目前,在我国流行的ASFV属于ASFV基因Ⅱ型,与俄罗斯克拉斯诺达尔的ASFV 2012毒株和伊尔库兹克的ASFV 2017毒株同源性为100%[10-11]。 ASFV传入我国后迅速在猪群中传播,在之后一年多的时间内席卷全国,疫情的快速流行导致我国的存栏母猪数大幅度降低,养猪业遭受了巨大的损失。
据权威媒体和业内人员统计,2020年底至2021年初,ASF疫情再次暴发,导致我国东北、华北等地区集团化和规模化猪场的猪群损失达20%~30%;在华东地区,山东省的胶东半岛和鲁南地区猪群受损高达50%,江苏省多个地区的养猪企业母猪减少60%~70%,其中不乏集团化猪场的育肥场受重创而清场;河南省和湖北省受损较大,母猪损失约30%~50%,而且普遍反映精准清除措施防控效果不理想。除了ASFV的强毒株以外,弱毒株的感染和发病也造成了重大的影响。
2.3 传染源和传播途径
猪是ASFV的天然宿主,家猪和野猪均易感,软蜱是ASFV的贮存宿主。感染猪和感染猪的肉制品均为传染源,人员、车辆、物资被感染猪污染后,在短时间内也会成为传染源。ASFV以直接接触为主要传播途径,也可以通过气溶胶发生短距离的传播[12]。根据我国养猪业和饲养环境的特殊性,ASFV在我国的传播方式主要有五种:一是活猪的跨区域调运,二是散养户的泔水喂猪,三是人员、车辆和物资带毒后的交叉传播,四是引种或外购仔猪的传播,五是饲养密集的地区或热带地区,蚊蝇、老鼠或飞鸟等携带非洲猪瘟病毒后的机械传播[13]。
3 非洲猪瘟的诊断
3.1 临床诊断
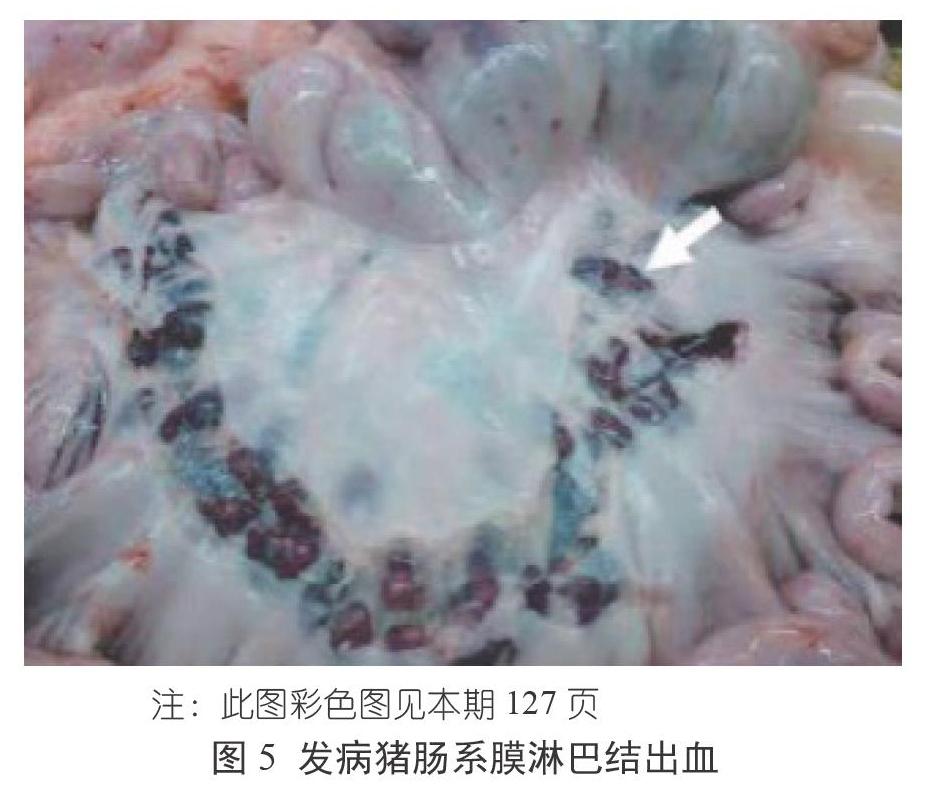
ASF的临床表现可分为最急性型、急性型、亚急性型、慢性型和亚临床型五种。2021年以前,我国流行的ASF主要表现为最急性型和急性型,临床表现为:猪突然死亡,病猪出现高热、扎堆、厌食和呼吸急促,耳、四肢和腹部皮肤发绀等症状,死亡率达100%(图1~图3)。 临床解剖可见肠系膜淋巴结出血、十二指肠出血、脾脏高度肿大、肺炎、肾脏严重出血等症状(图4~图7)。2021年以来,我国多个集团化猪场相继出现感染猪发病率高但死亡率低、多数猪场精准清除失败等现象。我国军事科学院兽医研究所分离到一株ASFV的自然变异弱毒株,该毒株感染猪后引发的临床症状不典型、致死率低,因此在临床上容易与其他疾病混淆,这会大大增加临床诊断和精准清除的难度。目前来看,ASFV弱毒株感染后猪会出现皮肤溃烂、关节炎和严重的呼吸道感染等问题。
3.2 实验室诊断
随着在我国猪群中流行的ASFV出现自然弱毒株和疫苗毒株,抗原检测和血清学检测同时进行,这对我国当前精准清除ASFV非常重要。目前,国际上常用的ASFV实验室检测方法主要有病原学检测和血清学检测,病原学检测方法包括病毒分离红细胞吸附(Virus Isolation-Hemadsorption,VI-HAD)、酶免疫组化(Immuno-Enzyme Histonchemistry,IEH)、聚合酶链式反应(PCR)、直接免疫荧光 (Direct Immunofluorescence,DIF)、荧光定量PCR(qPCR)等,其中qPCR技术是目前实验室应用最广泛的检测技术。血清学检测方法主要包括ELISA(间接和阻断ELISA)、免疫印迹试验(IB)和胶体金试纸条等。
VI-HAD、DIF等方法适用于ASFV急性病例的快速诊断[15];qPCR技术敏感性和特异性高,可一次性快速检测多种样品,操作简单,检测量大,是目前实验室检测采用的主要方法;环介导等温扩增法(Loop isothermal AMPlification,LAMP)可在等温(60 ℃~65 ℃)条件下高效、特异、快速扩增目的基因,适用于ASFV的现场诊断。
2019年,中国动物疫病预防控制中心多次筛选并推荐了目前市场上销售的28种荧光定量PCR试剂盒和6种等温扩增类试剂盒,为广大猪场实验室进行ASFV的快速诊断提供了可靠的方法和试剂盒[16-17]。
ASFV弱毒株出现后,实验室检测手段也必须随之改进。首先,弱毒株的排毒是间歇性的,因此要增加采样的频率。感染ASFV弱毒株的猪在应激后容易出现临床症状,因此可以在猪场普免常规疫苗后观察,对出现采食量下降、卧地不起和精神沉郁等异样的猪重点排查,可以采用同时收集口鼻拭子、血液和肛拭子的方法,有条件的猪场可以考虑扁桃体刮片采样。最近,有专家提出了腹股沟淋巴结穿刺采样的方法,能更准确地检出带毒猪。
对于ASFV弱毒株还有一个好办法进行排查,即检测抗体。由于ASFV弱毒株的间歇性排毒,抗原检测法很可能检测不到带毒猪,但是我们可以通过采血进行ELISA方法检测ASFV抗体。目前的难点是如何找到良好的抗体检测试剂盒。采用抗原加抗体同时检测将是筛查ASFV弱毒株最好的方法。
4 非洲猪瘟的精准清除
4.1 非洲猪瘟精准清除的理论基础
ASFV的精准清除技术俗称“拔牙”,是中国养猪业和兽医界对ASF等重大动物疫病防控在理论与实践上的创新,实质上这是特定猪场内ASFV的净化手段,该方法是通过及时清除阳性猪、防止病毒扩散从而达到净化ASF和保住猪群的目的。
ASFV的感染静默期比潜伏期长1 d~3 d,被感染的猪刚开始表现临床症状还未向外界排毒,因此我们可以利用这一空当及时清除被感染的猪,防止病毒扩散。ASFV的潜伏期通常为5 d~19 d,该病毒有两个检测窗口期,分别是感染第3天左右(鼻、口腔中可检测出病毒)和感染第5天左右(在血液中可检测到病毒),这两个窗口期决定了ASFV检测是处于钻石期、黄金期还是黄铜期、烂铁期(表6)。
随着2021年ASFV自然弱毒株的出现以及疫苗毒株的干扰,对原有的精准清除和实验室诊断提出了更高的要求。2021年3月,针对目前猪场流行的ASFV弱毒株(低致病性毒株)的情况,华南农业大学张桂红教授提出如下清除建议:
第一,若猪场确诊為ASFV低致病性毒株(弱毒株或疫苗毒株),立即按栋或区域采集40头猪的血液样本评估本场的感染率;
第二,进行抗原和抗体的检测,若阳性率小于10%,按照原有的精准清除方案进行“拔牙”;
第三,进行抗原和抗体的检测,若阳性率大于20%,按照生产线或整栋清空,分区洗消烘,同时加大阳性猪群的淘汰力度,尽早实现全场净化。
4.2 精准清除的关键步骤
4.2.1 及时发现
及时发现异常猪对精准清除策略的实施至关重要,特别是被ASFV低致病性毒株感染后,猪表现出的亚临床感染不容易被觉察。一般情况下,被ASFV感染后,母猪和育肥猪先发病,常见症状有采食量下降、不食、发烧、精神沉郁、呕吐、喜卧、不明原因突然死亡、母猪流产等,因此,饲养人员或巡场人员发现异常问题要及时上报。
4.2.2 生产静默
生产静默的目的是禁止饲养人员和猪流动,防止ASFV在场内二次传播,最大限度地减少病毒在场内的扩散。除了喂料等必要工作外,在生产静默期停止其他所有工作。
4.2.3 采样检测与阳性猪的淘汰
样品采集可以采集唾液拭子、鼻腔拭子、肛门拭子和尾尖血拭子等。血液中的病毒含量最高,唾液拭子的病毒含量低于血液的,但病毒在唾液中的出现时间早于在血液中的,而且排毒量高于肛门的排毒量。因此,唾液拭子是之前最常见、最高效的方法。值得注意的是,早期感染病例唾液中的病毒含量较低,而且病毒容易受到蛋白酶水解,因此,唾液拭子样品要加入样品保护剂。目前ASFV强毒株、弱毒株、疫苗毒株的出现大大增加了ASFV精准检测的难度,因此很多实验室不建议单纯采集某个部位的样本,以免造成漏检。为了保证检测结果的准确性,很多实验室建议采用三种拭子(肛门拭子、尾尖血拭子、鼻腔拭子)组合的方式进行采样,以便最大限度地提高检测的准确性,避免出现假阴性的问题。
ASFV病原检测以实时荧光定量PCR检测为主。一般以栋舍为单位,阳性率超过5%且分布较为分散时,则对该栋猪舍的猪全群扑杀。对于阳性率较低的猪舍,根据检测结果对阳性猪和其前、后、左和右的猪以及育肥猪栏整栏剔除,同时每隔2 d开展全群及环境普检,连续监测3~4周,如果连续3~4周都是阴性,说明本次精准清除已经成功;如果结果依然是ASFV阳性,说明该猪场的精准清除失败,可能需要全场清群进行复养。
5 非洲猪瘟的综合防控措施
5.1 生物安全措施与设施改进
5.1.1 设施改造
严格的猪场生物安全措施是防控ASF最根本的手段。大部分老式猪场需要改造外部和内部的生物安全设施。猪场外围重要的改进点有:建场外洗消烘中心、人员和物资场外隔离消毒点、实心外墙、出猪通道、出猪台和料塔等;猪场内重要的改进点有:实心墙猪栏、场内路面硬化以及净道和污道分离、场内赶猪连廊、种猪独立料槽等关键点(图8~图13);同时补充必要的设备和物资如暖风烘干机、喷火枪、死猪运输手推车和不同颜色的工作服等。
5.1.2 生物安全风险点控制
生物安全风险点控制要把好入场关和出场关,对进入猪场的人员、物资、饲料、种猪等进行严格隔离消毒,检测合格后方可进入;出售的猪、淘汰猪和病死猪出场也至关重要,避免场内和场外交叉污染,出猪通道要严格消毒。
人员、物资、饲料等入场,外部人员或猪场员工进场需提前24 h向猪场相关负责人提出申请,隔离检测合格后方可进场,人员在进场前3 d不得去其他猪场、屠宰场、无害化处理场及动物产品交易场所等生物安全高风险场所。猪场供给品、饲料、引种入场等要进行严格消毒与隔离,检测合格后才能进场。
卖猪时猪需要经专用出猪通道和出猪台出场,出场后严格消毒猪经过的区域。装死猪车和运猪粪车专场专用,运输和交接过程中禁止与外部车辆接触,交接地点离猪场越远越好(至少大于1 km);车辆每次使用完后,必须及时清洗、消毒及干燥,车辆经过的道路也要进行消毒处理。
加强员工食堂的管理也很重要。猪场应该在生产区外面设置厨房等生活区,厨房工作人员不能进场。食材管理要注意将猪肉和鸡肉混放在冷柜里,蔬菜消毒后才可食用。
除此之外,猪场还需要杀灭蚊蝇、灭鼠和防鸟类;猪场内应该禁止饲养狗、猫等小动物。
5.2 后备猪的引进
后备种猪引进后隔离和驯化是重点,科学合理的引进后备猪,猪场应该到有资质的种猪场引种,引种前应先评估该种猪场猪群的健康状况。
引种前要进行隔离舍的清洗、消毒、干燥及空栏等准备工作,事先做好药物、器械、饲料、用具等物资的消毒及储备,隔离舍应有专人负责后备猪的饲养管理工作。
在隔离期间要密切观察引进猪的健康状况,适当添加药物进行支原体肺炎、回肠炎等细菌性疾病的防控。隔离结束后对引进的后备猪进行健康评估,重点进行猪口蹄疫、猪瘟、非洲猪瘟、猪繁殖与呼吸综合征、猪流行性腹泻及猪传染性胃肠炎等疾病的抗原检测,同时还要进行猪伪狂犬gE抗体、口蹄疫O型/口蹄疫A型抗体和猪瘟抗體等检测。
5.3 控制猪群应激因素,降低非洲猪瘟弱毒株的危害
5.3.1 应激的危害
应激是万病之源,在现代养猪生产过程中,应激始终伴随着猪的整个生长过程(图14)。猪群受到应激后,会出现抵抗力下降、生产性能下降等问题,更容易被病原感染,原本的潜伏感染容易加重,从而表现出临床症状。有研究表明,猪群受到外源刺激后,交感神经兴奋引起肾上腺髓质释放儿茶酚胺,分解代谢加强(脂肪氧化、糖元分解),同时皮质醇大量释放,肝糖元的异生作用加强,蛋白质分解加速,具体表现为体温升高、呼吸加快,免疫功能受抑制,生长和繁殖机能减慢;最后肾上腺皮质功能衰竭,体脂蛋白质分解,导致体重下降[18]。在ASFV弱毒株和疫苗毒株感染猪群后,猪群带毒时间长并长期处于隐性带毒状态,这些猪极其脆弱,稍微受到应激就出现发病状态,甚至急性死亡,业内俗称为“玻璃猪”。减少猪群应激可以增强猪的抵抗力,减少甚至杜绝“玻璃猪”的情况。
5.3.2 应激的控制措施
猪出现应激后,首先要消除或减少应激源,改善饲养环境(如温度、密度、湿度和通风),同时要加强营养,补充复合维生素(如强力拜固舒)、功能性氨基酸和电解质等营养物质[18]。
(1)补充复合维生素:猪发生应激时,皮质醇大量产生,肝糖原不足,脂肪和蛋白质的糖异生途径加强,热休克蛋白合成增多。在热应激后的多种代谢途径中,维生素均以辅酶和催化剂的形式参与其中,因此在应激环境中,为猪群添加复合维生素是必要的(如强力拜固舒)。有研究表明,食用比膳食推荐量(Recommended Dietary Allowance,RDA)多的维生素C有助于维持肾上腺功能,防止皮质醇水平过高;维生素B1可以保护肾上腺功能免于衰竭;维生素B12可以改变皮质醇分泌的高峰,使生物节律更加规律[18]。
(2)补充能量和电解质:热应激导致猪出现呼吸性碱中毒、体液代谢紊乱、离子丢失,因此补充能量和电解质尤为重要;在母猪分娩时,给母猪补充能量和电解质(如科特壮)可提高母猪的产仔速度和产仔存活率。
(3)添加功能性氨基酸:有研究表明,在猪的肠外营养液中添加亮氨酸、异亮氨酸、缬氨酸等高浓度支链氨基酸,可减少骨骼肌的分解,极大改善全身蛋白质平衡。猪在遇到应激时会出现蛋白质的分解与丢失,而营养支持可以增加其治愈率。
(4)保证肠道健康:猪肠内营养的重要作用是保持小肠黏膜的完整性和屏障功能,维持黏膜抗体IgA的含量,同时抑制各种前炎症介质的释放,从而调节分解代谢,因此肠道健康对于动物机体来说至关重要[19]。
5.4 控制免疫抑制性疾病,减少ASFV弱毒株的危害
5.4.1 免疫抑制产生的原因
猪场常见的免疫抑制性疾病主要有非洲猪瘟(ASF)、猪繁殖与呼吸综合征、猪圆环病毒病等疾病。正常情况下,猪的免疫器官(如骨髓、胸腺、淋巴结、脾脏等)在淋巴细胞、单核巨噬细胞等免疫细胞的参与下,共同完成对抗原(病原、疫苗)的识别和应答,这时机体会产生相应的抗体和细胞因子,进而对抗原进行杀灭和清除。当ASFV、PRRS病毒、猪圆环病毒2型等病原感染猪后,主要在猪的免疫细胞中复制,病原的大量复制会干扰免疫细胞的功能和抗原的递呈,抑制或阻断抗体的生成,从而导致暂时性或永久性的免疫抑制,机体抗病力下降,甚至丧失。
5.4.2 免疫抑制性疾病对猪群的危害
发生猪繁殖与呼吸综合征、猪圆环病毒病等免疫抑制性疾病后,机体的免疫功能会减弱,容易出现混合感染情况,而且多病原的混合感染会加重病情,严重者失去治疗价值。免疫抑制性疾病可导致繁殖母猪抗病力明显下降,出现发情和生产障碍、配种率低、流产、返情、产死胎、产弱胎及产健仔少等现象,母源抗体保护力减弱会导致仔猪发病率升高等[22]。猪感染免疫抑制性疾病后会增加ASF防控的难度,也会使处于ASFV潜伏感染状态的猪更易出现临床症状,加大ASFV的排毒量,并延长排毒时间,增加精准清除的难度。
免疫抑制性疾病会干扰疫苗免疫和抗生素治疗的效果,增加猪场疫苗和药物的成本。在养猪生产中,当存在免疫抑制性疾病时,如果不能及时找出免疫抑制性疾病的根源,盲目加大疫苗免疫剂量,会加重猪免疫器官的损伤,导致免疫耐受或免疫麻痹。当猪群猪繁殖与呼吸综合征病毒潜伏感染时,抗生素治疗效果会很差,盲目加大药物剂量,不仅治疗效果不理想,还会导致猪群出现药物中毒,造成肝和肾的功能下降,生长速度减慢,给猪场带来更大的经济损失。
5.4.3 免疫抑制性疾病的防控
(1)科学的饲养管理:保证饲养密度合理、饲养环境良好和營养均衡。在母猪和断奶仔猪转群时,在饲料中添加复合多维(如强力拜固舒),可提高猪群的健康度,减少应激。
(2)科学合理用药:在饲料中添加高品质的替米考星和磺胺氯达嗪等药物,控制猪繁殖与呼吸综合征引起的继发性细菌性感染,减轻猪繁殖与呼吸综合征引起的免疫抑制[20-21];选择优质的猪圆环病毒2型疫苗进行免疫。
(3)定期对猪群进行监测:定期监测ASF、猪繁殖与呼吸综合征、猪圆环病毒病等免疫抑制性疾病的病原学和血清学,及时清除有问题的猪,有计划、有目的地提高种猪群的健康度,最终达到提高生产成绩的目标。
6 小结
ASF最根本的防控措施是不让病毒进入猪场,生物安全措施依然是预防ASF最根本的方法,大多数传统猪场需要进行硬件设备的改造,对人员进行专业的培训,执行严格的生物安全流程和专业的检测。ASFV主要通过接触传播,传播速度较慢,因此一旦猪场发现个别猪感染,可以通过精准清除的方法及时消灭感染猪,使猪场保持阴性。随着ASFV弱毒株和疫苗毒株的出现,经典的“拔牙”方法面临巨大挑战,但是通过更加专业和精确的检测以及更严格的生物安全措施,该病依然可以得到控制。对于感染ASFV弱毒株和疫苗毒株的猪场,在进行精准清除时需要控制其他疾病的感染,尤其是猪繁殖与呼吸综合征和猪圆环病毒病这类免疫抑制性疾病及继发感染,同时,猪场需要做好抗应激的工作,增强猪本身的抵抗力,减少排毒,提高“拔牙”的成功率。这些措施和方法是针对我国当前ASF形势下暂时的应急措施,从长远来看,未来中国ASF控制还是需要走彻底净化的道路。
参考文献:(22篇,略)
