罗汉果花绿原酸的提取和对DPPH·清除效果
2021-06-10汪洪涛
汪洪涛
江苏经贸职业技术学院健康学院;江苏省食品安全工程技术研究开发中心(南京 211168)
罗汉果为葫芦科属多年生藤本植物,雌雄异株,原产于广西、海南等亚热带地区,是我国特有的药食两用植物[1]。罗汉果花取自罗汉果的雄花,味甘、性凉,其中含有丰富的生物活性物质,如黄酮类、皂苷、绿原酸、槲皮素等,常以花茶的形式加入茶叶中饮用[2]。罗汉果花具有润肺清热、通肠利便、增强免疫力的功效,常用于消除咽炎、口腔炎、便秘、口臭等症状[3]。目前对罗汉果的研究较多而对罗汉果花的研究较少,主要集中在精油、皂苷、黄酮类化合物提取及生理功能的研究[4-6],醇提物的抗氧化降糖研究[7]和提取液对果蔬保鲜的研究[8]。
绿原酸即5-咖啡酰奎宁酸,又名咖啡鞣酸,是多酚类化合物,广泛存在于植物尤其是蕨类植物和双子叶植物中。研究表明绿原酸具有降血压、降血脂、清除自由基、对某些肿瘤具有预防和抵抗作用,对溶血性链球菌、金黄色葡萄球菌、伤寒杆菌和痢疾杆菌均有显著的抑制作用[9-11]。现代科学研究发现,绿原酸应用于食品行业可作为保健食品原料,具有天然的增香、护色、抗氧化作用[12]。
随着科技的进步,人们对天然植物提取物的研究与应用需求越来越多。自然资源的浪费和匮乏,使得未来的自然资源越来越稀缺,找到新的提取方法,减少提取过程中的浪费,既有效利用自然资源,又能造福人类生活与健康,是未来发展的重要方向。目前国内外学者对罗汉果花的研究报道较少,尤其对罗汉果花中绿原酸的研究还未见文献报道。为了更好地开发利用罗汉果花,拟通过筛选提取溶剂和提取方法,并对罗汉果花绿原酸的提取工艺进行优化及其体外抗氧化性进行测定,为罗汉果花绿原酸的生产开发提供理论依据。
1 材料与仪器
1.1 材料与试剂
罗汉果花(桂林市山植农副产品有限公司):试验前于烘箱中45 ℃恒温烘干至恒重后粉碎,装于密封袋中备用。
无水乙醇、聚乙二醇、DPPH·(1, 1-二苯基-2-苦基肼自由基):均为分析纯,国药集团化学试剂有限公司;绿原酸标准品:上海科顺生物科技有限公司。
1.2 仪器与设备
752N紫外可见分光光度计,上海屹谱仪器有限公司;HH-S4数显恒温水浴锅,金坛市医疗仪器厂;KQ-500E型超声波清洗器,昆山市超声仪器有限公司;M1-L213B白色美的微波炉,广东美的厨房电器制造有限公司;FW-100型高速万能粉碎机,天津市泰斯特仪器有限公司。
1.3 方法
1.3.1 标准曲线的制作
根据文献[13],在326 nm下测定吸光度,以吸光度y为纵坐标,标准溶液浓度x为横坐标,绘制标准曲线。得到回归方程:y=0.055 8x+0.011 4,回归系数R2= 0.999 1。
1.3.2 绿原酸得率的计算

式中:y为样品吸光度;N为样品稀释倍数;V为加入溶剂体积,mL;m为样品质量,g。
紫外分光法测得的是绿原酸类物质(含异构体)总得率。
1.3.3 提取方法的比较
经过查阅文献,了解目前对不同原料中绿原酸的提取方法,如水浴法[14]、微波辅助法[15]、超声辅助法[16]等。为了了解罗汉果花中绿原酸不同提取方法的提取效果,进行3种提取方法的比较:分别准确称取3份1.00 g罗汉果花粉末样品,置于3个250 mL具塞锥形瓶中,向样品中加入100 mL 40%乙醇,1份于60 ℃水浴提取40 min;1份于60 ℃先水浴提取37 min,接着在微波功率350 W下加热3 min;1份于60 ℃超声波提取40 min。分别抽滤后将全部样品转入3个100 mL容量瓶中定容至刻度。各吸取1 mL上述液体稀释到25 mL,在326 nm下测其吸光度,每组重复3次试验,取平均值计算绿原酸得率。
1.3.4 提取溶剂的选择
在提取方法确定的基础上,准确称取3份1.00 g罗汉果花粉末样品,分别置于250 mL具塞锥形瓶中,向每组样品中分别加入蒸馏水、40%乙醇、40%聚乙二醇,各100 mL,按确定的方法提取。抽滤后将全部样品转入100 mL容量瓶中定容至刻度。吸取1 mL上述液体稀释到25 mL,在326 nm下测其吸光度,每组重复3次试验,取平均值计算绿原酸得率。
1.3.5 单因素试验
分别准确称取5份一定量的罗汉果花粉末,放入5个锥形瓶中,按料液比1:25(g·mL-1)加入1.3.4确定的溶剂,根据预试验和查阅相关文献,其他条件不变,分别改变溶剂体积分数(20%,30%,40%,50%和60%)、料液比(1:15,1:20,1:25,1:30和1:35 g·mL-1)、提取时间(1,2,3,4和5 min)进行单因素试验,确定每个因素的最佳水平。
1.3.6 正交试验
在单因素试验结果的基础上,以绿原酸得率为考察指标,不考虑交互作用,进行L9(34)正交试验,确定最佳工艺参数。试验因素水平表见表1,试验结果采用极差分析和方差分析进行数据处理。

表1 正交试验因素水平表
1.3.7 提取液对 DPPH·清除能力测定
参考文献[17-18],并作修改。将提取液配制成含绿原酸质量浓度分别为10,20,40,60,80和100 μg/mL的待测液,分别取2.0 mL含不同浓度绿原酸待测样品溶液,加入2.0 mL 0.2 mmoL/L DPPH·乙醇溶液,混合均匀后避光放置30 min,在波长517 nm处测定其吸光度。以2.0 mL体积分数为95%乙醇代替样品为空白;以2.0 mL待测样品与2.0 mL体积分数为95%乙醇混合液为样品对照,以消除样品本身颜色的影响。DPPH·清除率按式(2)计算。

2 结果与分析
2.1 不同提取方法对提取液中绿原酸得率的影响
按照1.3.3的方法进行试验,试验数据采用Excel软件进行分析处理并作图,结果见图1。

图1 不同提取方法对提取液绿原酸得率的影响
由图1可知,在3种提取方法中,微波辅助提取法获得的提取液中绿原酸得率最高,其次是超声法,而水浴法获得的绿原酸得率最低。原因可能是超声辅助提取法与水浴法没有提取到更多的绿原酸,而微波辅助提取效果更好可能是因为电磁波穿透能力比较强,而且具有容易控制、加热迅速等特点,从而提取出更多的绿原酸。因此,以下试验均采用微波辅助法提取。
2.2 不同提取溶剂对提取液中绿原酸得率的影响
按照1.3.4的方法进行试验,试验数据采用Excel软件进行分析处理并作图,结果见图2。

图2 不同提取溶剂对提取液中绿原酸得率的影响
由图2可以看出,对于选择的三种提取剂来说,聚乙二醇的提取效果最好,蒸馏水提取效果次之,40%乙醇提取效果最差,这可能是因为罗汉果花中绿原酸在聚乙二醇中的溶解度最大。因此,以下试验均采用聚乙二醇为溶剂来提取。
2.3 单因素试验
2.3.1 不同聚乙二醇体积分数对提取液中绿原酸得率的影响
按照1.3.5方法,以聚乙二醇为溶剂,采用微波辅助提取方法,其他条件不变,分别改变溶剂体积分数(20%,30%,40%,50%和60%)进行试验,结果见图3。

图3 不同聚乙二醇体积分数对提取液中绿原酸得率的影响
由图3可知,当聚乙二醇体积分数小于50%时,绿原酸得率随着溶剂体积分数的增加而增加;当体积分数超过50%以后,得率不再明显增加。这是由于样品中绿原酸的总量在溶解的过程中是恒定的,在溶剂体积分数为50%处有最大得率,为1.32%,超过这个体积分数,溶剂体积分数再增加,溶解出的绿原酸也不会再有很大变化。因此,综合考虑原料利用率等多种因素,聚乙二醇的最佳体积分数为50%。
2.3.2 不同料液比对提取液中绿原酸得率的影响
按照1.3.5方法,以聚乙二醇为溶剂,采用微波辅助提取方法,其他条件不变,分别改变料液比(1:15,1:20,1:25,1:30和1:35 g·mL-1)进行试验,结果见图4。

图4 不同料液比对提取液中绿原酸得率的影响
由图4可知,绿原酸得率随着料液比的增加而增大,在料液比从1:15 g·mL-1增大至1:30 g·mL-1的过程中,绿原酸得率增加得较多;当料液比超过1:30 g·mL-1时,随着料液比的继续增大,绿原酸得率增幅较小,趋于平缓,这可能是由于提取液中绿原酸已达到饱和所致,并且在绿原酸溶出的同时其他干扰成分也会溶出,进而阻碍绿原酸溶出。综合考虑后期的浓缩成本,因此,选择1:30 g·mL-1为最适料液比。
2.3.3 不同微波提取时间对提取液中绿原酸得率的影响
按照1.3.5方法,以聚乙二醇为溶剂,采用微波辅助提取方法,其他条件不变,分别改变微波提取时间(1,2,3,4和5 min)进行试验,结果见图5。

图5 不同微波提取时间对提取液中绿原酸得率的影响
由图5可知,在1~4 min时,绿原酸得率随提取时间的增加而上升,4 min后随提取时间的继续增加而减少,且下降趋势随时间的增大而增大,故提取时间为4 min时绿原酸得率最高。提取时间过长,可能破坏了绿原酸的结构,从而导致绿原酸得率反而降低。因此,选用4 min为最适提取时间。
2.4 正交试验结果与分析
在单因素试验的基础上,按1.3.6的方法,以绿原酸得率为考察指标,进行三因素三水平的正交试验,不考虑交互作用,试验结果采用极差分析和方差分析,正交试验极差分析结果和方差分析结果分别见表2和表3。

表2 正交试验结果与极差分析
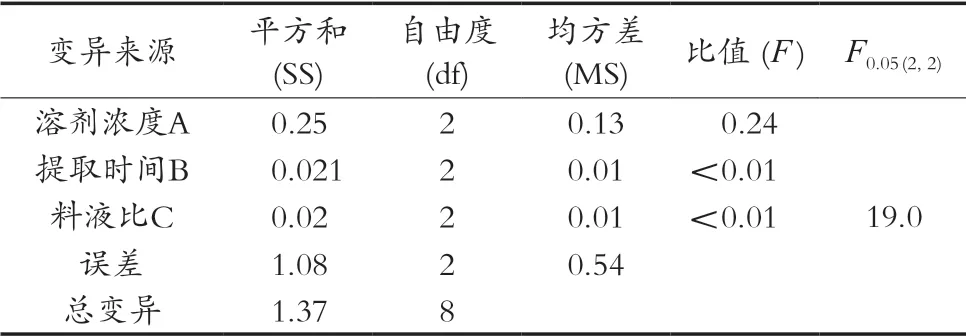
表3 正交试验结果方差分析表
由表2可知,极差分析结果表明,影响罗汉果花提取液绿原酸得率的因素大小为溶剂体积分数>提取时间>料液比。由表3方差分析结果可知,F检验结果表明,3个因素对绿原酸得率的影响均不显著。究其原因可能是试验误差大且误差自由度小,使检验的灵敏度低,从而掩盖了考察因素的显著性。由于各因素对绿原酸得率影响均不显著,不必再进行各因素水平间的多重比较。根据F值大小可知,影响绿原酸得率的因素大小顺序与极差分析相同。正交试验结果显示利用罗汉果花提取绿原酸的最佳工艺条件为A2B3C3,与实际试验结果A2B3C1不符,这可能是由于因素之间存在交互作用,也可能受到自然条件、人为因素、仪器精度等诸多因素影响。后经过试验验证即将理论优化组合A2B3C3与实际试验组合A2B3C1进行5次平行试验,理论优化组合A2B3C3的绿原酸得率平均值为1.70%,实际试验组合A2B3C1的绿原酸得率平均值为1.66%,通过验证可知理论试验组合A2B3C3清除效果最好,即溶剂体积分数为50%,提取时间为5 min,料液比为1:35 g·mL-1。在上述条件下,进一步试验得到罗汉果花提取液中绿原酸得率达到1.70%。
2.5 提取液对DPPH·清除能力测定
按1.3.7的方法进行试验,并与用绿原酸标准品、VC进行比较,试验结果见图6。由图6可知,罗汉果花提取液、绿原酸和VC对DPPH·均有很好的清除作用。罗汉果花提取液和绿原酸标准品在低浓度时对DPPH·清除效果均高于VC,且有一定的线性关系,且在40 μg/mL时对DPPH·清除率达到82%和79%。在低浓度时罗汉果花提取液对DPPH·清除率比绿原酸高可能与提取液中除了绿原酸外还有黄酮类等其他活性物质有关;当质量浓度超过60 μg/mL时,两者清除能力相当,结果表明提取液中主要抗氧化成分是绿原酸。

图6 罗汉果花提取液、抗坏血酸和绿原酸对DPPH·自由基的清除率
3 结论与讨论
微波辅助提取法具有快速高效、节省溶剂、有选择性、节省时间、后处理方便等特点从而应用得越来越广泛。试验结果表明利用聚乙二醇作为溶剂,采用微波辅助提取罗汉果花中绿原酸具有较好的效果。结果显示,在聚乙二醇体积分数50%、料液比1:35 g·mL-1、温度60 ℃的条件下水浴提取37 min后,再在微波功率350 W下提取5 min,此时提取液中绿原酸得率最高,为1.70%;罗汉果花提取液中绿原酸具有较好的抗氧化能力,其在低浓度时对DPPH·清除能力高于VC,且在质量浓度60 μg/mL时对DPPH·清除率达到87%,可以作为食品中的抗氧化剂进行进一步的开发利用。考虑到绿原酸在高温下容易受到破坏,故提取时通过查阅文献综合考虑微波提取功率为350 W,未进行微波功率的变化试验;另外因时间和篇幅的限制,未对罗汉果花绿原酸的提纯优化及其他生理功能的研究,未来有待于进一步的研究。
