PRR11在膀胱癌组织中的表达及其对膀胱癌T24细胞增殖和凋亡的影响
2021-06-08徐豪郝建伟束坤鹏张灏皇甫雪军张云天石红林
徐豪,郝建伟,束坤鹏,张灏,皇甫雪军,张云天,石红林
0 引言
膀胱癌是泌尿生殖系统中常见的恶性肿瘤,也是世界第九大常见癌症,具有易转移、易复发等特点[1-2]。据研究调查[3]显示,1990年至2017年我国膀胱癌发病率呈逐年上升趋势,其防治形势不容乐观。尽管膀胱癌的早期诊断及治疗技术得到极大提高,但其死亡率并没有得到明显改善[3]。因此,寻找潜在分子治疗靶点,可能对膀胱癌的治疗具有重要临床意义。富含脯氨酸蛋白11(proline-rich protein 11,PRR11)是定位于染色体17q22区的肿瘤相关基因,参与调控肿瘤细胞周期进程、凋亡、侵袭等诸多生物学过程。已有研究显示,PRR11在多种肿瘤组织中高表达,例如食管鳞状细胞癌[4]、宫颈癌[5]、胆囊癌[6]、乳腺癌[7]等,并且其高表达与患者不良预后相关。也有研究[8-9]报道称,靶向沉默PRR11表达可抑制乳腺癌及结直肠癌细胞的增殖、迁移与侵袭,并诱导细胞凋亡。基于以上研究报道,提示PRR11可能在肿瘤的发生发展过程中扮演癌基因的作用。然而,PRR11在膀胱癌中的表达水平及临床意义目前尚不明确。本研究旨在分析PRR11在膀胱尿路上皮癌中的表达及其临床意义,并探讨干扰PRR11的表达对膀胱癌细胞增殖和凋亡的影响,以期为膀胱癌的分子靶向治疗提供理论基础。
1 资料与方法
1.1 一般资料
选择2017年2月—至2019年1月在河南省人民医院泌尿外科行膀胱癌根治性切除术的57例膀胱癌患者癌组织标本及其对应的癌旁组织标本(距癌灶边缘>5 cm),所有癌组织均经病理学证实为膀胱尿路上皮癌,患者术前均未接受任何放疗、化疗及其他抗肿瘤治疗。所有患者均签署知情同意书,且本研究获得河南省人民医院伦理委员会批准。
1.2 细胞及主要试剂和仪器
人永生化膀胱上皮细胞株SV-HUC-1以及人膀胱癌细胞株HTB-9、T24、J82和UM-UC-3均购自中国科学院上海生命科学研究院细胞资源中心;胎牛血清、F12K、RPMI 1640和DEME培养基均购自美国Gibco公司;含有shRNA-PRR11重组质粒及其阴性对照(shRNA-NC)质粒的慢病毒(慢病毒滴度:2×108TU/ml)由上海吉凯基因医学科技股份有限公司提供;TRIzol试剂盒购自美国Invitrogen公司;PrimeScript™ Ⅱ 1st Strand cDNA Synthesis Kit和SYBR®Premix Ex Taq™ Kit购自宝生物工程(大连)有限公司;CCK-8试剂盒、Annexin V-FITC细胞凋亡检测试剂盒购自上海碧云天生物技术有限公司;Giemsa染液、免疫组织化学SP法试剂盒购自北京索莱宝科技有限公司;兔抗人PRR11多克隆抗体购自英国Abcam公司;兔抗人Caspase3单克隆抗体、兔抗人Bax多克隆抗体、小鼠抗人Bcl-2多克隆抗体和兔抗人GAPDH单克隆抗体购自美国Cell Signaling Technology公司;辣酸根过氧化物酶(HRP)标记的山羊抗兔或小鼠IgG二抗购自武汉博士德生物工程有限公司;ELx8000型酶标仪购自美国Bio-Tek公司;C6流式细胞仪购自美国BD公司;实时荧光定量PCR仪器购自美国Applied Biosystems公司。
1.3 方法
1.3.1 免疫组织化学检测 取石蜡包埋的膀胱癌及其癌旁组织,切片后脱蜡至水,3%H2O2处理10 min以灭活内源性过氧化物酶,0.01 mol/L柠檬酸钠缓冲液沸水浴处理进行抗原修复,滴加山羊血清封闭20 min,滴加PRR11抗体(1:50),4℃孵育过夜,PBS洗涤3次,滴加Bio-羊抗兔IgG二抗,室温孵育1 h,PBS洗涤3次,滴加链霉亲和素-POD工作液,室温孵育30 min,PBS洗涤3次,滴加DAB显色液,室温孵育10 min,PBS洗涤3次以终止反应,苏木精对比染色,梯度乙醇脱水干燥,二甲苯透明,中性树脂封片,光学显微镜观察。PRR11阳性染色以细胞质和细胞核呈棕黄色或棕褐色颗粒状,根据视野内细胞阳性细胞百分比和着色强度进行评分[10]。按照染色强度的深浅评分:无着色为0分、淡黄色1分、棕黄色2分,棕褐色3分;按照阳性细胞百分比评分:<5%为0分,5%~<25%为1分,25%~75%为2分,≥75%为3分。两项得分结果相乘为最终得分,评分≤4分为低表达,评分>4分为高表达。
1.3.2 细胞培养 从液氮罐中取出冻存的SVHUC-1、HTB-9、T24、J82和UM-UC-3等细胞,其中SV-HUC-1细胞采用含有10%胎牛血清的F12K培养基培养,HTB-9、T24和UM-UC-3细胞分别采用含有10%胎牛血清的RPMI 1640培养基培养,而J82细胞采用含有10%胎牛血清的DMEM培养基培养。复苏后的各细胞置于37℃、5%CO2的培养箱中培养,每隔2~3 d传代1次。
1.3.3 慢病毒感染 取对数生长期的T24细胞,调整细胞浓度,以1.5×105个/孔的细胞密度接种于6孔板中,设置空白对照组(Blank,未感染组)、shRNA-NC组(感染shRNA-NC慢病毒)和shRNA-PRR11组(感染shRNA-PRR11慢病毒)。取shRNA-NC慢病毒和shRNA-PRR11慢病毒以感染复数为50分别感染T24细胞。感染8~12 h后更换新鲜培养基,感染48 h后采用含有0.1 mg/L嘌呤霉素培养基筛选稳定表达细胞株,并采用qRT-PCR和Western blot实验验证PRR11基因干扰效果。
1.3.4 qRT-PCR检测 收集细胞沉淀,加入TRIzol试剂提取细胞总RNA,测定总RNA浓度及纯度。按照PrimeScript™ Ⅱ 1st Strand cDNA Synthesis Kit说明书步骤反转录合成cDNA,以cDNA为模板再按照SYBR® Premix Ex Taq™ Kit说明书进行qRTPCR扩增检测。引物序列:PRR11,上游引物:5’-GAAGCTGGCTAACATCCTG-3’,下游引物:5’-CTCTGGGTTATGCA GTTCTGG-3’;GAPDH上游引物:5’-ATGACCCCTTCATTGACCTCA-3’,下游引物:5’-GAGATGATGACCCTTTTGGCT-3’。反应条件:95℃预变性30 s;95℃变性20 s,60℃退火30 s,72℃延伸30 s,共40个循环。以GAPDH为内参,采用2-ΔΔCt法计算PRR11 mRNA相对表达量。
1.3.5 CCK-8检测细胞增殖活性 收集感染后的三组细胞,调整细胞浓度,以每孔3 000个细胞的密度接种于96孔板中,分别培养12、24、48、72 h后,每孔加入10 μl CCK-8溶液,在摇床上充分混匀,37℃孵育1 h,采用酶标仪检测450 nm波长处各孔吸光度值(OD450)。
1.3.6 平板克隆形成实验 收集感染后的三组细胞,制备成单细胞悬液,以每孔300个细胞接种于6孔板中,充分混匀,置于37℃、5% CO2的培养箱中培养,每隔2~3 d换液1次,培养2~3周。当出现肉眼可见的克隆时即终止培养,弃培养液,加入4%多聚甲醛固定15 min,加入适量0.5%亚甲基蓝染液30 min,肉眼计算克隆数。
1.3.7 流式细胞术检测细胞凋亡 取对数生长期感染后各组细胞,调整细胞浓度,以每孔3×105个细胞的密度接种于6孔板中培养48 h,收集细胞沉淀及培养液,1 000 r/min离心5 min,预冷PBS重悬细胞,调整细胞浓度至2×105个/毫升,取1 ml细胞悬液,依次加入5 μl Annexin V-FITC和10 μl PI,避光孵育15 min,上流式细胞仪检测。
1.3.8 Western blot实验 收集细胞沉淀,加入适量RIPA裂解液,冰上充分裂解30 min,12 000 r/min离心20 min,收集上清液,采用BCA法测定蛋白浓度。取25 μg蛋白加入上样缓冲液中沸水浴变性,SDS-PAGE凝胶电泳分离蛋白,并湿转法将蛋白转移至PVDF膜上,5%脱脂奶粉室温封闭1 h,分别加入PRR11抗体(1:1 000)、Caspase3抗体(1:1 000)、Bcl-2抗体(1:1 000)、Bax抗体(1:1 000)和GAPDH抗体(1:1 000),4℃条件下孵育过夜。TBST洗涤3次,加入HRP标记的山羊抗兔或小鼠IgG二抗(1:10 000),室温孵育1 h,TBST洗涤3次,滴加ECL化学发光液,显影。以GAPDH为内参,采用Image J软件分析条带灰度值,并计算各目的蛋白的相对表达量。
1.4 统计学方法
应用SPSS22.0统计学软件进行统计学分析,计量资料以()表示,计数资料用率(%)表示,多组间比较采用单因素方差分析(one-way ANOVA),组间两两比较采用t检验,采用χ2检验分析PRR11表达水平与患者临床病理特征之间的关系。P<0.05为差异有统计学意义。
2 结果
2.1 PRR11在膀胱尿路上皮癌组织及膀胱癌细胞中的表达
免疫组织化学检测结果显示,PRR11蛋白在细胞质和细胞核中均有表达,见图1。PRR11蛋白在膀胱尿路上皮癌组织中高表达率为71.93%(41/57),低表达率为28.07%(16/57),而在癌旁组织中高表达率为22.81%(13/57),低表达率为77.19%(44/57),差异有统计学意义(χ2=27.585,P=0.000)。与SV-HUC-1细胞比较,HTB-9、T24、J82和UM-UC-3细胞中PRR11 mRNA和蛋白相对表达量显著降低(FmRNA=215.711,P=0.000;F蛋白=384.777,P=0.000),见图2。其中T24细胞最为显著,为此后续细胞实验选择T24细胞作为研究对象。

图1 PRR11在膀胱尿路上皮癌组织及癌旁组织中的表达 (免疫组织化学 ×100)Figure 1 PRR11 expression in bladder urothelial carcinoma tumor tissues and adjacent tissues (IHC ×100)
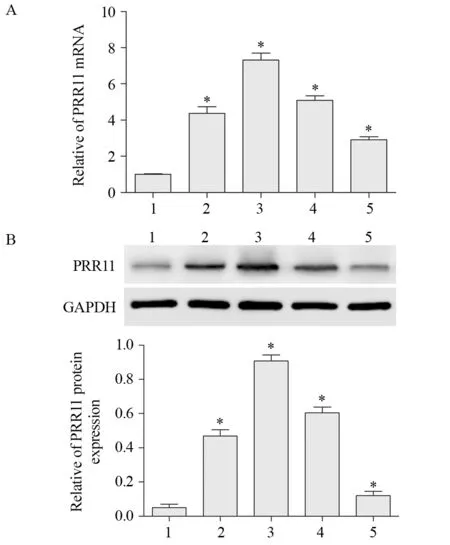
图2 各细胞中PRR11 mRNA(A)和蛋白(B)表达Figure 2 Expression of PRR11 mRNA(A) and protein(B) in each cell lines detected by qRT-PCR and Western blot
2.2 PRR11表达水平与膀胱尿路上皮癌患者临床病理特征的关系
PRR11 高表达与膀胱尿路上皮癌患者年龄(χ2=0.057,P=0.812)、性别(χ2=0.957,P=0.328)、肿瘤直径(χ2=0.768,P=0.381)、N分期(χ2=2.172,P=0.141)和M分期(χ2=0.537,P=0.464)均无显著相关性,而与患者病理分级(χ2=12.055,P=0.001)和T分期(χ2=6.293,P=0.012)有显著相关性,见表1。

表1 PRR11表达与膀胱尿路上皮癌患者临床病理特征的关系Table 1 Correlation of PRR11 expression with clinicopathological features of patients with bladder urothelial carcinoma
2.3 干扰PRR11表达对T24细胞中PRR11表达水平的影响
与Blank组或shRNA-NC组比较,shRNAPRR11组细胞中PRR11 mRNA和蛋白相对表达量显著降低,见图3。
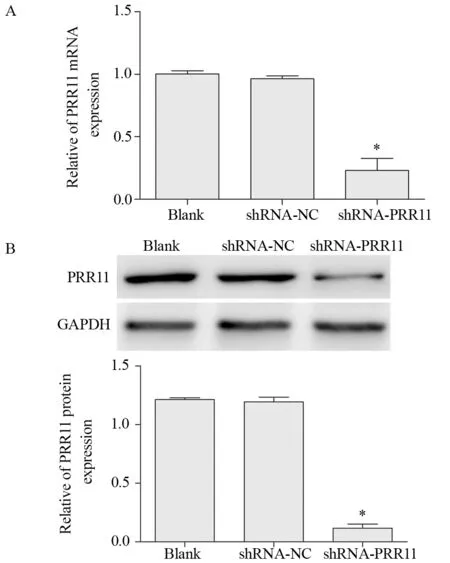
图3 慢病毒感染后T24细胞中PRR11 mRNA和蛋白表达水平Figure 3 Expression levels of PRR11 mRNA (A) and protein (B) in T24 cells after lentivirus infection detected by qRT-PCR and Western blot
2.4 干扰PRR11表达对T24细胞增殖的影响
CCK-8检测结果显示,培养24、48、72 h后,各组细胞增殖活性存在显著性差异(F=22.795,45.415,56.778,均P<0.05)。与Blank组或shRNANC组比较,shRNA-PRR11组细胞培养24、48、72 h后其细胞增殖活性显著降低(均P<0.05),见表2。平板克隆形成实验结果所示,Blank组、shRNA-NC组和shRNA-PRR11组细胞克隆形成数目分别(247.67±12.01)个、(234.33±16.56)个和(69.00±17.35)个。与Blank组或shRNA-NC组比较,shRNA-PRR11组细胞克隆形成数目显著减少(t=14.128,13.074,均P=0.000),见图4。

图4 平板克隆实验检测各组T24细胞克隆形成能力 (亚甲基蓝染色 ×10)Figure 4 T24 cell clonality of each group detected by plate cloning assays (methylene blue staining ×10)
表2 各组T24细胞增殖活性比较 (OD450,)Table 2 Comparison of T24 cell proliferation activity among three groups (OD450,)

表2 各组T24细胞增殖活性比较 (OD450,)Table 2 Comparison of T24 cell proliferation activity among three groups (OD450,)
Notes:a:P<0.05,compared with Blank group;b:P<0.05,compared with shRNA-NC group.
2.5 干扰PRR11表达对T24细胞凋亡的影响
流式细胞术结果显示,Blank组、shRNA-NC组和shRNA-PRR11组细胞凋亡率分别为(7.13±2.10)%、(8.00±1.35)%和(32.23±3.04)%。与Blank组或shRNA-NC组比较,shRNA-PRR11组细胞凋亡率显著增加(t=13.546,13.081,均P=0.000),见图5。与Blank组或shRNA-NC组比较,shRNA-PRR11组细胞Cleaved-caspase3和Bax蛋白表达水平显著升高(均P<0.05),而Bcl-2蛋白表达水平显著降低(P<0.05),见图6。
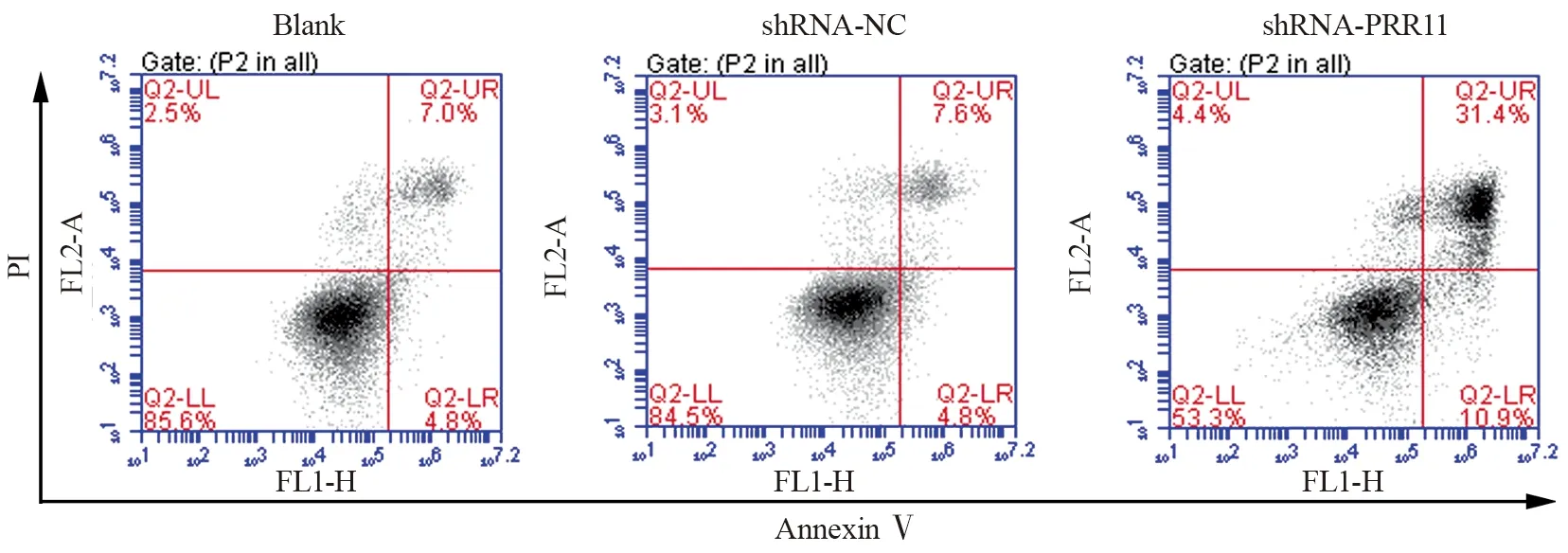
图5 流式细胞术检测各组T24细胞凋亡Figure 5 Apoptosis rate of each group T24 cells detected by flow cytometry

图6 Western blot检测各组T24细胞中Caspase-3、Bcl-2和Bax蛋白表达Figure 6 Protein expression levels of Caspase-3,Bcl-2 and Bax of T24 cells detected by Western blot
3 讨论
PRR11蛋白含有2个脯氨酸富集区和1个锌指结构域,其中锌指结构域是一个典型的具有结合双链DNA并调节基因转录的结构域,而脯氨酸富集区能够与SH3结构域或WW结构域结合并介导参与细胞信号传递相关蛋白质与蛋白质之间的相互作用。目前已有大量研究证实[4-7],PRR11在多种恶性肿瘤组织中高表达,并与患者不良预后呈负相关,且体外实验证实下调PRR11表达可抑制肿瘤细胞的恶性生物学行为,如细胞增殖、侵袭转移等。然而,有关PRR11在膀胱癌中的表达及作用目前鲜有报道。本研究证实,PRR11在膀胱尿路上皮癌组织中高表达,并与患者肿瘤病理分级和T分期有显著相关性,同时干扰PRR11表达可抑制膀胱癌T24细胞增殖并诱导细胞凋亡,因此PRR11可能在膀胱癌中发挥致癌基因的作用。
Cai等[11]研究显示,PRR11在原发性前列腺癌组织中高表达,并且其高表达与患者肿瘤病理分期、淋巴转移、短期生存率等显著相关,提示PRR11可能与泌尿生殖系统肿瘤发生发展密切相关。为此,本研究对57例膀胱尿路上皮癌组织及其癌旁组织中PRR11蛋白表达情况进行检测,结果显示PRR11在膀胱尿路上皮癌组织中高表达,推测其异常表达可能影响膀胱尿路上皮癌的进展。随后本研究进一步分析PRR11高表达与患者临床病理特征的关系,结果发现PRR11高表达与患者病理分级和T分期有显著相关性。Lin等[12]通过分析来自癌症基因组图谱(TCGA)和基因表达大棚车(GEO)两数据库的四组膀胱癌RNA序列及临床资料进行单变量Cox回归分析并建立预后评估模型,预测PRR11是膀胱癌的风险基因,并且预测PRR11高表达患者预后较差。因此,提示PRR11可能在膀胱癌发生发展中扮演致癌作用,其有可能成为分子靶向治疗膀胱癌的潜在靶点。
虽然PRR11作为癌基因已被证实参与调控肿瘤细胞周期、增殖、侵袭转移等众多生物学行为[13-15],但其对膀胱癌细胞生物学功能的调控作用目前还未知。因此本研究首先分析PRR11在膀胱癌细胞株中的表达情况,结果显示膀胱癌细胞株中PRR11 mRNA和蛋白表达水平显著增高,该结果与膀胱癌组织水平结果一致,再次提示PRR11可能在膀胱癌发生发展中扮演致癌作用。随后本研究采用shRNA技术干扰膀胱癌T24细胞株中PRR11基因的表达,相关实验结果显示,干扰PRR11表达可显著抑制T24细胞增殖活性以及克隆形成数。同时,干扰PRR11表达还可促进T24细胞凋亡,并上调促凋亡蛋白Cleaved-caspase-3和Bax表达水平,下调抗凋亡蛋白Bcl-2表达,说明干扰PRR11表达可抑制T24细胞增殖,并促进凋亡。细胞无限增殖及抗凋亡等是肿瘤细胞的重要恶性生物学行为特征,此外Huang等[16]研究也显示,沉默PRR11基因表达可抑制非小细胞肺癌细胞增殖,并诱导细胞凋亡。由此可见,PRR11在膀胱癌组织中高表达可能是导致膀胱癌细胞无限增殖的原因之一,因而抑制PRR11表达可能是膀胱癌靶向治疗的潜在靶点。
综上所述,PRR11在膀胱尿路上皮癌组织中高表达,其高表达与患者病理分级和T分期有显著相关性,并证实干扰PRR11表达可抑制膀胱癌细胞增殖及促进细胞凋亡,初步阐明PRR11在膀胱癌中的表达水平及其临床意义,但PRR11对膀胱癌细胞增殖及凋亡调控的具体机制,及其在膀胱癌中更多的功能,还需要进一步研究。
