MFG-E8对卵巢癌SKOV3细胞顺铂敏感度的影响及分子机制
2021-06-08李娜代聪伟杨艳艳魏强邱刚吴小华
李娜,代聪伟,杨艳艳,魏强,邱刚,吴小华
0 引言
卵巢癌是一个突出的公共卫生问题,尽管其发病率在女性生殖系统恶性肿瘤中低于宫颈癌及子宫内膜癌,但死亡率占据妇科恶性肿瘤之首[1]。根据世界卫生组织的统计,每年新增病例约225 500例,卵巢癌死亡的病例约140 200例左右[2]。1980年以来,卵巢癌的5年总生存率仍低于30%,未见明显改善[3]。因此探讨卵巢癌的发病机制,寻找新的治疗策略,成为女性健康领域的重大诉求。
乳脂肪球表皮生长因子8(milk fat globule-EGF factor 8,MFG-E8),又称为乳凝集素,是一种分泌型糖蛋白,由MFG-E8基因编码[4],其在许多生理和病理过程中发挥重要作用,如吞噬作用、动脉粥样硬化的发病机制、血管生成、免疫保护以及其他[5-8]。已有研究证实MFG-E8在多种肿瘤中高表达,并可促进肿瘤细胞的增殖和侵袭等[9-13],但MFG-E8在卵巢癌中的研究较少[14]。前期实验中,我们已经证实沉默MFG-E8可抑制上皮性卵巢癌细胞增殖、影响细胞周期分布、迁移、黏附、侵袭等生物学特性,并对其相关机制进行了探讨。有研究显示在肿瘤干细胞标记阳性的黑素瘤、乳腺癌以及非小细胞肺癌细胞株中证实MFG-E8可激活Stat3和Sonic Hedgehog信号途径,与IL-6协同增强其抗癌药耐药性[15],但其对于卵巢癌细胞化疗抵抗的影响尚不明确。本研究通过探讨沉默MFG-E8基因对卵巢癌SKOV3细胞顺铂药物敏感度的影响及其相关作用机制,为上皮性卵巢癌靶向治疗提供新思路。
1 材料与方法
1.1 材料
SKOV3细胞购自中科院上海细胞库。引物由上海生工合成,MFG-E8 siRNA及NC siRNA由江苏吉玛生物公司构建并合成。RPMI 1640培养基、胎牛血清均购自美国Gibco公司、细胞培养瓶和多孔培养板均购自美国Corning公司、CCK-8增殖试剂盒购自美国MCE公司、E-cadherin兔抗人单克隆抗体、N-cadherin兔抗人单克隆抗体、Vimentin兔抗人单克隆抗体、Snail+Slug兔抗人多克隆抗体以及GAPDH兔抗人单克隆抗体均购自美国Abcam公司、蛋白酶抑制剂、BCA检测试剂盒、ECL化学发光检测试剂盒均购自武汉塞维尔公司。Lipofectamine™2000购自美国Invitrogen公司、反转录聚合酶链反应(RT-PCR)试剂盒购于日本TaKaRa公司、顺铂购自山东齐鲁药业有限公司(H20073653)。
1.2 细胞培养及转染
SKOV3细胞用含10%胎牛血清的RPMI1640培养基中,在37℃、5%CO2饱和湿度条件下常规培养,1~2天换液一次。
MFG-E8 siRNA以及阴性对照siRNA(NC siRNA)序列如下:MFG-E8 siRNA#1:正义(5’-3’)GAUUUCCCAAGAAGUGCGATT,反义(5’-3’)UCGCACUUCUUGGGAAAUCTT;MFG-E8 siRNA#2:正义(5’-3’)GGACACG AAUU-CGAUUUCATT,反义(5’-3’)UGAAAUCGAAUUCGUGUCCTT;MFG-E8 siRNA#3:正义(5’-3’)GGCCUGAAGAAUAACAGCATT,反义(5’-3’)UGCUGUUAUUCUUCAGGCCTT;NC siRNA:正义(5’-3’)UUCUUCGAACGUGUCACGUTT,反义(5’-3’)ACGUGACACGUUCGGAGAATT。转染前一天,用胰酶消化细胞并计数,将细胞铺入六孔板中,使转染时细胞汇合度达到50%~70%,此时用不含抗生素的培养基进行培养,第二天进行细胞转染。转染步骤参考Lipofectamine™2000的试剂说明进行。步骤如下:(1)分别将2 μg NC siRNA或转染组MFG-E8 siRNA #1、#2、#3、5 μl Lipofectamine™2000溶于250 μl Opti-MEMⅠ培养基中,室温孵育 5 min。(2)将上述siRNA与Lipofectamine™2000混合,室温下继续孵育20 min。(3)将500 μl上述混合物分别加入各孔细胞中,轻轻混悬。转染6~8 h后更换含10%血清的完全培养基继续培养至48 h。收集细胞用于后续的研究。
1.3 MFG-E8 siRNA转染对细胞的顺铂药物毒性影响
取对数生长期的SKOV3细胞,常规胰酶消化,离心后用RPIM 1640培养基(含10%胎牛血清)重悬为单细胞悬液,计数板计数后,按每孔1×105个/孔接种于6孔板内,每组设6个复孔,置于5%CO2、37℃的培养箱内培养24 h,第二天用NC siRNA和MFG-E8 siRNA分别转染细胞。于转染后24 h,分别加入使用浓度为0、1.5、3、4.5、6、7.5、9、10.5 μg/ml顺铂作用于各组细胞,继续置于培养箱内培养48 h后,每孔加入CCK-8试剂10 μl,孵育2 h,应用酶标仪于450 nm波长处测定吸光度值(OD),根据以下公式计算细胞相对增殖抑制率。
相对增殖抑制率(%)=1-[(实验孔OD值-空白孔OD值)/(对照孔OD值-空白孔OD值)]×100%。本研究空白孔为单纯培养基。GraphPad Prism 5.0统计软件计算各组细胞顺铂注射液的IC50,选取适宜的药物浓度进行后续试验。
1.4 CCK-8检测MFG-E8 siRNA转染后细胞对顺铂的反应
取SKOV3细胞单细胞悬液,计数后将1×105个/孔细胞均匀接种于96孔板中。贴壁12 h后,用NC siRNA和MFG-E8 siRNA转染细胞,方法同前,每组设6个复孔。转染后24 h,分别加入顺铂(药物浓度为上述实验中检测顺铂对阴性对照组细胞的IC50值)继续培养。分别在加药24、48和72 h后,每孔加入10 μl CCK-8,继续培养2 h,利用多功能酶标仪测定各个孔在450 nm处的OD值。
1.5 实时荧光定量PCR实验
按照TRIzol试剂盒说明书提取细胞总RNA,并对所提取的RNA完整性鉴定和定量,反转录合成cDNA,SYBR®GreenⅠ行Real-time PCR检测,50℃适应2 min,94℃预变性5 min,94℃变性15 s,60℃复性、延伸45 s,循环40次。每次延伸前读板。95℃反应10 min后作溶解曲线分析。以GAPDH作为内参基因,分析目的基因的mRNA相对表达量。
1.6 Western blot实验
加入细胞蛋白裂解液提取细胞总蛋白,测定蛋白浓度,SDS-聚丙烯酰氨凝胶电泳,湿转法电转印蛋白质至PVDF膜,将PVDF膜放入5%脱脂牛奶封闭液中,封闭2 h,将膜放置于含有一抗的稀释液中,4℃过夜,加入二抗(1:500)室温孵育2 h,将等体积的化学发光试剂A和B混匀后与PVDF膜共孵育1 min,应用Image Quant LAS 4000凝胶成像系统进行显色,Gelpro4.0软件分析条带灰度值,蛋白相对表达量=待检样品蛋白的灰度值/内参的灰度值。
1.7 统计学方法
所有实验结果均采用均数±标准差()表示,GraphPad Prism5.0统计软件处理,t检验对数据进行统计分析,P<0.05为差异有统计学意义。
2 结果
2.1 沉默MFG-E8 基因转染效率测定结果
分别将NC siRNA及MFG-E8 siRNA转染SKOV3细胞中,于转染后48 h收集细胞检测MFG-E8 siRNA的干扰效率,Vehicle(溶剂组)只加转染试剂Lipofectamine™2000。
Western blot结果显示,MFG-E8蛋白的表达在MFG-E8 siRNA#3中明显低于MFG-E8 siRNA#1、MFG-E8 siRNA#2以及组Vehicle组和NC siRNA组细胞,其中NC siRNA组相对蛋白量为0.85±0.106,MFG-E8 siRNA组相对蛋白量为0.28±0.079(P=0.0003),见图1。上述结果表明所用MFG-E8 siRNA#3序列可以有效干扰MFG-E8的表达,阴性序列对MFG-E8蛋白表达无明显影响,因此应用MFG-E8 siRNA#3(Msi)及NC siRNA(Csi)完成后续试验。

图1 转染后48 h各组细胞中MFG-E8蛋白的表达Figure 1 Expression of MFG-E8 protein in SKOV3 cells after MFG-E8 siRNA transfection for 48h
2.2 CCK-8检测MFG-E8 siRNA转染对SKOV3细胞顺铂毒性的影响
不同浓度的顺铂作用于两组细胞48 h后结果显示,随着药物浓度的增高,两组细胞的增殖抑制率均有上升,MFG-E8 siRNA转染组细胞增殖抑制率上升较明显(P=0.0001),见图2A。GraphPad Prism 5.0统计软件计算顺铂对两组细胞的IC50,MFG-E8 siRNA转染组(3.308±1.75)明显低于对照组(1.934±0.06),差异有统计学意义(P=0.0002)。
据所测阴性对照组的IC50,将3 μg/ml顺铂浓度作用于两组细胞,检测不同时间后两组细胞对顺铂的敏感度变化。结果表明,处理48、72 h后,可见MFG-E8 siRNA转染组细胞增殖活性显著低于阴性对照组,见图2B、表1。

图2 CCK-8检测顺铂对两组SKOV3细胞的毒性反应Figure 2 Toxicities reaction of cisplatin in two groups of SKOV3 cells detected by CCK-8

表1 MFG-E8 siRNA转染联合顺铂 (3 μg/ml) 对细胞增殖的影响Table 1 Influence of MFG-E8 siRNA t ransfection combined with casplatin (3μg/ml) on proliferation of SKOV3 cells
2.3 qRT-PCR检测MFG-E8 siRNA对多重耐药蛋白ABCB1、ABCC1 mRNA水平表达的影响
结果显示,与阴性对照组相比,MFG-E8 siRNA转染组中ABCB1及ABCC1 mRNA表达均明显降低,差异有统计学意义(P=0.0059,P=0.0206),见图3。
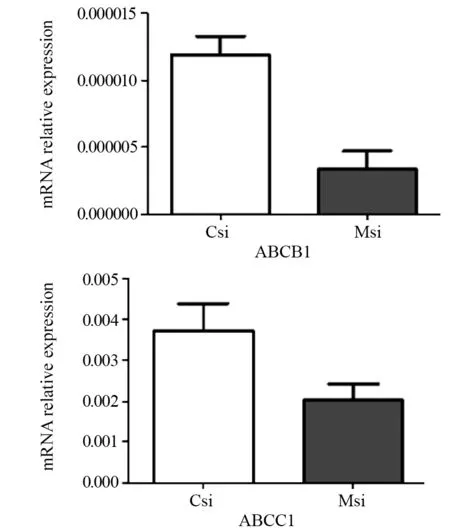
图3 qRT-PCR检测两组细胞中耐药基因ABCB1、ABCC1 mRNA相对表达水平Figure 3 ABCB1 and ABCC1 mRNA expression in SKOV3 cells of two groups detected by qRT-PCR
2.4 MFG-E8 siRNA对SKOV3细胞中EMT进程的影响
Csi与Msi组中N-Cadherin mRNA表达量分别为1.01±0.073和0.72±0.086,差异有统计学意义(P=0.002),Snail mRNA表达量分别为1.06±0.072和0.71±0.032,差异有统计学意义(P=0.000);Vimentin mRNA相对表达量分别为1.03±0.181和0.60±0.122,差异有统计学意义(P=0.0469);E-Cadherin mRNA相对表达量分别为0.92±0.087和1.69±0.2371,差异有统计学意义(P=0.001)。说明沉默MFG-E8基因可下调N-Cadherin、Vimentin、Snail mRNA的表达,上调E-Cadherin mRNA表达,见图4。

图4 qRT-PCR检测转染MFG-E8 siRNA对SKOV3细胞中EMT的影响Figure 4 Effect of MFG-E8 siRNA transfection on EMT in SKOV3 cells detected by qRT-PCR
Western blot检测结果显示,Csi组与Msi组N-Cadherin蛋白的相对表达量为0.67±0.03和0.47±0.013,差异有统计学意义(P=0.020);snail+slug蛋白相对表达量分别为0.33±0.02和0.12±0.017,差异有统计学意义(P=0.0002);Vimentin蛋白相对表达量分别为0.53±0.081和0.27± 0.062,差异有统计学意义(P=0.0258);E-Cadherin蛋白相对表达量分别为0.27±0.033和0.61±0.034,差异有统计学意义(P=0.0085)。结果表明,沉默MFG-E8可降低SKOV3细胞中N-Cadherin、Vimentin、Snail+Slug蛋白的表达,上调E-Cadherin蛋白表达,见图5。
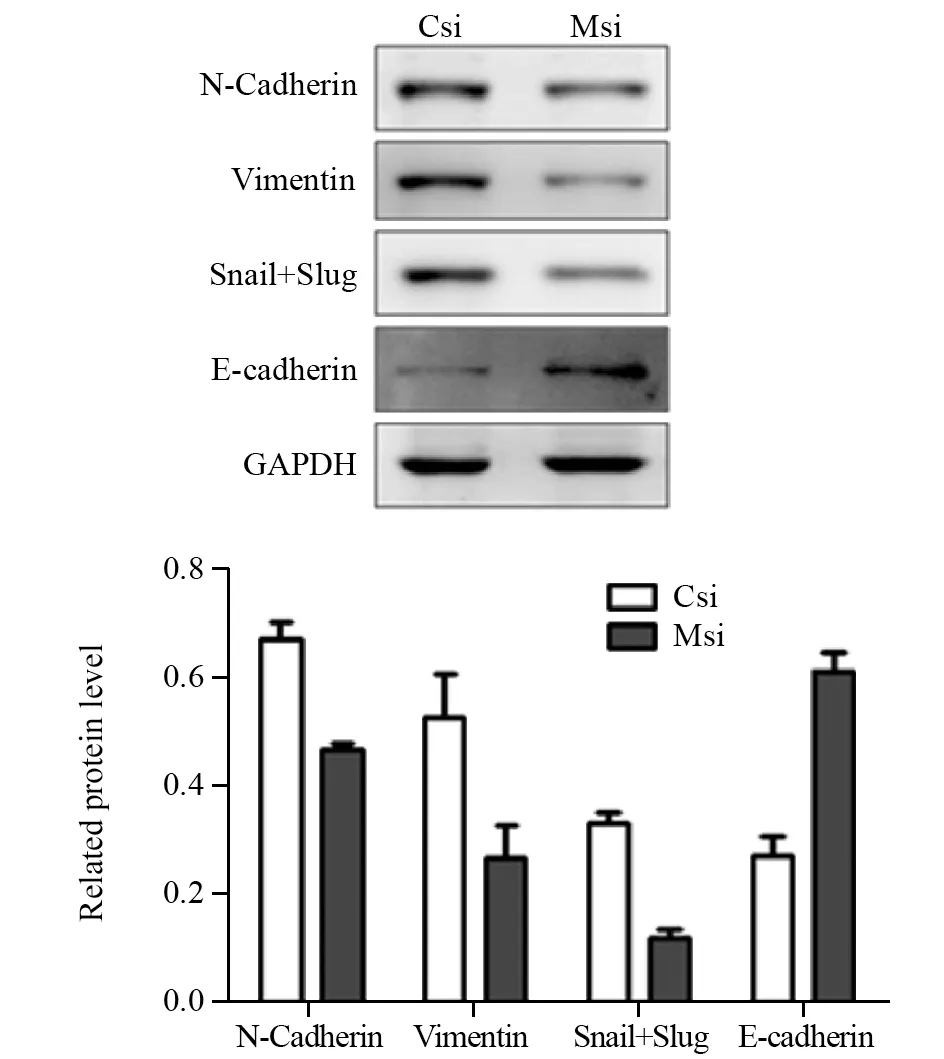
图5 Western blot检测转染MFG-E8 siRNA对SKOV3细胞中EMT相关蛋白表达的影响Figure 5 Effect of MFG-E8 siRNA transfection on expression of EMT-related proteins in SKOV3 cells detected by Western blot
3 讨论
尽管随着治疗技术的进展,手术及联合放化疗等治疗手段广泛应用于临床,但中晚期的上皮性卵巢癌患者病死率仍无明显改善。卵巢癌在女性生殖系统恶性肿瘤中死亡率最高,其恶性进展的特征包括:腹腔内肿瘤细胞的扩散,大量腹水的快速形成,肿瘤血管的形成[16]。认识卵巢癌的发病机制,寻找更有效的治疗方案,是关乎女性健康的一大挑战。
MFG-E8可从各种类型的细胞中分泌,包括乳腺上皮细胞、巨噬细胞和未成熟的树突细胞,并通过与吞噬细胞上的αVβ3整合素结合来介导凋亡细胞的有效吞噬作用[17-18],已有研究证实MFG-E8可促进肿瘤增殖、侵袭[5,9]。
化疗是上皮性卵巢癌的主要治疗手段之一,尤其是对中晚期患者来说。本研究进一步检测了MFG-E8 siRNA转染对SKOV3细胞顺铂毒性反应以及联合顺铂处理对细胞增殖的影响。结果显示,随着药物浓度的增高,各组细胞的增殖抑制率上升,MFG-E8 siRNA转染组细胞增殖抑制率上升明显,当顺铂浓度达到7.5 μg/ml以上时,两组细胞OD值趋于接近,参考顺铂对阴性对照组细胞的IC50,设定药物浓度为3 μg/ml作用于两组细胞,测不同的时间点(24、48、72 h)对抗肿瘤药物敏感度的变化。结果显示处理48、72 h后,MFG-E8 siRNA转染组细胞增殖活性显著低于阴性对照联合顺铂处理组细胞。提示MFG-E8参与了卵巢癌耐药的发生过程。
虽然一线化疗(铂类联合)对大多数卵巢癌患者在初始治疗时疗效显著,但大约70%的晚期卵巢癌患者会在治疗后复发,并最终因化疗耐药而导致死亡。有研究表明,MFG-E8可以促进肿瘤细胞对化疗的耐药性[15],ABCB1(P-gp MDR1)以及ABCC1(MRP1)均属于为ATP结合盒(ATP binding cassette transporters)转运蛋白超家族成员,广泛分布于肿瘤组织内,与多重耐药相关[19]。研究发现,多重耐药分子机制复杂,涉及多个方面,如肿瘤细胞对化疗药物的摄取降低、排出增加、以及机体对药物代谢的改变、DNA损伤修复增强等,但其具体机制尚不明确。ATP结合盒转运蛋白具有“药泵”作用,它可以将化疗药物从肿瘤细胞内泵出,降低细胞内有效药物浓度,从而产生耐药。为进一步了解MFG-E8基因对多重耐药蛋白ABCB1及ABCC1的影响,我们用qRT-PCR检测MFG-E8 siRNA对ABCB1及ABCC1 mRNA表达变化,结果显示,与阴性对照组相比,MFG-E8 siRNA转染组中ABCB1及ABCC1 mRNA表达均明显降低。这表明沉默MFG-E8对顺铂的增敏作用可能是通过降低ABCB1及ABCC1表达产生。
越来越多的研究表明上皮间充质细胞转化(epithelial mesenchymal transtion,EMT)激活可促进肿瘤组织的侵袭、远处转移及肿瘤耐药[20-21]。EMT是指上皮性细胞失去细胞极性转化为间质细胞的过程,间充质细胞可表现出更高的侵袭性及迁移性等恶性表型[22]。EMT在各种病理过程中同样发挥着重要作用,包括伤口愈合、组织纤维化和癌症进展[20-21]。EMT被分为三型:1型EMT指在胚胎发育阶段上皮细胞转化为运动间充质细胞;2型涉及伤口愈合和组织再生;3型发生在上皮性肿瘤细胞中与肿瘤进展和转移密切相关[23]。EMT的形成体现在上皮性标志物E-cadherin蛋白表达降低,同时伴有N-cadherin、Vimentin、Snail及Slug蛋白表达升高[24]。本研究同时检测沉默MFG-E8基因表达在mRNA水平及蛋白水平对EMT进程的影响,结果显示MFG-E8 siRNA可上调E-cadherin表达,同时抑制N-cadherin、Vimentin、Snail及Slug表达,证实沉默MFG-E8基因可逆转SKOV3细胞中的EMT形成过程。我们的结果与MFG-E8在恶性黑色素瘤及结直肠癌中的作用研究结果一致[5,25]。
综上,本研究提示在沉默MFG-E8基因可以增加肿瘤细胞对化疗药物的敏感度,并下调多重耐药蛋白ABCB1及ABCC1 mRNA水平的表达,说明MFG-E8与化疗耐药相关,并且沉默MFG-E8可抑制EMT进程。这将为表达MFG-E8的卵巢癌的治疗提供新思路。
