碘量法测定铜减少碘化钾加入量的探讨
2021-06-07郑佳慧潘雨欣开小明
郑佳慧 潘雨欣 开小明
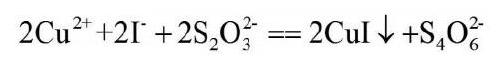
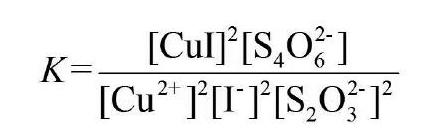
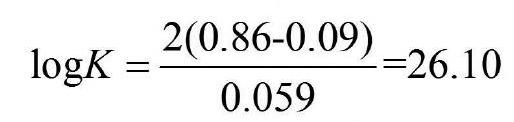
摘 要:本文推导了碘量法滴定铜碘化钾加入量,实验比较了加入不同量碘化钾实验结果。实验结果表明,只要终点时,游离碘化钾的浓度稍大于10-4mol/L即可满足实验要求,与标准分析方法结果无显著性差异,说明方法是可靠的。
关键词:碘量法;铜盐;碘化钾;平衡常数;显著性差异
中图分类号:O652 文献标识码:A 文章编号:1006-3315(2021)4-198-001
普遍采用碘量法测定含铜合金、铜矿石和铜盐中铜含量,由于食盐加碘,推高碘化钾试剂价格。有文献探讨碘量法测定铜减少碘化钾加入量[1-3],探讨减少碘化钾加入量具有一定经济价值和科学意义。
1.加入碘化钾量理论推导
碘量法测定铜总化学反应式:
反应平衡常数K为:
代入有关标准电极电位数据计算:
若终点时溶液中铜离子浓度为10-5mol/L,起始浓度为0.10mol/L,体积为25mL,考虑到溶液稀释,终点至100mL,则终点时连四硫酸根浓度约为0.0125mol/L,
这说明滴定终点时保证碘离子浓度不小于1.0×10-4mol//L,铜离子能够完全转化为CuI沉淀。
2.实验方法
参考文献4操作方法,用分析纯试剂和蒸馏水,配制0.10mol/L的铜离子和硫代硫酸钠溶液,20%(20g试剂稀至100mL)碘化钾(1.2mol/L)和硫氰化钾溶液,以及其它实验所需试液。取25mL铜离子溶液,分别加入不同量的碘化钾,相同量辅助试剂,用硫代硫酸钠滴定。
3.结果讨论
实验中加入2.5mL碘化钾,与铜离子完全反应后,理论计算游离的碘化钾浓度为5×10-3mol/L,超過理论要求的量。与文献4加入5mL碘化钾量,6次实验结果比较如表1:
上述数据通过F和t检验法检验,在95%的置信度下,检验值分别为1.61、0.18小于检验表值5.05、2.23,说明两种实验结果无显著性差异,实验中碘化钾与铜离子完全反应后,保证游离的碘化钾浓度大于10-4mol/L即可。实验观察和理论分析表明,碘化钾加入的量少,开始时与铜离子没有完全反应,生成CuI的量少,有利于减少CuI对I2的吸附,减少实验误差。
参考文献:
[1]肖必华.碘量法滴定铜的改进[J]理化检验(化学分册),1994,30(3):55
[2]曹双喜,黎成勇.对“碘量法滴定铜的改进”的异议[J]长沙大学学报,1998,12(4):88-89
[3]编辑.关于碘量法滴定铜的几个问题——答读者问[J]理化检验(化学分册),1996,32(4):50
[4]武汉大学等编.分析化学实验[M]北京:高等教育出版社,1994:166
