抗氧化Ag@Cu核壳结构的制备及其性能
2021-06-07迟聪聪白飞飞屈盼盼
迟聪聪, 张 萌, 夏 亮, 白飞飞, 屈盼盼, 许 馨
(陕西科技大学 轻工科学与工程学院 轻化工程国家级实验教学示范中心 陕西省造纸技术及特种纸品开发重点实验室 中国轻工业纸基功能材料重点实验室, 陕西 西安 710021)
0 引言
铜粉价格低廉,导电性能良好,但长期暴露在空气中表面易形成氧化膜,从而影响其导电性.银粉在导电性和抗氧化性方面均具有优势,但价格昂贵.以铜为核制备的Ag@Cu核壳结构,既具有优良的导电性能,还可节约成本[1],在导电油墨[2]、电磁屏蔽涂料[3]、薄膜印刷电极等领域的应用潜力较大[4-6].
制备Ag@Cu核壳结构的关键是在纳米铜表面镀银,主要方法有喷雾热解法[7]、置换反应法[8]和化学还原法[9].喷雾热解法可以控制银壳层的厚度,但所需成本较高,制备工艺复杂;置换反应法镀银[10]工艺简单,但需要多次镀层才能达到抗氧化效果,并且反应过程会消耗铜颗粒,导致产率不高;化学还原法镀银[11]是在置换反应镀银体系中加入还原剂和络合剂,络合银离子被还原为银颗粒沉积在纳米铜颗粒表面,同时遏制置换反应的进行,该方法不消耗铜颗粒,反应过程可控,表面银层致密均匀.
廖辉伟等[12]利用化学还原法合成Ag@Cu核壳结构,发现对纳米铜进行活化和敏化处理有助于改善其性能;Yu等[13]通过改进的多元醇还原方法,绿色合成了抗氧化的Ag@Cu核壳纳米粒子,平均直径约50 nm,并以其作为导电填料制备导电油墨,导电性能与银基导电油墨相当;Ouyang等[14]开发了一种合成Ag@Cu核壳结构的简单方法,通过L-抗坏血酸对作为种子的铜核表面的银盐进行还原,进而得到尺寸和形态较为均一的Ag@Cu核壳纳米粒子,在环境气氛下的抗氧化性能较好;Trinh等[15]使用聚乙烯吡咯烷酮作为表面活性剂,使用抗坏血酸和硼氢化钠作为还原剂还原金属配合物[Cu(NH3)4]2+和[Ag(NH3)2]+,合成了平均粒径为32 nm的Ag@Cu纳米粒子,且其悬浮液在空气中放置80天仍可稳定分散.
本研究采用化学还原法,以纳米铜颗粒为铜芯,硝酸银为银源,葡萄糖为还原剂,聚乙烯吡咯烷酮为分散剂,合成抗氧化的Ag@Cu核壳结构,探讨纳米铜前处理、络合剂、体系pH值、硝酸银用量、葡萄糖用量对核壳结构的影响.提出采用乙二胺作pH调节剂,可有效抑制铜氨离子的形成,制备的Ag@Cu核壳结构表面致密,无孔洞.
1 实验部分
1.1 实验试剂
硝酸银、乙二胺、氢氧化钠、三乙烯四胺、三乙醇胺、EDTA-二钠、无水乙醇(C2H5OH)和氨水(NH3·H2O),天津大茂化学试剂厂;聚乙烯吡咯烷酮(K=10),上海麦克林生化有限公司;葡萄糖,上海阿拉丁生化科技股份有限公司;所有试剂均为分析纯;纳米铜为实验室自制,制备方法参考本课题组前期的工作[16].
1.2 纳米铜的前处理
为使铜粉可以长时间保存,一般会选用有机物包覆提高其抗氧化性,本实验所用铜粉经油酸包覆处理,表面的有机物膜层不利于制备核壳结构,影响银微粒在铜颗粒表面的沉积,因此需要前处理.
称取自制的纳米铜颗粒0.128 g (0.002 mol),分别用5%稀盐酸溶液和去离子水以4 000 rpm转速离心清洗两次至纳米铜颗粒呈砖红色.本论文实验的铜粉用量均相等,为0.002 mol.
1.3 Ag@Cu核壳结构的制备
溶液A:在处理过的纳米铜颗粒中加入30 mL去离子水,再加入一定量的PVP,超声分散并磁力搅拌15 min至PVP完全溶解,形成纳米铜颗粒的PVP悬浮液,再加入pH调节剂调节体系pH.溶液B:称取一定量的葡萄糖,加入30 mL去离子水,磁力搅拌15 min后加入A液中,形成B液.溶液C:称取一定量的AgNO3,加入40 mL去离子水,磁力搅拌15 min后加入络合剂,溶液颜色由透明变浑浊再透明后,再滴加三滴络合剂,搅拌5 min,配成新制的银胺络合液.
将B液注入三口烧瓶,置于60 ℃水浴锅中,保持中速机械搅拌20 min后,用蠕动泵以14 rpm的速率将C液滴入B液中并继续机械搅拌,滴加完成后继续反应40 min.反应完成后,将反应体系分别用无水乙醇和去离子水离心洗涤三次,粉末产物置于45 ℃烘箱中干燥,干燥样品收集备分析用.
1.4 测试与表征
采用漏斗法[17](GB/T 1479)测试Ag@Cu的松装密度;通过高分辨率扫描电子显微镜(SEM,FEI Verios 460,FEI,美国)在10 kV电压下观察Ag@Cu的微观结构,表征其表观形貌和分散程度;利用X射线衍射仪(XRD,D/max 2200PC,Rigaku Industrial,日本)表征Ag@Cu的包覆情况;采用同步热分析仪(TG-DSC,STA449F3-1053-M,TA,美国)分析Ag@Cu的热稳定性.
2 结果与讨论
2.1 纳米铜前处理对核壳结构的影响
选用三乙醇胺为络合剂,葡萄糖为还原剂,PVP为分散剂,铜粉、葡萄糖、PVP与AgNO3的摩尔比依次为4∶3、2∶1、2∶1.用NaOH溶液调节体系pH为9,60 ℃下反应40 min.铜粉处理前后的相关性能参数如表1所示.
由表1中数据可得,未经处理的纳米铜粉制备的核壳结构粉末表观颜色为黑色且无光泽,松装密度较小,涂层的电阻率较大,在300 ℃范围内氧化增重幅度较大.而经过前处理后,制备的核壳结构各性能参数均有所改善,说明前处理工艺可以极大提高核壳包覆的完整度及性能.

表1 纳米铜前处理对核壳结构的影响
2.2 pH调节剂与络合剂对核壳结构的影响
络合剂是影响核壳结构的主要因素之一,其与银离子络合直接决定镀液的稳定性、镀层的致密性以及镀银层的产率.不同络合剂与pH调节剂下Ag@Cu核壳结构的相关性能参数如表2所示.其他相同条件:铜粉、葡萄糖、PVP与AgNO3的摩尔比依次为4∶3、2∶1、2∶1,pH为9.
由表2不难看出,采用乙二胺作pH调节剂的效果明显优于采用NaOH的.乙二胺作pH调节剂时,三乙醇胺作络合剂,核壳结构表观颜色为银白色,产率很高,电阻率偏高;三乙烯四胺作络合剂时,Ag@Cu的表观颜色为银灰色,电阻率高,但松装密度较大,且产率偏高;络合剂为氨水时,表观颜色为银白色,松装密度较大,电阻率低,产率适中;络合剂为EDTA-二钠时,所得样品颜色为银灰色,电阻率偏高,且产率不高.总的来看,以氨水作络合剂的综合效果不错.

表2 络合剂与pH调节剂对核壳结构的影响
用NaOH调节体系pH时,镀层颜色较为黯淡,原因可能是在反应初始阶段,置换反应使铜颗粒表面生成部分游离的Cu2+,银络合液加入后,游离氨离子会与Cu2+形成铜氨配离子[Cu(NH3)4]2+,如式(1)所示.铜氨配离子比银氨离子性质活泼,会优先附着在铜颗粒表面,络合银离子被还原为银微粒后不能正常沉积到纳米铜颗粒表面,造成镀层稀松,呈点缀状.
当采用乙二胺调节体系pH时,根据式(2),乙二胺与Cu2+发生螯合作用形成Cu[(C2H8N2)2+]2+.图1显示,Cu2+的配位数为4,2个乙二胺分子与Cu2+形成2个稳定的五元环螯合物,而Cu2+与氨水形成普通配合物,所以Cu[(C2H8N2)2]2+比[Cu(NH3)4]2+性质更稳定[18].根据化学反应动力学,加入乙二胺后Cu2+不再与氨离子络合,从而抑制了铜胺配离子[Cu(NH3)4]2+的生成,络合银离子被还原为银微粒后能够正常沉积到纳米铜颗粒表面,从而形成完整的包覆结构.
Cu2++4NH3·H2O=[Cu(NH3)4]2++4H2O
(1)
Cu2++NH2(CH2)2NH2=Cu[(C2H8N2)2]2+
(2)
以氨水为络合剂,制备核壳结构的SEM图如图2所示.可以看出,NaOH调节pH时,核壳结构呈稀松点缀状包覆在铜表面,还存在铜裸露的现象;采用乙二胺时,银微粒包覆致密,形成了完整的核壳结构.图3的XRD结果显示,以乙二胺作pH调节剂时,产物在银的JCPDS标准谱图特征衍射晶面(Ag(111)、(200)、(220)、(311)和(222))出现了纯净的吸收峰,而以氢氧化钠调节pH时,除了上述五个特征衍射峰,产物还出现了Cu((111)、(200)和(220)晶面)的特征峰.这表明后者包覆不完整,纳米铜颗粒表面裸露,与SEM结果一致.

(a)氢氧化钠 (b)乙二胺

(c)未包覆图2 不同pH调节剂下Ag@Cu的SEM图及未包覆的纳米铜的SEM图

图3 两种pH调节剂下Ag@Cu的XRD图
综上,乙二胺既能调节体系的pH值,还可优先与游离的Cu2+形成稳定的螯合物,抑制铜胺配离子的生成,促进银微粒在铜颗粒表面的沉积.因此后续研究选取氨水作络合剂,乙二胺作pH调节剂来制备Ag@Cu核壳结构.
2.3 pH值对核壳结构的影响
在制备Ag@Cu核壳结构过程中,反应速率过快会导致银微粒沉积速度过快,银壳层包覆不均匀甚至银微粒单独聚集形成银镜的现象.反应速率过慢会导致银微粒沉积缓慢,纳米铜颗粒发生沉降,出现包覆不完整的现象.
通过调节反应体系的pH可以控制反应速率.一般来说,体系pH值越小,反应速率越慢,体系pH值越大,反应速率越快.由于银氨溶液在pH为6~13可以稳定存在,故体系的pH值有一定的调节范围.实验条件:铜粉、葡萄糖、PVP与AgNO3的摩尔比依次为4∶3、2∶1、2∶1.
由表3数据可以看出,当pH为6.5~9时,产物的表观颜色从灰黑色到银灰色,上清液颜色为深蓝色和浅蓝色,表明有铜络合物存在,氯离子检测有沉淀生成,表明上清液中含有游离的银离子,电阻率也较大,可能上述条件下反应不完全;当pH为9.5~10时,表观颜色为银白色,只出现微量银镜,且上清液无色,未出现白色沉淀,电阻率较小,表明该pH值范围较为合适;当pH>10.5时,产物颜色变暗淡,瓶壁出现大量银镜,此时反应速率极快,一部分银微粒自发团聚并附着在瓶壁上,造成浪费,且在上清液检测到银离子,表明过快的反应速率抑制了一部分银离子被还原,此时表现出较大的电阻率.
综上,优化的pH值范围为9.5~10,后续研究均采用此pH值范围.

表3 pH值对核壳结构的影响
2.4 C6H12O6∶AgNO3摩尔比对核壳结构的影响
本研究以氨水为银离子络合剂,银前驱体被葡萄糖还原为银微粒,再沉积到悬浮的铜颗粒表面,形成Ag@Cu核壳结构.如式(3)和(4)所示,理论摩尔比为C6H12O6∶AgNO3=1∶2,但实际并不符合该比例.因此,本部分探讨了葡萄糖用量的影响(AgNO3用量不变),其他相同条件为:Cu∶AgNO3=4∶3;PVP∶AgNO3=2∶1.
2AgNO3+3NH3·H2O=2Ag[(NH3)2]OH+
NH4NO3
(3)
CH2OH(CHOH)4CHO+2Ag[(NH3)2]OH=
CH2OH(CHOH)4COONH4+2Ag↓+
3NH3↑+H2O
(4)
不同葡萄糖与硝酸银摩尔比的核壳结构相关性能如表4所示.当C6H12O6∶AgNO3=1∶2时,制备的产物颜色呈黑红色,上清液检测出现大量白色沉淀,此时产率只有32.2%,电阻率极大.说明理论葡萄糖用量不足以将银氨溶液完全还原为银,原因可能是葡萄糖溶液在反应体系中还起着保护剂的作用,防止反应过程中纳米铜颗粒的氧化.当反应结束后,未完全包覆的产物粉末快速氧化,颜色呈黑红色,涂层电阻率也随之增大.进一步增大摩尔比至2∶1,产物颜色变为银灰色,上清液出现微量沉淀,电阻率大幅度下降.继续增大摩尔比至8∶3时,上清液检测不出白色沉淀,产率提升至90.2%,表明银离子被完全还原,同时电阻率降为3.8×10-4Ω·cm.继续增大摩尔比至3∶1,产物各项性能无明显变化.

表4 C6H12O6∶AgNO3摩尔比对Ag@Cu性能的影响
2.5 Cu∶AgNO3摩尔比对核壳结构的影响
提高AgNO3用量可以提高产物的导电性能和抗氧化性能,但也会增加成本,故应在保证核壳结构性能的基础上最大限度地减少硝酸银用量.实验条件:葡萄糖、PVP与AgNO3的摩尔比分别为2∶1、2∶1.
对样品进行XRD表征,结果如图4所示.当Cu∶AgNO3摩尔比为5∶1时,样品表观颜色为黑色无光泽,XRD图谱中铜元素的吸收峰强度远大于银元素的吸收峰强度,表明该比例下几乎不能进行核壳包覆.随着Cu∶AgNO3从4∶1降低至1∶1,图4中Cu的(111)、(200)和(220)晶面特征峰强度发生明显变化,Cu∶AgNO3摩尔比降至4∶3时,已无铜元素的特征峰出现,表明此时硝酸银用量能够完全包覆纳米铜颗粒,进一步增大硝酸银用量至摩尔比1∶1,图谱无明显变化.
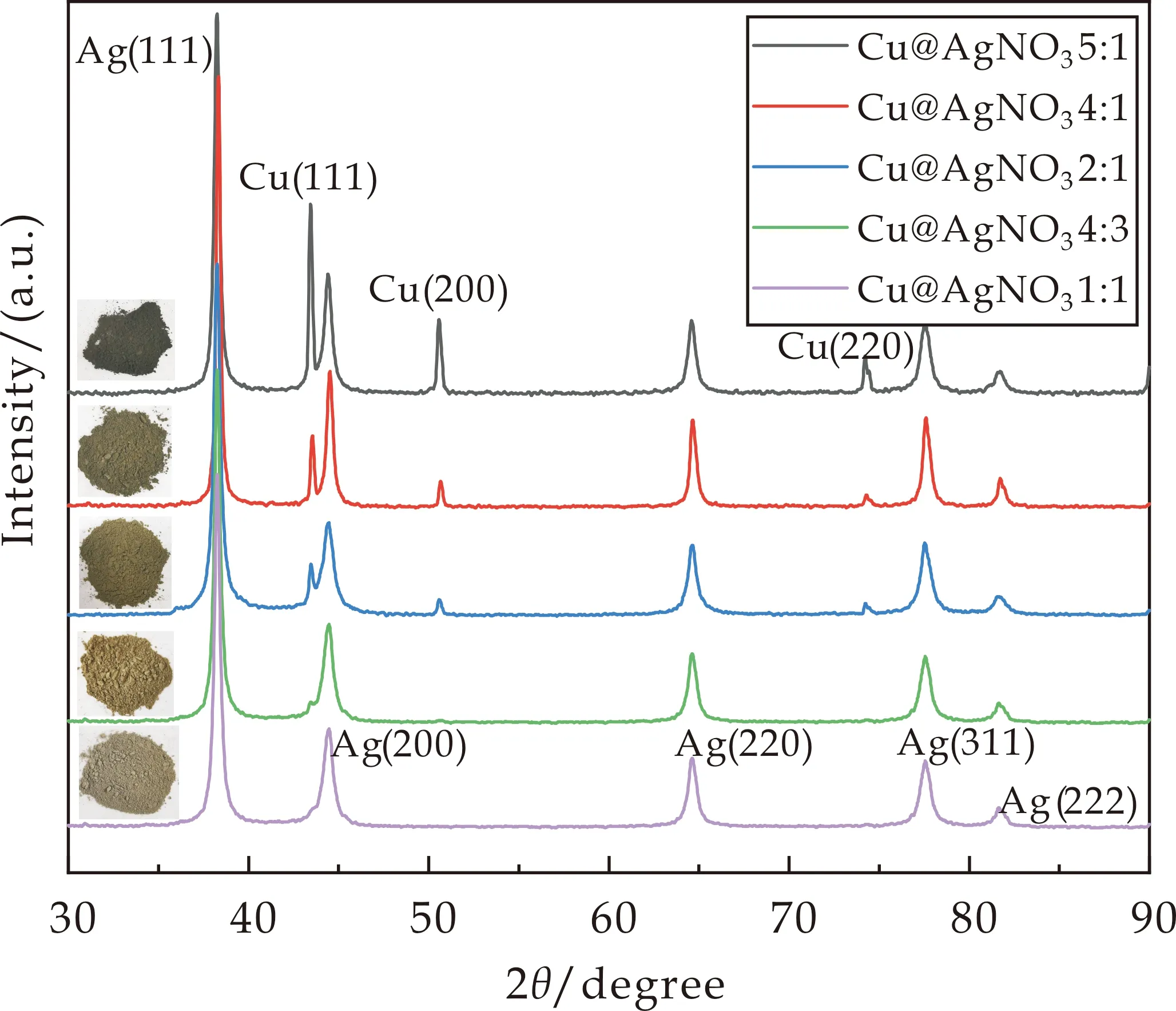
图4 不同摩尔比下Ag@Cu的XRD图
样品的SEM图如图5所示.当Cu∶AgNO3摩尔比为4∶1时,产物出现铜颗粒裸露和单独存在的银微粒,在纳米铜颗粒表面只有稀松的点缀状包覆和岛状包覆,与XRD结果一致,此时硝酸银用量不足;当摩尔比为2∶1时,产物表面出现较为均匀的点缀状包覆,但仍有部分铜颗粒表面裸露,此时包覆仍不完全;当进一步调整Cu∶AgNO3摩尔比为4∶3时,制备的产物已经形成完整的包覆层,观察不到铜颗粒表面的裸露现象,且包覆层致密,无孔洞及稀松包覆现象,表明此摩尔比较为合适;当Cu∶AgNO3摩尔比为1∶1时,基本观察不到单独存在的颗粒,颗粒之间呈连接状或相邻颗粒合并为大颗粒,导致包覆壳层过厚,表明该比例下硝酸银用量过多.

(a)Cu∶AgNO3=4∶1

(b)Cu∶AgNO3=2∶1

(c)Cu∶AgNO3=4∶3

(d)Cu∶AgNO3=1∶1图5 不同摩尔比下Ag@Cu的SEM图
为进一步确认核壳结构的包覆效果,对样品进行TEM和EDS分析(如图6所示).TEM图中浅色部分代表银元素,深色部分代表铜元素.从图6(a)可以看出,球状结构的内层为深色的铜芯部分,外层由浅色的银壳层包覆,且包覆层厚度较为均匀,无包覆缺陷,分散性较好;从图6(b)可以看出,产物形成链状结构,包覆效果不理想;根据图6(c)可知,当Cu∶AgNO3摩尔比为4∶3时,产物铜含量为39 wt%,银含量为61 wt%,Cu∶Ag摩尔比约为1.078∶1.银元素和铜元素峰强度大,且基本无杂质元素,表明样品纯度较高;银元素分布散点图较为均匀,无大面积团聚现象,表明制备的结构分散性能较好;图中未出现氧元素特征峰,证实了该摩尔比下已经形成完全包覆结构.

(a)Cu∶AgNO3=4∶3 (b)Cu∶AgNO3=1∶1

(c)Cu∶AgNO3=4∶3图6 不同摩尔比下Ag@Cu的TEM图和EDS图
Ag@Cu的粒径分布图如图7所示.可以看出,随着Cu∶AgNO3摩尔比从4∶1增加至4∶3,产物的平均粒径从87.99 nm逐渐增大至100.05 nm,均一性也逐步提高,表明随着硝酸银用量的增加,硝酸银被还原为银微粒从均相成核和异相成核两种状态逐渐转变为异相成核状态,即生成的银微粒以沉积的形式包覆在铜颗粒的表面.当Cu∶AgNO3摩尔比增大至1∶1时,产物的粒径增大至117.03 nm,根据对应的SEM图可以看出,过多的银微粒在核壳结构之间相互堆积,形成交联状结构,此时基本无单独存在的包覆结构,粒径的均一性也较差.分析可得,当Cu∶AgNO3摩尔比为4∶3时,包覆效果最好,此时粒径平均值为100.05 nm.

(a)Cu∶AgNO3=4∶1
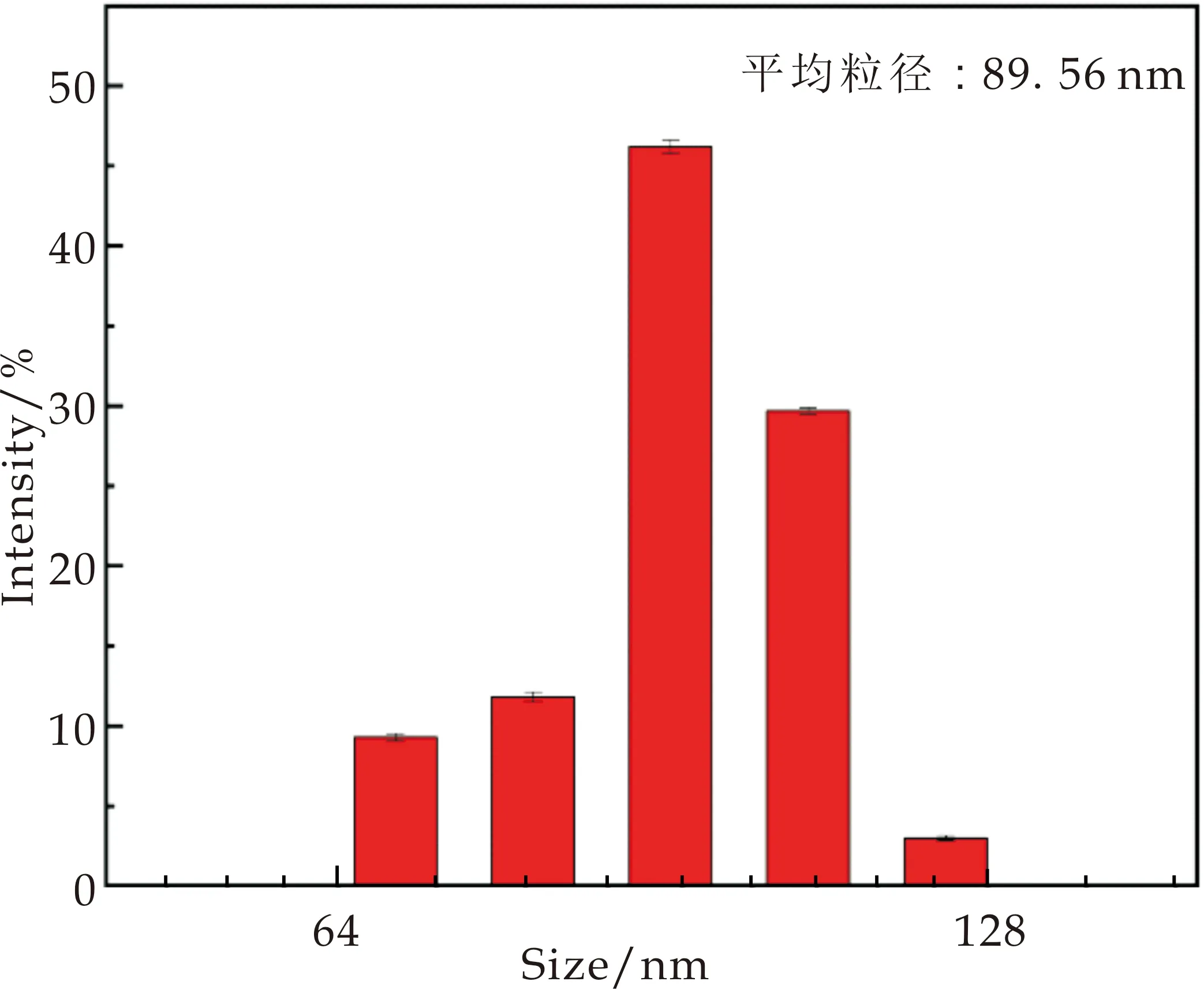
(b)Cu∶AgNO3=2∶1

(c)Cu∶AgNO3=4∶3

(d)Cu∶AgNO3=1∶1图7 不同摩尔比下Ag@Cu的粒径分布图
为探讨产物的热稳定性,对其进行热分析,结果如图8所示.可以看出,在升温初始阶段40 ℃~80 ℃范围内,产物都表现出了大幅度的失重现象,可能与包覆后表面变成粗糙面、表面积增加有关,较大的表面积有助于吸附更多的水分子,所以此温度范围内的失重也较大.随着AgNO3用量的增加,包覆核壳结构的粒径增加,表面积增大,从而因脱湿导致的失重越大.继续升温,四种产物表现出不同的热变化曲线.
Cu∶AgNO3摩尔比为4∶1时,在升温过程中表现出缓慢的上升趋势,可能是由于硝酸银用量不足造成包覆不均匀或者包覆不完全,裸露的铜颗粒在升温过程中由于氧化而增重;Cu∶AgNO3摩尔比为2∶1时,曲线在74 ℃~265 ℃范围内呈下降趋势,可能是产物表面的PVP分解导致重量降低,在265 ℃~280 ℃出现增重现象,可能是PVP完全分解,但仍旧有部分铜颗粒表面裸漏,造成铜的氧化增重,280 ℃之后趋于平稳,不再发生变化;Cu∶AgNO3摩尔比为4∶3时,热重曲线在81 ℃~400 ℃温度范围内基本呈直线状,无下降趋势,表明此条件下PVP用量适度并已洗涤干净,产物重量随温度升高基本保持不变,表现出良好的热稳定性;Cu∶AgNO3摩尔比为1∶1时,热重曲线在75 ℃~194 ℃范围内呈缓慢下降趋势.由于纳米铜用量不变,该比例下的AgNO3用量最多,葡萄糖和PVP用量也最多,这可能会导致产物洗涤不完全,从而在升温过程中,葡萄糖和PVP的分解会造成样品失重.194 ℃~400 ℃范围内曲线趋于平直,产物重量不再发生变化.

图8 不同摩尔比下Ag@Cu的TG图
3 结论
选用自制纳米铜为核,以硝酸银为银源,氨水为络合剂,乙二胺为pH调节剂,葡萄糖为还原剂,聚乙烯吡咯烷酮为分散剂制备Ag@Cu核壳结构.研究发现,纳米铜在氨水和乙二胺的共同作用下形成比[Cu(NH3)4]2+更稳定的Cu[(C2H8N2)2]2+,更利于银微粒的完整致密包覆;反应体系pH值、硝酸银用量、葡萄糖用量对制备产物的纯度和产率都有很大影响.包覆改性的优化条件为:先用5%稀硫酸和去离子水洗涤三次铜芯,乙二胺调节pH值9.5~10,铜粉、葡萄糖、PVP与AgNO3的摩尔比依次为4∶3、8∶3、2∶1,在60 ℃下反应40 min,可制得粒径较为均一(约100 nm)、包覆效果良好、导电性能优异(3.8×10-4Ω·cm)、产率达90.6%,且81 ℃~400 ℃范围内能够保持良好热稳定性的Ag@Cu核壳结构.
