会仙湿地典型河流抗生素污染特征及风险评价
2021-06-05夏飞扬马冬冬王敦球
夏飞扬, 马冬冬, 张 军, 王敦球
(桂林理工大学 a.广西环境污染控制理论与技术重点实验室; b.岩溶地区水污染控制与用水安全保障协同创新中心;c.环境科学与工程学院, 广西 桂林 541006)
0 引 言
抗生素是微生物、植物和动物在其生命活动过程中所产生的(或由其他方法获得的)有机代谢产物, 它能在低微浓度下选择性地抑制或影响其他生物的次级代谢产物及其衍生物[1]。由于抗生素存在持续使用、人体或兽体内代谢程度低的特点, 且低浓度抗生素可强化耐药性基因的产生和传播, 因此, 环境中抗生素的广泛残留, 成为全球面临的重要环境问题之一[2]。尽管大多数抗生素的半衰期并不长, 但由于其被频繁地使用, 重复进入水体环境, 并不断通过食物链富集最终进入人体, 形成一种“假持续”现象。有研究表明, 多数抗生素在人和动物体内都不能代谢完全, 30%~90%未被吸收的抗生素以原形或活性代谢产物的形式通过尿液和粪便排出体外[3]。
抗生素一旦进入环境中, 可通过吸附、水解、光降解及生物降解等过程产生一系列代谢及降解产物[4], 进而对整个生态系统构成长期的潜在危害。 中国是抗生素生产和使用大国, 我国的各大河流、海洋和湖泊系统, 如长江流域[5]、珠江流域、辽河流域[5]、太湖流域[6]和莱州湾[7]、北部湾[8]、渤海湾[9]等水体中均有抗生素检出, 检出率高达100%, 且在生态风险评价中氟喹诺酮类抗生素均表现出高风险等级。但与河流、海洋和湖泊等水体环境相比, 关于湿地系统中抗生素污染特征的研究还相对较少。
岩溶湿地具有生态环境脆弱、恢复周期长等特点, 应对其可能存在的抗生素污染给予更多关注。会仙湿地是中国最大的岩溶湿地, 被誉为“漓江之肾”, 是漓江流域最大的喀斯特地貌原生态湿地, 具有保持水源、净化水质、蓄洪抗旱、维护生物多样性等重要的环境调节功能和生态效益[10]。该湿地风貌及其周边环境不仅在广西是独一无二的, 在全国乃至全球峰林岩溶平原风貌中也极为罕见, 是极具研究价值的典型湿地[11]。近年来, 随着周边人口急剧增加, 人类活动不断增强, 湿地生态系统遭到严重破坏[12]。本文以会仙湿地典型河流为研究对象, 分析其地表水、沉积物和植物中抗生素的含量水平、分布特征及水生植物对抗生素的富集能力, 并对地表水的生态风险进行了评估, 以期对会仙湿地的污染防治及环境保护提供科学的参考依据。
1 研究区概况
会仙湿地位于桂林市临桂区会仙镇, 北纬25°5′20″—25°6′46″, 东经110°9′50″—110°14′30″。该区域属于中亚热带湿润季风气候, 年平均气温为16.5~20.5 ℃, 以北风和东北风为主。年降雨量约1 890.4 mm, 降雨时空分布不均, 春夏雨多而集中, 秋冬少雨而干旱[13]。会仙湿地总体地势南北高、中间低。研究区为会仙湿地的核心区, 主要选取古桂柳运河和睦洞河为研究河段。研究区的东西两侧分别为良丰河和洛清江, 贯穿研究区中部的古桂柳运河将两河流相连(图1)。

图1 采样点分布图Fig.1 Sampling points distribution map
2 材料与方法
2.1 样品的采集
样品采集时间为2018年5—8月(夏季)和9—10月(秋季), 分别采集地表水、沉积物和植物样品。研究的抗生素包括: 氟喹诺酮类(氧氟沙星(OFL), 环丙沙星(CIP)); 四环素类(四环素(TC)); 磺胺类(磺胺嘧啶(SDZ), 磺胺甲二唑(SMX), 磺胺甲基嘧啶(SMR), 磺胺甲恶唑(SMZ)); 抗菌增效剂(甲氧苄氨嘧啶(TMP))。本研究所选河段主要为分水塘东流至良丰河附近段, 以及分水塘西流穿过会仙喀斯特国家湿地公园, 而后沿睦洞河北流至会仙喀斯特国家湿地公园001号界碑段, 所选河段全长约13 km, 每隔1 km左右进行样点的布设, 其中部分河段样点根据周围环境进行加密布设, 共布设12个采样点(图1、表1)。其中, 样点1~4位于分水塘以东, 样点5~12位于分水塘以西, 是湿地核心区, 潜在污染源多, 故加密布设样点。

表1 取样点位置概况Table 1 Location overview of sampling points
2.1.1 地表水样品 采样时分别使用1 L棕色试剂瓶装满样点处表层(0~50 cm)地表水, 难以直接到达的区域使用吊桶采集后转移至棕色试剂瓶中。每个样点周围50 m范围内采集3份重复样品, 共计36份样品。样品储存于专用冷藏箱中, 12 h内带回实验室后, 先以硫酸溶液调节样品pH至3.0左右, 再向每升样品中加入50 mL甲醇以抑制微生物对目标化合物的降解。最后将其储存于4 ℃冷藏箱中, 并于2 d内完成试样的制备。
2.1.2 沉积物样品 根据地表水中抗生素含量特征, 选择样点1、5和7处的沉积物进行采集。采用柱状采样器(聚创801A, 长100 cm、直径4 cm)采集表层(0~10 cm)沉积物, 用锡纸包裹后储存在自封袋中。每个样点周围50 m范围内各采集3份重复样品, 共计9份样品。样品储存于专用冷藏箱中带回实验室冷藏于-20 ℃左右冷柜内, 于2 d内对样品完成冷冻干燥处理。将冷冻干燥后的样品研磨过60目(0.25 mm)不锈钢筛, 再将筛下物密封保存于-20 ℃环境中。
2.1.3 植物样品 根据地表水中抗生素的含量特征, 选择样点1、5和7处的植物根、茎和叶样品。在有植物生长的地表水和沉积物样点周围0.5 m范围内采集生长旺盛、病虫害少的植物样品, 保存于密封袋中, 并储存于4 ℃冷藏箱中。于2 d内先使用自来水冲洗干净植物的根、茎和叶部, 再用超纯水清洗, 然后使用剪刀对植物的根、茎和叶进行分离, 随后进行冷冻干燥, 最后将冷冻干燥后的植物样品粉碎, 并过10目(2.00 mm)的不锈钢筛后, 置于-20 ℃环境中密封储存。
2.2 样品预处理与分析
2.2.1 样品预处理 (1)地表水样品: 先使用循环水式多用真空泵配合孔径为0.45 μm滤膜过滤地表水样品。量取1 000 mL过滤后水样, 加入0.5 g乙二胺四乙酸二钠(EDTA), 使用固相萃取仪(ASPE 799, 吉尔, 日本)萃取水样。固相萃取的步骤依次为活化、上样、吸附和洗脱, 即先分别用10 mL甲醇(色谱纯, Tedia, 美国)和10 mL超纯水活化固相萃取柱(Bond Elut-SAX, Agilent, 美国)。水样以5 mL/min的流速通过小柱进行富集, 随后用10 mL超纯水淋洗小柱并吹干, 再用10 mL甲醇以0.5 mL/min的流速洗脱小柱, 洗脱液接收于棕色收集管中; 然后用氮吹仪吹干洗脱液(温度低时于40 ℃水浴温度下吹干); 最后用1.0 mL甲醇溶解, 经0.22 μm滤膜过滤后, 于-20 ℃以下避光保存, 待使用高效液相色谱-串联质谱仪(HPLC-MS/MS)进行分析。
(2)沉积物和植物样品: 称取过60目(0.25 mm)不锈钢筛的沉积物或植物样品2.0 g, 先加入以1∶1(V/V)磷酸盐缓冲液(1 L的0.1 mol/L柠檬酸溶液和625 mL的0.2 mol/L 磷酸氢二钠溶液相混合配制成McIlvaine缓冲溶液)-乙腈混合液配制的溶液(pH≈4)6 mL, 再以漩涡混匀器振荡1 min, 随后超声提取15 min, 所得提取液再冷冻离心(TGL-18000cR, 安亭, 中国)15 min(4 ℃, 6 000 r/min), 收集上层提取液。反复提取5次后, 合并提取液于60 mL棕色试剂瓶中, 吹扫除去乙腈并以超纯水稀释定容至250 mL, 加入0.1 g EDTA, 以2 mol/L HCl溶液调节样品pH≈4, 按上述地表水的富集方法进行萃取。
2.2.2 预处理样品的抗生素上机分析 使用安捷伦串联四级杆液质联用仪(1200-6410B, Agilent, 美国)对样品中的抗生素进行分析。液相色谱条件为: 液相色谱柱为Agilent XDB-C18(150 mm×2.1 mm, 5 μm), 流动相A和B分别为含0.1%甲酸(色谱纯, Aladdin, 美国)的水溶液和含0.1%甲酸的乙腈溶液, 进样量5 μL, 流速为0.3 mL/min; 质谱条件: 采用电喷雾离子源(ESI)的正离子模式, 干燥气温度300 ℃, 干燥气流速10 L/min, 毛细管电压3 500 V,MS1与MS2温度均为100 ℃, 喷雾针压力30 Psi(206.85 kPa), 碰撞气为氮气, 检测方式为选择多离子反应监测(MRM)模式, 采用外标法进行定量分析。

表2 抗生素及其内标的串联质谱检测参数Table 2 Detection parameters of antibiotics and internaltargets by tandem mass spectrometry
2.2.3 质量保证与质量控制 在优化试验条件的情况下, 均采用外标法进行定量分析。8种抗生素的线性方程的R2均大于0.99。在加标浓度均为20 ng/L时, 地表水回收率为13.48%~131.24 %, 沉积物回收率为98.04%~168.46%, 植物回收率为73.83%~164.00%。
2.3 植物富集能力评价方法
植物富集系数法[14](bioaccumulation factor, BAF)主要用于反映植物从土壤中吸收重金属的能力。本文将其用于分析整株植物从地表水、沉积物中吸收抗生素的能力。由于所选湿地植物为浮水植物水葫芦, 其各部位与地表水、沉积物两个介质接触面广而复杂, 故计算整株植物中抗生素的富集情况更具意义, 其计算公式为
BAFi=Cp/Cw,
(1)
式中:BAFi为植物中抗生素i相较于地表水或沉积物中抗生素i的富集系数;Cp为整株植物中抗生素元素i的浓度,μg/kg;Cw为植物样点所在位置处地表水或沉积物中抗生素元素i的浓度,ng/L。
2.4 生态风险评估方法
根据欧盟技术指导文件(TGD)中关于环境风险评价的方法, 药品在环境中的生态风险可以根据风险熵值(RQi)大小来评估[15]。RQi通过污染物的环境实测浓度与预测无效应浓度的比值获得[16]
(2)

(3)
(4)
式中:MECi为环境中抗生素i实测浓度,ng/L;PNECi为抗生素i预测无效应浓度,ng/L;LC50i和EC50i分别为抗生素i的半致死质量浓度和半最大效应质量浓度,ng/L;NOECi为抗生素i的最大无效应浓度,ng/L;AFi为抗生素i的评价因子;RQcom为多种抗生素联合毒性风险值。当采用急性毒性数据LC50i和EC50i时,AFi取值1 000,当采用慢性毒性NOECi数据时,AFi取100。
3 结果与讨论
3.1 地表水中抗生素的空间分布特征
对12个样点夏、秋季地表水中的抗生素含量进行测定分析。 夏季地表水样品除SMX和SMR的检出率为0, OFL、CIP和SDZ的检出率为41.67%外, 其余各种抗生素检出率均高于50%; 秋季各类抗生素检出率均大于90%。 夏季SMX和SMR未检出, 这与彭聪等[17]对会仙湿地典型抗生素污染特征研究结果一致。夏、秋两季地表水中抗生素含量数据取对数函数绘制箱线图, 如图2所示。
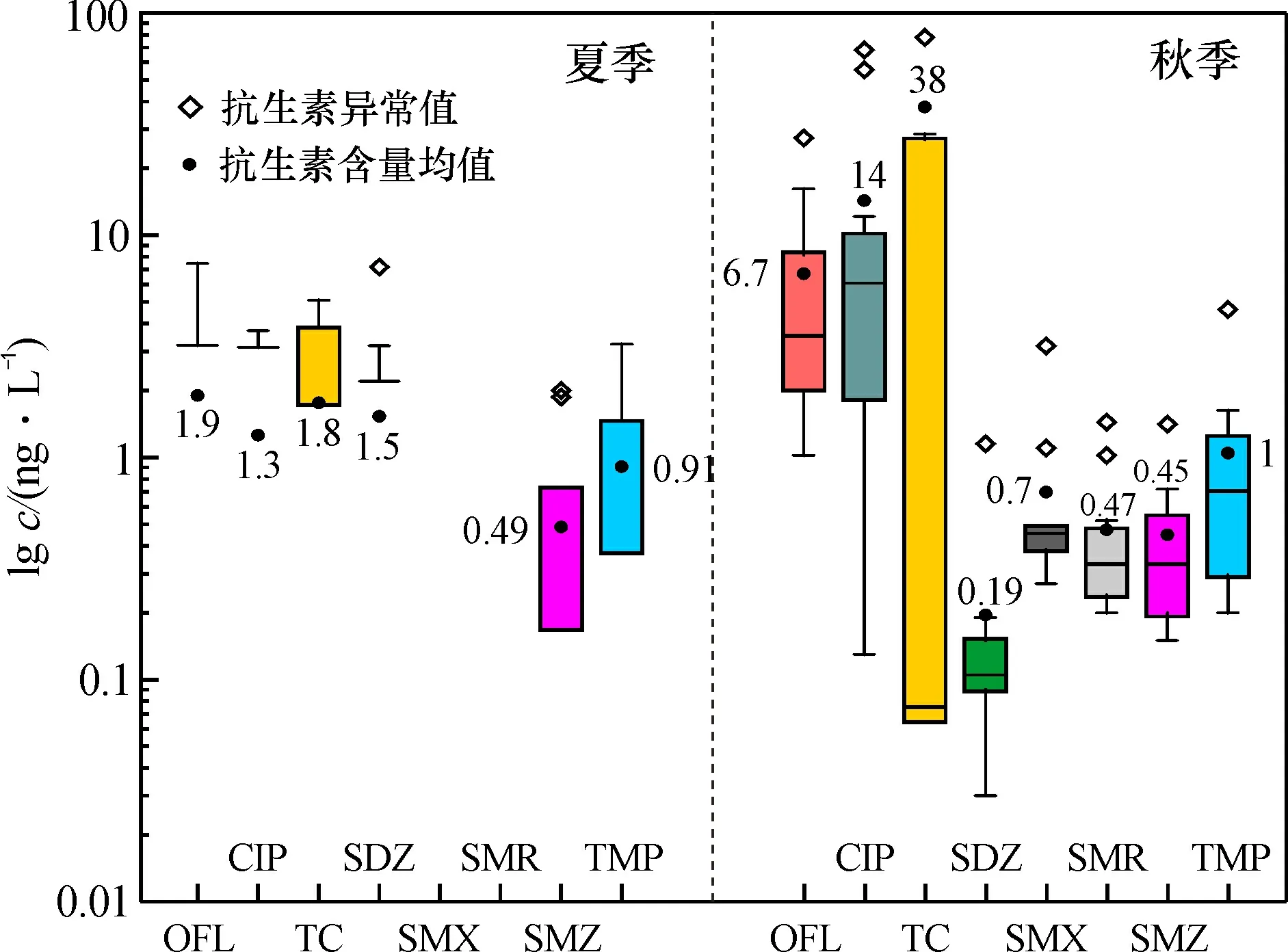
图2 夏、秋季地表水中抗生素含量对数分布图Fig.2 Logarithmic distribution of antibacterial contents of surface water in summer and autumn
两季地表水中, TC含量均值19.74 ng/L较高, CIP和OFL次之, TMP、SDZ、SMZ、SMX和SMR则相对较低。地表水夏季和秋季抗生素的含量变化较大, 可能与研究区的水产养殖、农田播种和病虫害防治时抗生素的使用量、使用方式和使用时期密切相关。张晓娇等[5]对辽河流域地表水中的研究显示, 其地表水中OFL、CIP、SMX和TMP的含量均值分别为37.93、11.60、84.90、113.40 ng/L, 本研究中OFL、CIP、SMX和TMP的含量均值为4.225、7.73、0.7、0.975 ng/L, 相比于辽河流域, 本研究地表水中OFL、CIP、SMX和TMP的含量处于较低水平, 仅TC含量超过辽河流域地表水的检出值(0.57 ng/L)。与薛保铭[18]和伍婷婷等[19]对广西邕江水体中磺胺类和抗菌增效剂的研究相比, 本研究中SDZ、SMX、SMZ和TMP的含量均值也均低于其干流及支流中的含量均值, 表明SDZ、SMX、SMZ和TMP的污染程度较低, TC、CIP和OFL是造成水体污染的主要污染物。总体上, 氟喹诺酮类、四环素类和抗菌增效剂秋季时的含量均值比夏季时高。两季地表水中4类抗生素含量均值的高低顺序为四环素类>氟喹诺酮类>磺胺类>抗菌增效剂。
随着降雨、光照强度、温度、微生物活性等因素的变化, 抗生素浓度在不同季节随时会发生变化[20]。磺胺类(SDZ、SMX、SMR、SMZ)抗生素容易被生物降解, 会仙湿地夏季高温高湿的环境会加快微生物的活性, 加速磺胺类抗生素的降解[21], 这可能是造成磺胺类抗生素夏季浓度普遍低于秋季的主要原因, 也造成了夏季SMX、SMR未检出, 而在秋季检出。氟喹诺酮类(OFL、CIP)抗生素具有水解稳定性, 不易水解, 且光解能力较弱[22], 降雨量的大小是氟喹诺酮类抗生素浓度在四季中变化的主要因素。四环素类(四环素(TC))抗生素在太阳光的照射下会发生光降解反应[23], 降解速率与太阳光的强弱呈正比, 夏季湿地日照充足, 日照时间也比秋季更长, 所以四环素类抗生素浓度夏季比秋季更低。
四环素类抗生素主要用于治疗人类和动物疾病, 氟喹诺酮类抗生素是一种人兽共用药, 常被用于家禽疾病的防治[24]。实地调查表明, 样点4~11沿线广泛分布畜禽养殖和水产养殖, 水域汇集了大量农业废水。由于养殖业大量使用抗生素, 导致畜禽粪便中含有大量的抗生素, 这些粪便经过地表径流进入水体, 会大大增加水体中抗生素的含量, 这与三峡水库[4]、辽河流域[5]结果一致。广泛存在且长期持续排放的农业废水可能是造成湿地抗生素污染的主要原因。而样点2和3为工业和居民生活混合区, 人口相对密集, 产生了较多的生活污水和工业废水。同时地处湿地核心区的样点9和10为居民聚居地和旅游观光区, 居民和游客也会产生大量生活污水, 生活污水和工业废水的排放, 也会导致湿地水体中四环素类和氟喹诺酮类抗生素的残留量较高。会仙湿地4类抗生素均受到季节变化的影响, 并且在地域空间上表现出不同的分布特征。研究结果表明, 会仙湿地抗生素污染的主要来源可能是农业废水, 其次是居民聚居地产生的生活污水。
3.2 沉积物中抗生素的空间分布特征
对3个样点(点1、5和7)中的抗生素含量进行测定分析, 沉积物样品中夏、秋季8种抗生素中除TC的检出率为66.67%外, 其余7种的检出率均为100%。对夏、秋两季沉积物中抗生素含量数据取对数函数绘制箱线图, 如图3所示。

图3 夏、秋季沉积物中抗生素含量对数分布图Fig.3 Logarithmic distribution of antibacterial contents of sediments in summer and autumn
两季沉积物抗生素中,TC含量均值(2.86 ng/g)较高, CIP和OFL次之, TMP、SDZ、SMZ、SMX和SMR则相对较低。与刘叶新等[25]对珠江沉积物的典型抗生素研究相比, 本研究两季沉积物中SDZ、SMX、SMR、SMZ和TMP的含量均值0.06、0.02、0.02、0.02、0.02 ng/g均低于珠江两季沉积物中SDZ、SMX、SMR、SMZ和TMP的含量均值1.565、0.295、1.39、9.41、4.785 ng/g。与薛保铭[18]和伍婷婷等[19]对广西邕江沉积物中磺胺类和抗菌增效剂的研究相比, 本研究中SDZ、SMX、SMZ和TMP的含量均值也均低于其干流及支流中的此4种抗生素的含量均值。表明SDZ、SMX、SMZ和TMP的污染程度较低, TC、CIP和OFL是造成沉积物污染的主要污染物。总体上, 氟喹诺酮类、四环素类和抗菌增效剂秋季时的含量均值比夏季时高。两季沉积物中4类抗生素含量均值的高低顺序为四环素类>氟喹诺酮类>磺胺类>抗菌增效剂。这一结果与地表水抗生素含量中相近, 说明沉积物中抗生素的来源与地表水中有很大的相关性, 其污染来源可能相同。
3.3 植物中抗生素的分布及富集特征
3.3.1 植物中抗生素的分布特征 根据地表水和沉积物中抗生素的含量特征, 本研究所选湿地植物为浮水植物水葫芦, 因其各部位与地表水、沉积物两种介质接触面广而复杂。选择样点1、5和7处植物根、茎和叶检测8种抗生素, 并进行含量特征分析。夏季植物根部8种抗生素中除TC的检出率为66.67%外, 其余7种的检出率均为100%; 茎部中, 除OFL和TC的检出率为66.67%外, 其余6种的检出率均为100%; 叶部中, 除TC的检出率为33.33%外, 其余7种的检出率均为100%。秋季根部中除TC的检出率为33.33%, 其余7种的检出率均为100%; 茎和叶部, 除TC的检出率为66.67%外, 其余7种的检出率均为100%。对夏、秋两季植物中抗生素含量数据取对数函数绘制箱线图(图4)。 植物(水葫芦)体内抗生素含量均值的高低顺序为TMP>OFL>TC>SMR>CIP>SDZ>SMX>SMZ。而夏季根部的OFL、CIP、TC和SDZ含量均值高于秋季根部的, 其余4种正相反; 夏季茎部的CIP、SDZ、SMX、SMZ和TMP含量均值高于秋季茎部的, 其余3种正相反; 夏季叶部的OFL、CIP、TC、SDZ、SMX和TMP含量均值高于秋季叶部的, 其余2种正相反。而在植物各部位的含量均值可知OFL、CIP、TC的含量较高, 这与地表水和沉积物中OFL、CIP、TC含量较高的情况相一致。但在植物各个部位中TMP的含量均值较高, 这与地表水和沉积物中TMP的含量均值较低的情况相反, 这可能是植物对TMP具有超强富集能力导致的。水葫芦在会仙湿地中广泛且大量存在, 地表水和沉积物中的TMP被大量的水葫芦吸收和吸附, 导致水体和沉积物中的TMP含量降低, 使TMP在水体和沉积物中表现出高检出率和低含量的情况。近年来, 湿地内鱼塘呈现快速增长的趋势, 对氟喹诺酮类和四环素类抗生素的使用量不断加大, 而湿地是鱼塘的主要给水源, 同时也是主要受纳水体, 大量排入的养殖废水致使OFL和TC含量也较高。湿地地形为四周高中间低, 湿地水体不像近海鱼塘、虾塘更容易扩散, 这与于菲等[26]的研究结果相异。

图4 夏、秋季植物中抗生素含量对数分布图Fig.4 Logarithmic distribution of antibacterial contents in summer and autumn plants
两季植物(水葫芦)体内4类抗生素含量均值的高低顺序为抗菌增效剂>氟喹诺酮类>磺胺类>四环素类。各部位中四类抗生素的均值排序分别为: 抗菌增效剂>氟喹诺酮类>磺胺类>四环素类(根部), 四环素类>磺胺类>抗菌增效剂>氟喹诺酮类(茎部), 磺胺类>四环素类>氟喹诺酮类>抗菌增效剂(叶部)。但四环素类抗生素含量在夏季的叶部和秋季的茎部远远高于其他部位, 时空变异程度较大。抗菌增效剂和氟喹诺酮类抗生素含量远远高于磺胺类和四环素类, 表明水葫芦对抗菌增效剂和氟喹诺酮类抗生素有较强的吸附能力, 而地表水和沉积物中抗菌增效剂含量较低, 在水葫芦中检测出的含量均值却明显高于氟喹诺酮类, 说明水葫芦对抗菌增效剂的吸附能力更强。地表水和沉积物中的抗生素通过与其直接接触的水葫芦的根部进入植株, 植物的茎被认为是抗生素的传导通道[24], 叶部的抗生素主要来源于水葫芦根部吸收后的向上运输。水葫芦可能向上转运的能力有限, 导致高浓度的抗生素主要在根部累积[27], 茎部和叶部的抗生素含量相对较低。
3.3.2 植物中抗生素的富集特征 由于会仙河流湿地水深较浅, 样品采集时主要选择没于地表水下并连带有沉积物的植株(水葫芦), 故通过植物体内抗生素含量与其周围地表水、沉积物中抗生素含量的比值, 即植物富集系数(BAF)来评价其富集情况的差异, 地表水和沉积物的BAF如图5所示。

图5 夏、秋季植物对地表水(a)和沉积物(b)抗生素富集系数的统计值Fig.5 Statistical values of antibiotic enrichment factors in summer and autumn plants compared with surface water(a) and sediment(b)
夏、秋季地表水中植物对各类抗生素的富集系数相比, 植物各部位的富集系数在不同的季节对不同的抗生素的富集能力不同。这可能与植物所处的环境、温度和水质有关。但总体上看, 除了SMX和SMR外, 植物对水体中大部分抗生素都表现出较强的富集能力, 其中对抗菌增效剂的富集能力最强。夏、秋季沉积物中植物对抗生素富集系数除了秋季的根和叶以外, 所有的富集系数均大于1, 表明植物对沉积物中的各类抗生素都有较强的富集能力, 其中对抗菌增效剂的富集能力也明显高于对其他抗生素类, 这与前文得出的植物对抗菌增效剂有超强的吸附能力结果相一致。此外, 相较于对地表水中抗生素的富集能力, 植物对沉积物中抗生素的富集能力则更高。
植物茎部和叶部对四环素类以及磺胺类抗生素的富集能力存在季节性差异: 夏季植物叶部对四环素类的富集能力最强, 在秋季时则是茎部的富集能力最强; 夏季植物对磺胺类中不同抗生素的富集能力各有差异; 不论夏季还是秋季, 植物根部对氟喹诺酮类和抗菌增效剂抗生素的富集能力都明显强于茎部和叶部。这表明植物不同部位对不同抗生素类的吸附能力存在一定的差异。对比各个部位对不同抗生素的吸附能力, 发现植物根部对各种抗生素的富集能力都较强, 这可能与植物生活在水环境中, 根部是主要和水体以及沉积物长期直接接触的部位, 植物的根部先吸收大量的抗生素并大量累积有一定关联。而植物对同种抗生素富集能力的差异是由于不同采样点的植物对抗生素富集能力存在差异。不同环境温度、pH和营养状况都会对植物吸收、富集抗生素产生影响, 造成植物富集抗生素差异, 这与韩娟等[28]的研究结果相一致。
3.4 地表水抗生素生态风险评价
使用风险熵值法对地表水中抗生素的生态分析进行评价, 8种抗生素所对应最敏感物种的毒理数据如表3所示。
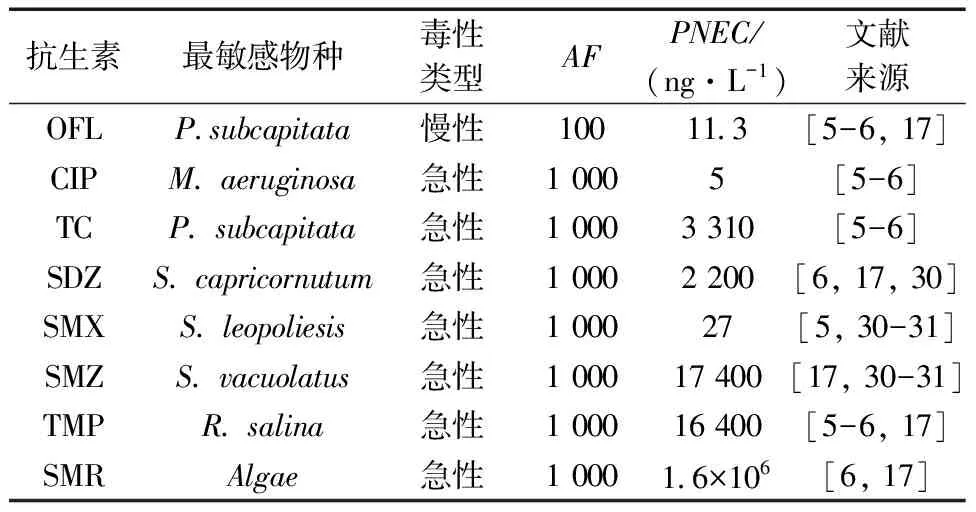
表3 抗生素对应敏感物种的毒理数据Table 3 Aquatic toxicity data antibacterial to the mostsensitive aquatic species
根据Hernando等[29]的研究将风险熵值分为3个等级:RQ<0.1为低风险, 0.1≤RQ<1为中等风险,RQ≥1为高风险, 本研究地表水中抗生素的风险熵值如表4所示。

表4 夏、秋季地表水中抗生素毒性风险评价Table 4 Evaluation of ttoxicity risk antibacterial forsummer and autumn surface water
两季地表水均为高风险等级, 氟喹诺酮类中的OFL和CIP均为高风险等级, 表明它们对湿地构成了较为严重的威胁; 夏季时, 四环素类中TC, 磺胺类中SDZ、SMX、SMR和SMZ, 以及抗菌增效剂中TMP均为低风险等级, 表明这几种抗生素对湿地生态系统无潜在生态风险。秋季时TC和SMX为中等风险等级, 表明它们对湿地存在一定的威胁; SDZ、SMR、SMZ和TMP为低风险等级, 表明这几种抗生素对湿地生态系统无潜在生态风险。对比8种抗生素的含量和风险等级, 发现SMX在水体的浓度都偏低, 但生态风险评价中仍具有较大的风险程度, 这表明SMX在浓度较低的情况下, 仍会对生态环境造成较大的危害, 需要给予一定的关注。而OFL和CIP在含量均值低于TC的情况下, 生态风险评价却高于TC, 表明OFL和CIP对生态环境的危害较大, 需要给予足够的重视。
研究区地表水存在生态风险的抗生素主要集中在氟喹诺酮类, 其次是四环素类和磺胺类中的SMX。因此, 研究区地表水中抗生素整体存在一定的生态风险, 针对这一现象应减少氟喹诺酮类抗生素的使用, 并对存在潜在风险的四环素类和磺胺类的SMX加以防范, 避免滥用现象, 从而降低生态风险。
4 结 论
(1)会仙湿地地表水和沉积物中检测出的4类抗生素中, 夏、秋两季含量均值依次为四环素类>氟喹诺酮类>磺胺类>抗菌增效剂。地表水和沉积物中抗生素含量变化趋势相似, 其污染来源可能相同, 皆为养殖废水。
(2)植物中抗生素含量均值依次为抗菌增效剂>氟喹诺酮类>磺胺类>四环素类。植物富集法分析结果表明: 植物在不同季节对不同的抗生素的富集能力存在一定差异, 但总体上对各类抗生素都表现出较强的富集能力。在植物的各个部位中, 根部对抗生素的富集能力最强。
(3)地表水抗生素的生态风险评估结果显示, 氟喹诺酮类中的OFL和CIP均为高风险等级, 四环素类和磺胺类中的SMX在秋季时处于中等风险, 其他抗生素处于低风险。因此, 会仙湿地地表水中抗生素整体存在一定的生态风险, 需要引起足够的重视, 并采取相应的防范措施。
