γ-分泌酶抑制剂通过Notch信号通路抑制人骨肉瘤细胞的迁移
2021-06-05李珂李京贺西京王爽郝丹丹
李珂 李京 贺西京 王爽 郝丹丹
骨肉瘤是一种最常见的恶性骨肿瘤,在儿童和青少年人群发病率最高。转移是骨肉瘤预后不良的关键因素之一,最常见的转移部位为肺,约有15%~25%的骨肉瘤病人在确诊时即发现肺转移[1_3]。骨肉瘤目前的治疗方式为保肢手术联合辅助化疗,然而转移病人的5年生存率仍然不足20%[4_5]。有文献报道,Notch信号通路在包括骨肉瘤在内的多种恶性肿瘤中均有异常表达,增加肿瘤的迁移侵袭能力[6_8]。而DAPT是一种γ-分泌酶抑制剂,能够在Notch通路的活化过程中起到阻断作用[9]。本文通过体外培养人骨肉瘤细胞系MG63和143B以及构建体内肺转移瘤模型,并用DAPT进行处理干预,来探究DAPT能否通过阻断Notch通路而抑制骨肉瘤细胞的迁移及体内侵袭能力,从而为骨肉瘤的临床抗转移治疗提供研究思路。
材料与方法
一、细胞株和主要试剂耗材
人骨肉瘤细胞系MG63和143B(中国科学院上海细胞研究所,中国);DMEM高糖培养基、胎牛血清、青霉素&链霉素(Gibco公司,美国);PBS缓冲液、胰蛋白酶(Hyclone公司,美国);DAPT、二甲基亚砜(DMSO)、4%多聚甲醛(Sigma公司,美国);Jagged1活性肽(序列:CDYYYGFGCNKFCRPR,10μM,Gen_Script);Transwell小室(Corning Costar公司,美国);鼠抗人Notch1(免疫荧光1∶250,Abcam公司,英国);羊抗鼠二抗(免疫荧光1∶500,Abcam公司,英国);DAPI(1∶1 000,Abcam公司,英国)。
二、实验方法
(一)细胞培养
143B和MG63细胞系培养于含10%胎牛血清和1%青链霉素的DMEM培养基中,置于37℃、5%CO2的细胞培养箱,每两天换液一次,将细胞培养至对数生长期,用胰蛋白酶消化收集用于后续实验。
(二)DAPT处理
将DAPT用DMSO溶解配成50 mM的母液,分装后储存于-80℃冰箱中。使用时取出溶解,用DMEM培养基稀释到实验所需浓度。
(三)免疫荧光染色
将细胞接种于细胞爬片上,待细胞融合度达到90%时,取出爬片,用PBS浸洗3次,每次3 min。用4%多聚甲醛固定爬片15 min,用PBS浸洗3次,每次3 min。用吸水纸吸干爬片上的PBS,滴加山羊血清,室温封闭30 min。在每张爬片上滴加稀释好的一抗并放入湿盒中,4℃孵育过夜。第二天取出爬片,用PBS浸洗3次,每次3 min,用吸水纸吸干后滴加稀释好的二抗,置于湿盒中,室温避光孵育1 h。用PBS浸洗3次,每次3 min,然后滴加稀释好的DAPI,室温避光孵育5 min后,用PBS浸洗3次,每次3 min。用吸水纸吸取残余的PBS后,用含抗荧光猝灭剂的封片液封片,然后在荧光显微镜下观察采集图像。
(四)标本来源
西安交通大学第二附属医院骨二科,病人1,男,16岁,诊断为左侧肱骨近端骨肉瘤;病人2,男,12岁,诊断为右侧股骨远端骨肉瘤。病人3,女,57岁,诊断为左侧股骨近端骨肉瘤。以上病人均发生肺部转移。
(五)免疫组织化学染色
取肿瘤组织用4%多聚甲醛固定48 h,然后进行石蜡包埋。将石蜡组织连续切片后进行抗原修复,擦干周围水分后,加入一抗置于4℃冰箱孵育过夜。复温加入二抗后于37℃孵育20 min,然后用PBS冲洗。擦净周围水分后DAB显色、苏木精复染、分化、脱水、透明,封片,最后在光学显微镜下进行观察采集图像。
(六)划痕试验
取处于对数生长期的143B和MG63细胞以5×105个/孔接种于24孔板中,每隔一天换液一次,显微镜下观察细胞状态,待细胞融合度达到90%时,用200μL的无菌枪头划痕,注意用力均匀,弃去培养液,用PBS浸洗后更换含有1%胎牛血清的DMEM培养液。将0.2μL的DMSO(对照组)、10μM的DAPT(DAPT组)以及10μM的Jagged1活性肽(Jagged1组)加入至各组,于显微镜下观察划痕情况,拍照。将24孔板置于37℃、5%CO2的细胞培养箱中培养,24 h后取出于显微镜下观察各组划痕愈合情况,拍照。
(七)Transwell迁移试验
取处于对数生长期的143B和MG63细胞,用无血清的DMEM培养基重悬计数,取50μL 5×106/mL的MG63和143B细胞接种于Transwell小室的上室,下室分别加入30μL含等体积DMSO(对照组)、10μM的DAPT(DAPT组)以及10μM的Jagged1活性肽(Jagged1组)的10%血清培养液。常规孵育8 h后,用棉签轻轻擦去小室膜上表面的细胞,用4%的多聚甲醛固定小室膜下表面迁移的细胞30 min,并用结晶紫染液染色15 min,纯水洗净。在显微镜下随机选取8个视野,观察迁移细胞的数量,每组实验均独立重复3次。
(八)肺转移瘤模型的构建
在西安交通大学医学部实验动物中心购买6只4周龄大BABL/C雄性裸鼠,参考文献[10_11]方法建立小鼠骨肉瘤异种肺转移瘤模型。将裸鼠随机分为两组,对照组和DAPT组,每组3只。从尾静脉向6只裸鼠注射100μL的MG63细胞悬液,浓度为1×107个/mL。随后每隔一天对裸鼠腹腔注射一次DAPT(DAPT组,10 mg/kg,用5%DMSO稀释)或等体积的5%的DMSO(对照组,用PBS稀释),在MG63细胞注射四周后对裸鼠进行处死,观察肺转移瘤大小,并将标本切片进行HE染色。
(九)肿瘤组织染色
将裸鼠肺部转移瘤组织切片进行染色,首先使用二甲苯脱蜡2次,每次5 min,用无水乙醇浸洗2次,每次5 min。然后用95%的乙醇和80%的乙醇各洗10 min,分别用自来水和纯水各清洗2 min,然后用苏木素染色4 min后用自来水清洗2 min。用1%的盐酸酒精分化20 s,马上用自来水清洗2 min,用1%稀氨水返蓝30 s后,用自来水清洗2 min。最后用伊红染色2 min,再用80%的乙醇和95%的乙醇各脱水10 s,无水乙醇脱水5 min,用二甲苯透明20 min后封片,置于显微镜下观察采集图像。
三、统计学分析
采用SPSS 22.0(IBM公司,美国)进行统计学分析,计量资料用均数±标准差(±s)表示,各组间细胞迁移数量的比较采用独立样本t检验。以P<0.05为差异有统计学意义。
结 果
一、Notch1在骨肉瘤细胞及临床标本中高表达
从图1 a~f可以看到Notch1在MG63细胞及143B细胞中均高表达,人骨肉瘤体内肺转移临床标本的免疫组织化学染色结果显示肺转移肿瘤标本中同样高表达Notch1(图1 g、h),说明Notch1无论在人骨肉瘤MG63和143B细胞系还是在肺转移瘤中都被过度表达。
二、DAPT抑制骨肉瘤细胞的迁移
如图2所示,与对照组相比,DAPT组细胞的迁移愈合距离明显短于对照组和Jagged1组,而Jag_ged1组细胞的迁移愈合距离最长,说明DAPT能够抑制两种骨肉瘤细胞的迁移,而Jagged1通过促进Notch通路的活化增强两种骨肉瘤细胞的迁移能力。Transwell迁移试验结果如图3所示,DAPT组穿膜细胞明显少于对照组和Jagged1组,而Jagged1组的穿膜细胞最多,同样说明了DAPT对于143B细胞和MG63细胞的迁移有抑制作用。
三、DAPT在体内抑制骨肉瘤的肺转移
肺部是骨肉瘤病人最常见的转移部位,为了验证DAPT对体内骨肉瘤肺转移的影响,我们用MG63细胞进行了裸鼠成瘤试验,成功构建了裸鼠的肺转移瘤模型,并经腹腔注射DAPT探究其对骨肉瘤肺转移的影响。如图4 a所示,对照组的肺部肿瘤结节明显大于DAPT组,且数量更多。随后我们将肺部进行切片染色,HE染色结果显示对照组有明显的转移结节,且面积更大,而DAPT组几乎没有结节(图4 b),说明DAPT能够在体内明显抑制人骨肉瘤MG63细胞的肺转移。
讨 论
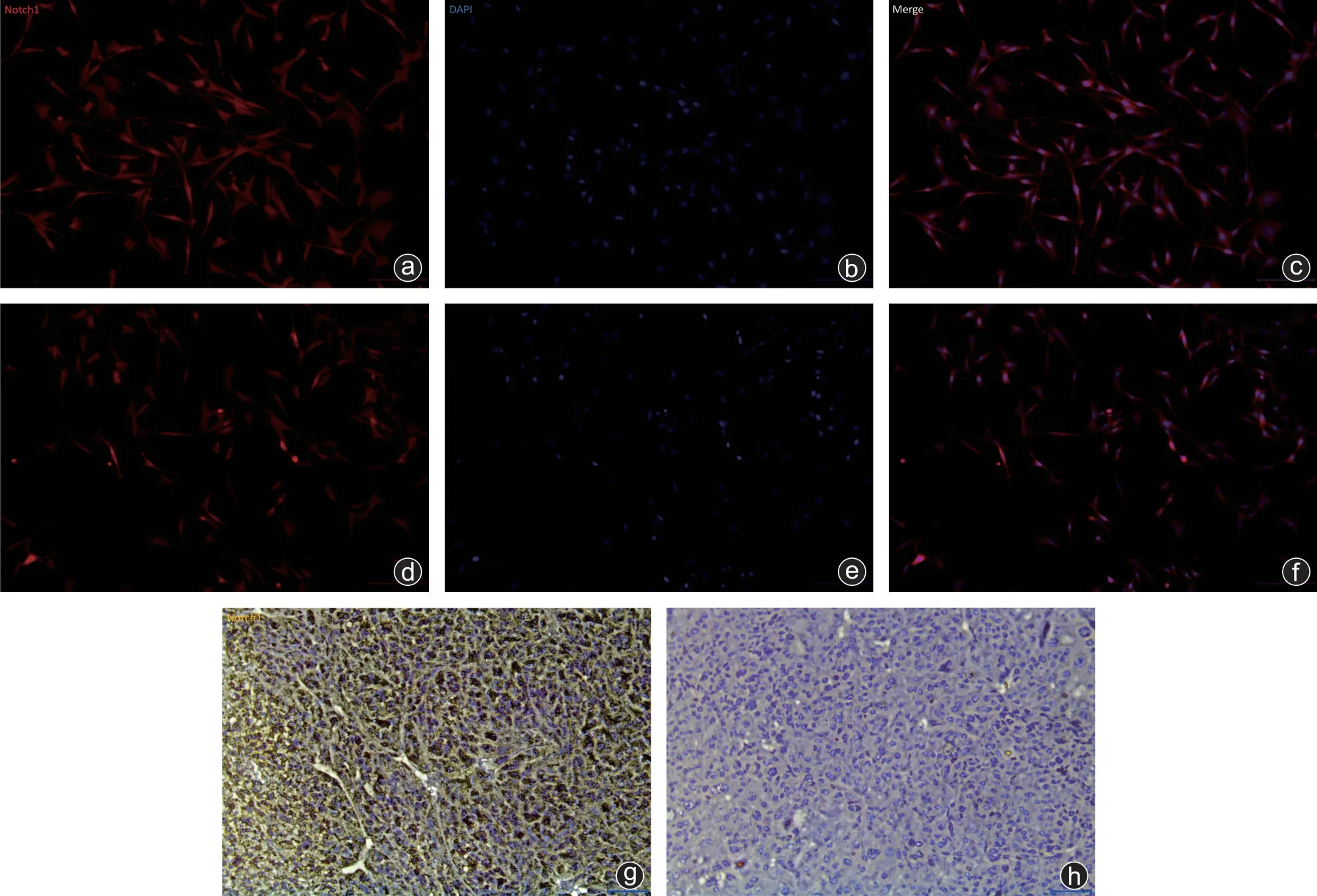
图1 细胞免疫荧光染色与临床标本免疫组化结果a~c:MG63细胞免疫荧光染色;d~f:143B细胞免疫荧光染色;红色荧光标记Notch1阳性细胞,蓝色荧光DAPI标记细胞核(×200);g、h:人体骨肉瘤标本免疫组化结果及阴性对照(×400)

图2 143B细胞和MG63细胞的划痕实验 a:143B细胞划痕愈合结果(×100);b:MG63细胞划痕愈合结果(×100)
骨肉瘤是一种致残率很高的原发性恶性骨肿瘤,尤其是肺转移后的病人生存率很低,严重威胁到人类的生命[12_13]。随着治疗手段的不断提升,骨肉瘤的治疗方法不断增多,但是由于骨肉瘤容易发生肺转移,所以总体的预后仍然很差,肺转移病人的5年生存率不足20%,因此针对骨肉瘤病人肺转移的治疗目前仍是一大研究热点[14_15]。
Notch信号通路在胚胎发育过程中起着关键作用,参与胚胎期间的血管发育和血管生成,在组织修复、伤口愈合的新生血管再生中同样发挥着重要作用[16_17]。同样,Notch通路也在癌症中扮演着重要的角色,任何干预Notch通路的微环境的改变都有可能成为机体癌变的引线。Notch通路通过整合癌细胞与肿瘤微环境之间的相互作用,进一步支持了癌细胞的“干性”,帮助其在微环境中的长期生存[18]。Notch信号传导参与癌症扩散的早期阶段,即入侵和迁移,有研究表明,Notch通路直接或间接地与细胞外基质(extracellular matrix,ECM)成分相互作用,帮助上皮癌细胞穿透ECM,这对于癌细胞的体内转移具有重要作用[19_20]。因此,本文拟通过体内、体外实验来探究Notch通路阻断剂DAPT对骨肉瘤迁移侵袭的影响,为骨肉瘤转移的临床治疗提供研究思路和科研支持。
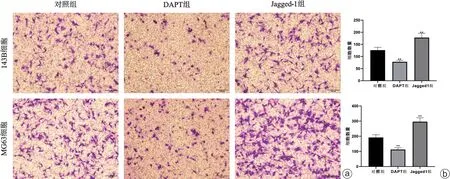
图3 143B细胞和MG63细胞的Transwell迁移试验 a:两种细胞Transwell迁移情况(结晶紫染色,×200);b:两种细胞迁移情况柱状统计图(与对照组比较,**P<0.01)
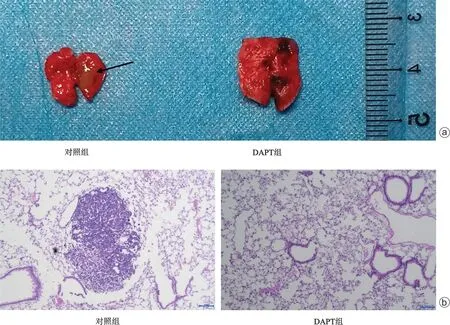
图4 裸鼠骨肉瘤的肺转移情况 a:肺部转移瘤图片;b:肺转移瘤的HE染色(×100)
本实验通过体外培养人骨肉瘤143B细胞和MG63细胞,添加DAPT与Notch通路激活剂Jag_ged1,观测其对癌细胞体外迁移能力的影响。首先我们采用免疫荧光染色和免疫组化分别检验MG63细胞、143B细胞和人骨肉瘤肺转移瘤的临床标本中Notch1的表达情况,结果显示体外培养的人骨肉瘤MG63、143B细胞系和人骨肉瘤肺转移瘤均高表达Notch1,这对后续的干预研究具有指导意义。然后我们通过划痕试验定性观察DAPT和Jagged1对人骨肉瘤143B细胞和MG63细胞迁移的影响,结果表明DAPT能够明显抑制两种细胞的划痕愈合能力,而Jagged1则能够起到明显的促进愈合作用,这与我们的预期相符。接着我们通过Transwell迁移实验进行定量验证,结果同样证明DAPT对143B细胞和MG63细胞的迁移起抑制作用。为了给临床治疗提供更加可靠的实验信息,模拟更加复杂的体内环境,我们通过构建裸鼠的骨肉瘤肺转移瘤模型来验证DAPT对于骨肉瘤的体内侵袭转移能力的影响。结果显示,DAPT能够明显减少人骨肉瘤MG63细胞肺转移瘤的数量及体积,且通过对转移瘤标本的HE染色发现,DAPT组的结节数量明显少于对照组,且结节大小也明显减小,说明DAPT能够在体内环境中抑制骨肉瘤的肺部侵袭转移能力,这对于骨肉瘤的转移治疗具有重要指导意义。
本研究结果显示,γ-分泌酶抑制剂DAPT对体外培养的人骨肉瘤143B细胞和MG63细胞有明显的迁移抑制作用,同时能够减弱体内骨肉瘤肺部侵袭转移能力。本研究为DAPT治疗骨肉瘤肺转移的临床应用提供了重要的理论基础。
