超短期胰岛素强化治疗对住院T2DM患者胰岛β细胞功能的影响*
2021-06-04杜娟王若梅陈婧雷远王琼汪睿刘燕胡红琳
杜娟,王若梅,陈婧,雷远,王琼,汪睿,刘燕,胡红琳
(1.安徽医科大学第四附属医院 内分泌与代谢病科,安徽 合肥230012;2.安徽医科大学第一附属医院 内分泌代谢科,安徽 合肥230022)
胰岛素抵抗和胰岛素分泌不足是2型糖尿病(type 2 diabetes mellitus,T2DM)发生、发展的病理和生理基础,而胰岛β细胞数量进行性减少是外源性胰岛素替代治疗的基础。近年来,众多研究证实为期数周至数月的多次胰岛素皮下注射对改善T2DM患者胰岛β细胞功能有益,甚至部分患者达到缓解。针对这一现象,细胞凋亡机制难以解释,亦有学者提出“去分化”学说[1-2],胰岛β细胞去分化可能较细胞凋亡更为重要[1]。由于体内胰岛素测定受到外源性影响因素众多、住院期间观察超短期多次胰岛素皮下注射治疗的研究少见,同时为进一步减少患者住院时间和经济费用。本研究选取C-肽(C-peptide,C-P)替代胰岛素纳入改良稳态模型评估公式[3],在5~7 d的超短期多次胰岛素皮下注射后,重新评估住院T2DM患者胰岛β细胞功能HOMA-β(C-P)的恢复情况。
1 资料与方法
1.1 一般资料
选取2018年1月—2019年12月就诊于安徽医科大学第四附属医院内分泌与代谢病科的住院T2DM患者69例。其中,男性35例,女性34例;平均年龄(51.25±11.61)岁;平均体重指数(body mass index,BMI)(24.40±3.12)kg/m2;平均糖化血红蛋 白(glycosylated hemoglobin,HbA1c)(11.25±2.07)%;病程中位数28(4.5,90.0)个月;初诊初治者32例,口服降糖药>3个月血糖不达标者37例。根据不同的HbA1c水平将HbA1c<11.0%患者作为低HbA1c组,共36例,平均HbA1c(9.73±0.84)%,病程中位数48(5.25,99.00)个月;将HbA1c≥11.0%患者者作为高HbA1c组,共33例,平均HbA1c(12.92±1.71)%,病程中位数24(2.50,84.00)个月。根据不同的BMI水平将BMI<25 kg/m2患者作为非超重组,共37例;BMI≥25 kg/m2者作为超重组,共32例。纳入标准:①T2DM诊断明确;②初诊、初治糖尿病者空腹血糖(fasting blood glucose,FBG)≥11.1 mmol/L或HbA1c≥9%、复诊血糖控制不佳(口服降糖药3个月后HbA1c≥7%)、尚未采取多次胰岛素皮下注射治疗。排除标准:①1型糖尿病、特殊类型糖尿病;②糖尿病酮症酸中毒和高血糖高渗状态;③严重心脏、肝脏、肾脏功能不全或严重基础病、应激状态及恶性高血压;④严重感染;⑤精神系统疾病。本研究经安徽医科大学第四附属医院医学伦理委员会批准,患者签署知情同意书。
1.2 方法
1.2.1 一般临床指标测定由专人测量受试者身高(cm)、体重(kg),计算BMI。隔夜禁食8 h后,采集受试者晨空腹肘静脉血5~10 ml,送检FBG、空腹C肽(FC-PIn)和HbA1c。用FC-P代替空腹胰岛素纳入改良稳态模型评估法(HOMA)公式,计算胰岛β细胞功能[HOMA-β(C-P)In]和胰岛素抵抗指标[HOMA-IR(C-P)In],HOMA-β(C-P)In=0.27×FC-P/(FPG-3.5)、HOMA-IR(C-P)In=1.5+FPG×FC-P/2800[3]。
1.2.2 多次胰岛素皮下注射参照《中国2型糖尿病防治指南(2017)》[4]中多次胰岛素皮下注射标准,FBG≥11.1 mmol/L或HbA1c≥9%的初诊、初治疗T2DM患者及口服降糖药3个月后HbA1c≥7%者,均入院启动多次胰岛素皮下注射(长效胰岛素+三餐前速效胰岛素);依据指南推荐的T2DM高血糖管理路径,适当加用二甲双胍、阿卡波糖;血糖控制标准为餐前血糖或FBG 4.4~7.8 mmol/L,餐后2 h血糖6.1~10.0 mmol/L;诊断糖尿病慢性并发症及其他合并症者均予以对症处理;有阿司匹林及他汀适应证者,排除禁忌后,尽早启动心脑血管疾病二级预防。
1.2.3 临床指标复测多次胰岛素皮下注射治疗5~7 d,复测FBG、FC-PIn,抽血前1天停用长效胰岛素,重新评估受试者HOMA-β(C-P)In和HOMAIR(C-P)In。
1.3 统计学方法
数据分析采用SPSS 26.0统计软件。计量资料以均数±标准差(±s)表示,比较用配对t检验或独立样本t检验;相关性分析用Pearson法。P<0.05为差异有统计学意义。
2 结果
2.1 多次胰岛素皮下注射前后临床指标比较
T2DM患者多次胰岛素皮下注射前后FBG、FC-PIn、HOMA-β(C-P)In和HOMA-IR(C-P)In比较,差异有统计学意义(P<0.05),FBG、FCPIn和HOMA-IR(C-P)In治疗后较注射前下降,HOMA-β(C-P)In较注射前升高。见表1。
表1 多次胰岛素皮下注射前后临床指标比较(n=69,±s)
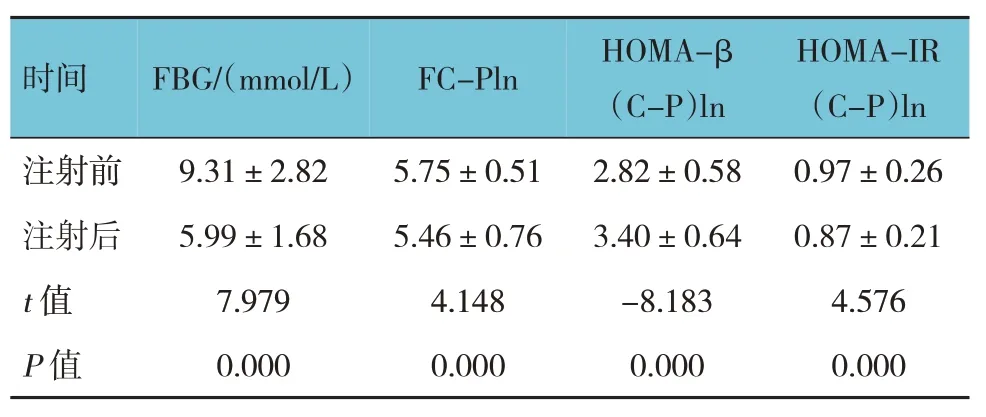
表1 多次胰岛素皮下注射前后临床指标比较(n=69,±s)
时间FBG/(mmol/L)FC-Pln HOMA-β(C-P)ln HOMA-IR(C-P)ln注射前注射后t值P值9.31±2.82 5.99±1.68 7.979 0.000 5.75±0.51 5.46±0.76 4.148 0.000 2.82±0.58 3.40±0.64-8.183 0.000 0.97±0.26 0.87±0.21 4.576 0.000
2.2 不同HbA1c组患者多次胰岛素皮下注射前后临床指标比较
不同HbA1c组患者多次胰岛素皮下注射前后FBG和HOMA-β(C-P)In的差值比较,差异有统计学意义(P<0.05),高HbA1c组较低HbA1c组高。不同HbA1c组患者多次胰岛素皮下注射前后其余指标比较,差异无统计学意义(P>0.05)。见表2。
表2 多不同HbA1c组患者多次胰岛素皮下注射前后临床指标比较(±s)
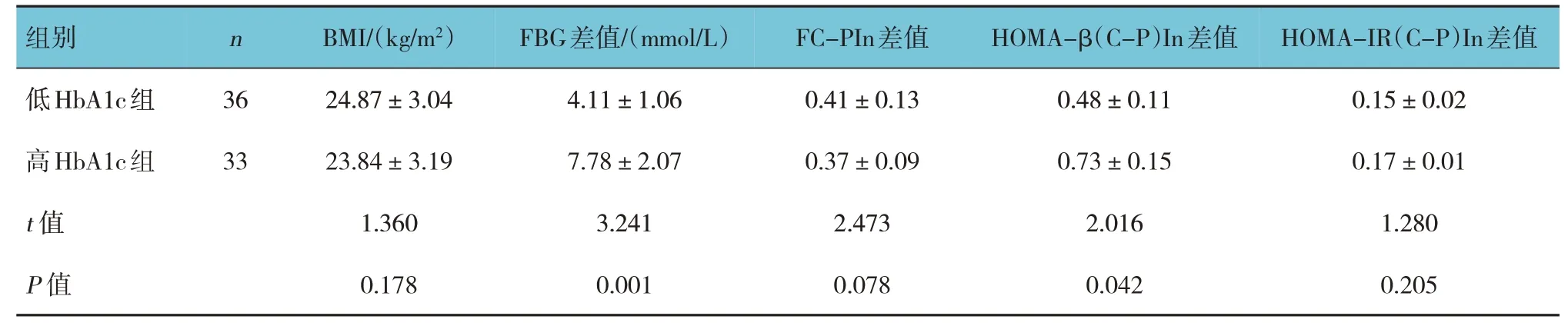
表2 多不同HbA1c组患者多次胰岛素皮下注射前后临床指标比较(±s)
组别n BMI/(kg/m2)FBG差值/(mmol/L)FC-PIn差值HOMA-β(C-P)In差值HOMA-IR(C-P)In差值低HbA1c组高HbA1c组t值P值36 33 24.87±3.04 23.84±3.19 1.360 0.178 4.11±1.06 7.78±2.07 3.241 0.001 0.41±0.13 0.37±0.09 2.473 0.078 0.48±0.11 0.73±0.15 2.016 0.042 0.15±0.02 0.17±0.01 1.280 0.205
2.3 不同BMI组患者多次胰岛素皮下注射前后临床指标比较
不同BMI组患者HbA1c比较,差异有统计学意义(P<0.05),非超重组较超重组高,不同BMI组患者多次胰岛素皮下注射前后FC-PIn和HOMA-β(C-P)In的差值比较,差异有统计学意义(P<0.05),非超重组FC-Pln差值较超重组高,HOMAβ(C-P)In差值较超重组低。不同BMI组患者多次胰岛素皮下注射前后其余指标比较,差异无统计学意义(P>0.05)。见表3。
表3 多次胰岛素皮下注射前后超重组和非超重组的临床指标比较(±s)
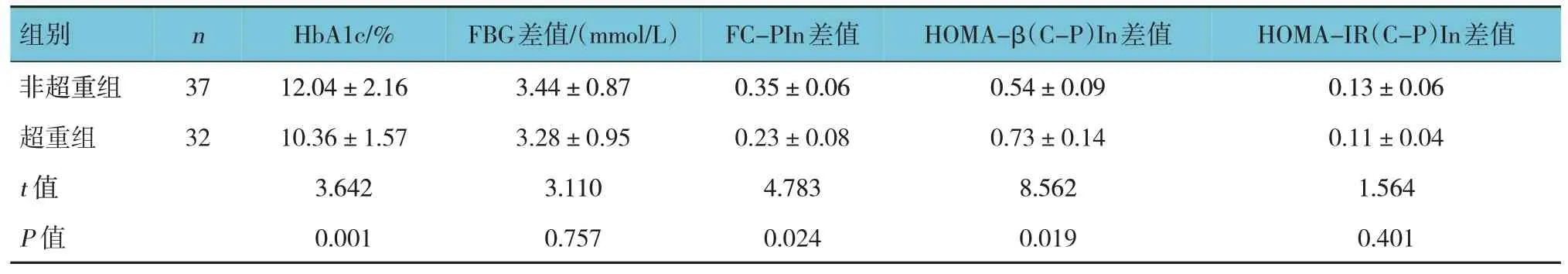
表3 多次胰岛素皮下注射前后超重组和非超重组的临床指标比较(±s)
组别n HbA1c/%FBG差值/(mmol/L)FC-PIn差值HOMA-β(C-P)In差值HOMA-IR(C-P)In差值非超重组超重组t值P值37 32 12.04±2.16 10.36±1.57 3.642 0.001 3.44±0.87 3.28±0.95 3.110 0.757 0.35±0.06 0.23±0.08 4.783 0.024 0.54±0.09 0.73±0.14 8.562 0.019 0.13±0.06 0.11±0.04 1.564 0.401
2.4 相关性分析
Pearson相关性分析显示,HOMA-β(C-P)In差值水平与多次胰岛素皮下注射前FBG水平、HOMA-IR(C-P)In水平、HbA1c水平及多次胰岛素皮下注射后HOMA-IR(C-P)In水平、HOMA-β(C-P)In水平呈正相关(r=0.570、0.331、0.237、0.307和0.560,P=0.000、0.005、0.049、0.010和0.000)。HOMA-β(C-P)ln差值水平与多次胰岛素皮下注射后FBG、多次胰岛素皮下注射前HOMA-β(C-P)In水平呈负相关(r=-0.495和-0.400,P=0.000和0.001)。
3 讨论
T2DM是遗传和后天环境等多重因素共同导致的代谢性疾病,而胰岛β细胞功能进行性衰竭是T2DM进展的关键环节,也是外源性胰岛素替代进行性增加的病理基础[2]。有研究显示早期T2DM胰岛β细胞损伤是可逆的,越早改善血糖,越能保护胰岛β细胞功能并延缓其衰竭[5]。不仅如此,初诊T2DM患者起始胰岛素治疗对改善FBG和胰岛β细胞功能显著优于口服降糖药物治疗[6]。尽管早期多次胰岛素皮下注射的具体机理尚不明确,但对于胰岛β细胞功能的保护及改善作用已达成共识。
本研究发现,1周左右的超短期多次胰岛素皮下注射仍对住院T2DM患者胰岛素β细胞功能、FBG和胰岛素抵抗有极大改善。已经凋亡的胰岛β细胞不能再生,但多次胰岛素皮下注射后胰岛HOMA-β显著改善的原因到底是什么呢?2012年,TALCHAI等[7]首次通过胰岛β细胞FoxO1基因敲除的糖尿病小鼠模型,发现高糖作用下胰岛β细胞出现增殖、凋亡、脱颗粒丧失内分泌功能、转分化为α细胞和去分化为祖细胞或前体细胞这五大去路。去分化的内分泌前体细胞,可表达Nanog、LMyc、Neurogenin3、Oct4等基因,但失去分泌胰岛素的功能和细胞表型,最后出现功能性胰岛β细胞数量下降和血糖进行性升高。其在后续试验中亦首次证实,人体中也存在β细胞去分化现象,胰岛β细胞去分化程度越高,胰岛素分泌下降越明显,且去分化评分与糖尿病病程、年龄、BMI等均无相关性[8]。故有学者推断:高糖毒性下部分胰岛β细胞出现去分化,尽早启用多次胰岛素皮下注射可以“唤醒”或“诱导”去分化的胰岛β细胞实现“逆转”,即再分化为具有合成和内分泌功能的胰岛β细胞,实现血糖缓解,为T2DM患者的治疗提供思路[2]。而这一设想也在动物模型中得到验证,即多次胰岛素皮下注射解除高糖毒性后,KATPGOF糖尿病小鼠标注的去分化β细胞数量显著下降,而胰岛素分泌功能得到改善[9]。细胞去分化可能是细胞应激状态下逃避死亡的一种适应性机制,这种机制同样存在于癌细胞和植物细胞中,而高糖毒性正是T2DM患者的应激环境[10]。故笔者推断,住院T2DM患者超短期多次胰岛素皮下注射治疗后,胰岛β细胞功能改善可能与胰岛β细胞去分化有紧密联系,但具体机制仍待进一步研究。
超短期多次胰岛素皮下注射治疗难以对HbA1c和BMI造成较大影响,故纳入分组研究。由于BMI存在差异,胰岛β细胞受损和胰岛素抵抗不均一;BMI越小,β细胞受损越严重;多次胰岛素皮下注射对于肥胖患者胰岛β细胞改善更显著[11]。本研究中,超重组差值FC-Pln、差值HOMA-β(C-P)In差值水平均显著高于非超重组,与上述试验结果存在一致性。高HbA1c组差值FBG和差值HOMAβ(C-P)In差值水平高于低HbA1c组,这提示多次胰岛素皮下注射后HOMA-β(C-P)In水平恢复和和血糖改善相关。王双双等[12]报道称患者以血糖控制不佳、血糖波动大和慢性并发症构成入院主要原因,多次胰岛素皮下注射后整体疗效显著。但HOMA-β(C-P)In差值水平和众多临床指标均有相关性,提示人体内胰岛β功能的恢复是多种临床因素和病理机制共同作用的结果。
综上所述,超短期多次胰岛素皮下注射治疗显著改善住院T2DM胰岛β细胞功能,且胰岛β细胞恢复和多种临床指标均有相关性。但本研究的不足是:有待大样本、长周期的研究进一步验证。笔者也会进一步观察随访,超短期多次胰岛素皮下注射患者未来血糖缓解程度和达标率。无论细胞凋亡机制还是去分化学说,T2DM患者在不同阶段的不同胰岛素治疗方案中,均可带来不同程度的胰岛β功能改善。
