黄芩苷对高糖诱导的人晶状体上皮细胞凋亡和氧化应激的影响及其可能机制△
2021-06-02杨涛柴盼盼何启红潘家钰彭正虹康刚劲
杨涛 柴盼盼 何启红 潘家钰 彭正虹 康刚劲
在发达国家和部分发展中国家,白内障是糖尿病患者失明的主要原因之一[1]。糖尿病可能引起一系列并发症,包括微循环异常和代谢紊乱等,在眼部可表现为白内障,其原理在于高糖可能引起晶状体代谢紊乱,从而诱发糖尿病性白内障[2]。黄芩苷是从植物灯盏花中提取的黄酮类化合物,在中国广泛用于治疗心脑血管疾病[3]。现代医学对黄芩苷的系统研究表明,黄芩苷具有抗炎、抗氧化、抗凋亡、抗缺血等多种药理作用,同时对糖尿病、肿瘤、神经变性、青光眼等多种疾病具有治疗作用。氧化还原敏感信号系统Kelch样ECH相关蛋白1 (Keap1)-核因子红细胞2相关因子2 (Nrf2)-抗氧化反应元件(ARE)在应激、炎症、致癌和促凋亡条件下对维持细胞内环境稳定起着关键作用[4-6]。本研究以人晶状体上皮细胞系HLE-B3为研究对象,观察黄芩苷对高糖诱导的人晶状体上皮细胞凋亡和氧化应激是否有作用,并探讨其可能作用机制。
1 材料与方法
1.1 材料人晶状体上皮细胞系HLE-B3(ATCC公司,美国),黄芩苷(成都曼斯特生物科技有限公司),DMEM培养基、胎牛血清(杭州四季青生物工程材料有限公司),CCK-8溶液(同仁化学研究所,日本),FITC-PI凋亡检测试剂盒(BD公司,德国),超氧化物歧化酶(SOD)、丙二醛(MDA)、谷胱甘肽过氧化物酶(GSH-Px)检测试剂盒(南京建成生物科技有限公司),Bcl-2、Keap1、Nrf2、HO-1、NQO1抗体(Abcam公司,英国),Bax抗体(Proteintech中国公司),GAPDH抗体(上海碧云天生物技术有限公司,中国)。
1.2 方法
1.2.1 细胞培养HLE-B3细胞培养于低糖(含5.6 mmol·L-1葡萄糖)DMEM培养基,置于37 ℃、含体积分数5% CO2的培养箱内培养并及时传代。
1.2.2 CCK-8法筛选黄芩苷最佳作用浓度将处于对数生长期的HLE-B3细胞以1×104个·mL-1接种于96孔板中,同步化后,分别加入浓度为0 μmol·L-1、5 μmol·L-1、10 μmol·L-1、25 μmol·L-1、50 μmol·L-1、100 μmol·L-1的黄芩苷处理48 h,每浓度组设5个复孔。处理完成后,每孔加入10 μL CCK-8溶液,37 ℃孵育2 h后于450 nm波长处测定光密度(D)值,计算各浓度黄芩苷处理后的细胞活力,根据细胞活力结果筛选出黄芩苷的最佳作用浓度用于后续实验。
1.2.3 实验分组取对数生长期的HLE-B3细胞随机分为3组,其中,正常组:用低糖DMEM培养基正常培养细胞48 h;高糖组:先用低糖DMEM培养基培养48 h,再用含200 mmol·L-1葡萄糖的DMEM培养基培养48 h;黄芩苷组:用含5 μmol·L-1黄芩苷的低糖DMEM培养基培养细胞48 h,再用含200 mmol·L-1葡萄糖的DMEM培养基培养 48 h。
1.2.4 CCK-8法检测各组细胞活力CCK-8法检测正常组、高糖组、黄芩苷组细胞活力,具体操作步骤同1.2.1。实验重复3次,取平均值记录。
1.2.5 流式细胞术检测各组细胞凋亡率分组处理后收集各组HLE-B3细胞,PBS清洗3次,胰蛋白酶消化,用含血清的DMEM培养基终止消化,吹打混匀后离心,弃上清,PBS重悬2次,重悬后分别离心,弃上清液,然后每组加入100 μL 1×binding buffer混匀,避光加入5 μL FITC染色液及5 μL碘化丙啶(PI)染色液再次混匀,避光反应15 min,1 h内使用流式细胞仪(Thermo公司,美国)检测,记录各组细胞凋亡率。
1.2.6 RT-PCR检测各组HLE-B3细胞中Keap1、Nrf2、NQO1、HO-1、Bax、Bcl-2的mRNA表达分组处理后收集各组HLE-B3细胞,用Trizol法提取细胞中总RNA,反转录,以GAPDH为内参进行扩增,引物由上海生工生物工程股份有限公司合成。Keap1的上游引物为5’- CCAATGCTGACACGAAGGAT -3’,下游引物为5’- ATACAGTTGTGCAGGACGCAG -3’,引物长度为194 bp;Nrf2的上游引物为5’- CAGTCAGCGACGGAAAGAGTA -3’,下游引物为5’- CTGGGAGTAGTTGGCAGATCC -3’,引物长度为196 bp;HO-1的上游引物为5’-GCCAGCAACAAAGTGCAAGA-3’,下游引物为5’-TAAGGACCCATCGGAGAAGC-3’,引物长度为100 bp;NQO1的上游引物为5’-TGGTGGAGTCGGACCTCTATG-3’,下游引物为5’-CATGGCAGCGTAAGTGTAAGC-3’,引物长度为287 bp;Bax的上游引物为5’-TCTGAGCAGATCATGAAGACAGG-3’,下游引物为5’-ATCCTCTGCAGCTCCATGTTAC-3’,引物长度为191 bp;Bcl-2的上游引物为5’-AGGATTGTGGCCTTCTTTGAG-3’,下游引物为5’-AGCCAGGAGAAATCAAACAGAG-3’,引物长度为209 bp;GAPDH的上游引物为5’-CATCATCCCTGCCTCTACTGG-3’,下游引物为5’-GTGGGTGTCGCTGTTGAAGTC-3’,引物长度为259 bp。采用2-ΔΔCt计算Keap1、Nrf2、NQO1、HO-1、Bax、Bcl-2 mRNA的相对表达量。
1.2.7 Western blot检测各组HLE-B3细胞中Keap1、Nrf2、NQO1、HO-1、Bax、Bcl-2的蛋白表达分组处理后收集各组HLE-B3细胞,RIPA蛋白裂解液(碧云天,中国)在冰上提取各组细胞蛋白,BCA法测蛋白浓度,SDS-PAGE凝胶电泳、转膜,50 g·L-1脱脂奶粉封闭2 h,分别加入Keap1(稀释比例11000)、Nrf2(稀释比例15000)、NQO1(稀释比例110 000)、HO-1(稀释比例12000)、Bax(稀释比例11000)、Bcl-2(稀释比例 11000)一抗4 ℃过夜,HRP标记的羊抗兔二抗(稀释比例13000)孵育1 h,化学发光法显影。以GAPDH为内参分析各组细胞中各蛋白灰度值比值。
1.2.8 酶标法检测各组细胞中SOD活力和MDA、GSH-Px含量实验步骤严格按照试剂盒说明书进行。分组处理后收集各组HLE-B3细胞,弃上清后PBS清洗3次,胰蛋白酶消化,用含血清的DMEM培养基终止消化,吹打混匀后以1000 r·min-1的速度离心10 min,弃上清,PBS重悬1次,离心,弃上清,在细胞沉淀中加入0.3 mL生理盐水,调整细胞密度为1×106个·mL-1,超声裂解,酶标法检测各组细胞中SOD活力和MDA、GSH-Px含量。
1.3 统计学分析采用SPSS 22.0进行统计学分析,计量资料均用均数±标准差表示, 多组样本均数间比较采用方差分析,组间两两比较采用t检验。检验水准:α=0.05。
2 结果
2.1 CCK-8法筛选黄芩苷最佳作用浓度结果CCK-8法检测结果显示, 0 μmol·L-1、5 μmol·L-1、10 μmol·L-1、25 μmol·L-1、50 μmol·L-1、100 μmol·L-1的黄芩苷处理HLE-B3细胞48 h后,细胞活力分别为(100.00±0.00)%、(126.86±0.04)%、(95.48±0.05)%、(91.12±0.05)%、(60.04±0.13)%、(42.36±0.0)%,组间差异有统计学意义(F=38.52,P=0.000)。进一步两两比较结果显示,5 μmol·L-1黄芩苷处理后HLE-B3细胞活力最强,与其他浓度黄芩苷处理后HLE-B3细胞活力相比差异均有统计学意义(均为P<0.05);50 μmol·L-1、100 μmol·L-1黄芩苷处理后HLE-B3细胞活力均明显减弱,与其他浓度黄芩苷处理后HLE-B3细胞活力相比差异均有统计学意义(均为P<0.05);0 μmol·L-1、10 μmol·L-1、25 μmol·L-1黄芩苷处理后HLE-B3细胞活力两两相比差异均无统计学意义(均为P>0.05);50 μmol·L-1与100 μmol·L-1黄芩苷处理后HLE-B3细胞活力相比差异无统计学意义(P>0.05)。可见,5 μmol·L-1黄芩苷作用48 h可显著促进HLE-B3细胞活力,随着黄芩苷浓度升高,HLE-B3细胞活力逐渐下降。因此,本研究选择5 μmol·L-1的黄芩苷进行后续实验。
2.2 CCK-8法检测各组HLE-B3细胞活力结果与正常组HLE-B3细胞活力(100.00±0.00)%相比,高糖组HLE-B3细胞活力明显降低,为(73.52±1.71)%,两组细胞活力相比差异具有统计学意义(t=15.520,P=0.000);黄芩苷组HLE-B3细胞活力为(92.36±3.61)%,较高糖组显著增加,差异具有统计学意义(t=4.719,P=0.009)。
2.3 流式细胞术检测各组HLE-B3细胞凋亡率结果流式细胞术检测结果显示,正常组、高糖组、黄芩苷组细胞凋亡率分别为(7.93±0.22)%、(57.12±2.63)%、(42.09±1.04)%,组间相比差异具有统计学意义(F=237.90,P=0.000)。两两比较结果显示,与正常组相比,高糖组、黄芩苷组细胞凋亡率均显著升高,差异均有统计学意义(t=18.680、32.250,均为P=0.000);与高糖组相比,黄芩苷组细胞凋亡率显著降低,差异具有统计学意义(t=5.328,P=0.006)(见图1)。

图1 流式细胞术检测各组HLE-B3细胞的凋亡率 A:正常组;B:高糖组;C:黄芩苷组。
2.4 RT-PCR检测各组HLE-B3细胞中Keap1、Nrf2、NQO1、HO-1、Bax、Bcl-2的mRNA表达结果正常组、高糖组、黄芩苷组间HLE-B3细胞中Keap1、Nrf2、NQO1、HO-1、Bax、Bcl-2的mRNA相对表达量差异均有统计学意义(F= 2148.00、201.10、530.40、27.93、42.97、1069.00,均为P=0.000)。两两比较结果显示,与正常组相比,高糖组Keap1、Bax的mRNA相对表达量均升高,差异均有统计学意义(t=12.050、14.040,均为P<0.01),Nrf2、NQO1、Bcl-2、HO-1的mRNA相对表达量均降低,差异均有统计学意义(t=19.050、47.790、48.390、7.063,均为P<0.01);与高糖组相比,黄芩苷组Keap1、Bax的mRNA相对表达量均降低,差异均有统计学意义(t=7.494、24.100,均为P=0.000),Nrf2、NQO1、HO-1、Bcl-2的mRNA相对表达量均升高,差异均有统计学意义(t=9.175,P=0.000;t=2.924,P=0.002;t=4.076,P=0.015;t=2.943,P=0.012)(见表1)。

表1 各组HLE-B3细胞中Bax、Bcl-2、Keap1、Nrf2、HO-1、NQO1的mRNA相对表达量
2.5 Western-blot检测各组HLE-B3细胞中Keap1、Nrf2、NQO1、HO-1、Bax、Bcl-2的蛋白表达结果正常组、高糖组、黄芩苷组间HLE-B3细胞中Keap1、Nrf2、NQO1、HO-1、Bax、Bcl-2的蛋白相对表达量差异均有统计学意义(F=8.62,P=0.017;F=38.52,P=0.000;F=2478.00,P=0.000;F=102.20,P=0.000;F=166.50,P=0.000;F=41.16,P=0.000)。两两比较结果显示,与正常组相比,高糖组Keap1、Bax的蛋白相对表达量均升高,差异均有统计学意义(t=3.800,P=0.019;t=16.950,P=0.000),Nrf2、NQO1、HO-1、Bcl-2的蛋白相对表达量均降低,差异均有统计学意义(t=20.050,P=0.000;t=55.620,P=0.000;t=15.080,P=0.000;t=8.084,P=0.001);与高糖组相比,黄芩苷组Keap1、Bax的蛋白相对表达量均降低,差异均有统计学意义(t=3.657,P=0.022;t=11.360,P=0.000),Nrf2、NQO1、HO-1、Bcl-2的蛋白相对表达量均升高,差异均有统计学意义(t=3.657,P=0.023;t=21.590,P=0.000;t=6.596,P=0.003;t=2.919,P=0.043)(见图2)。
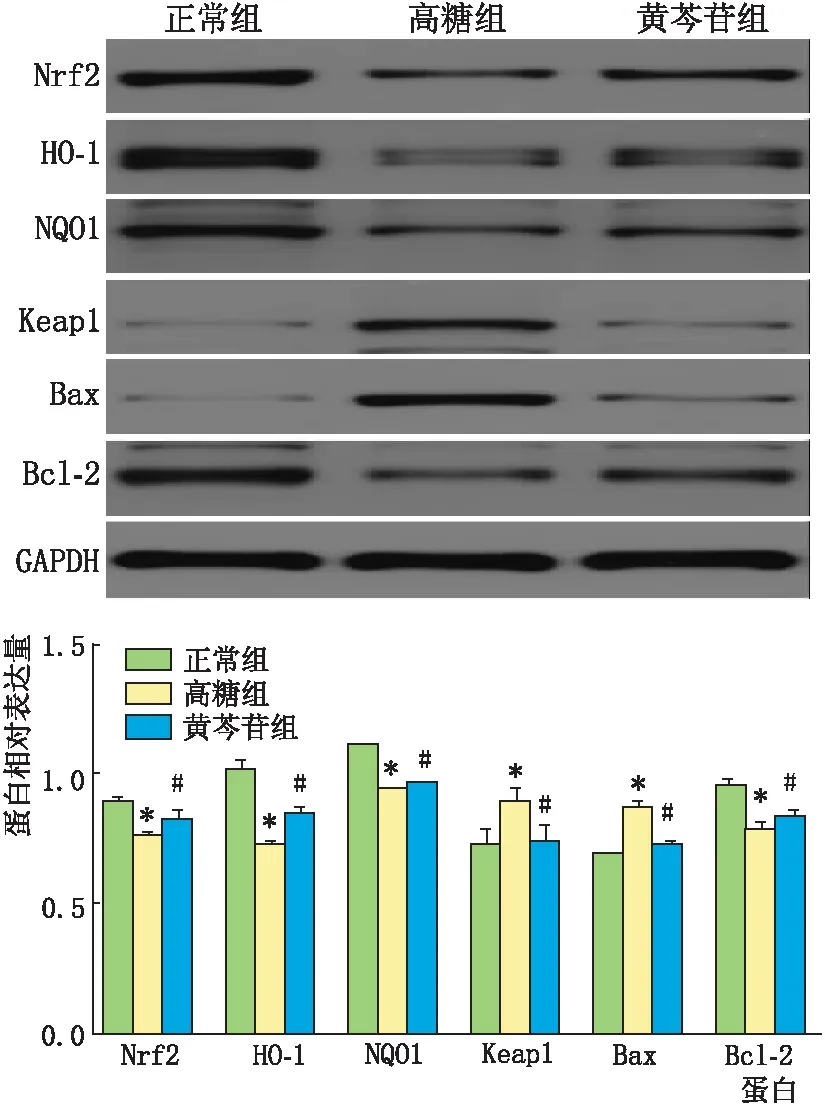
图2 Western blot检测各组HLE-B3细胞中Bax、Bcl-2、Keap1、Nrf2、HO-1、NQO1的蛋白表达情况 与正常组相比,*P<0.05;与高糖组相比,#P<0.05。
2.6 酶标法检测各组HLE-B3细胞中SOD活力和MDA、GSH-Px含量结果正常组、高糖组及黄芩苷组间HLE-B3细胞中SOD活力、GSH-Px含量、MDA含量差异均有统计学意义(均为P<0.05)。两两比较结果显示,与正常组相比,高糖组HLE-B3细胞中SOD活力、GSH-Px含量均降低,MDA含量升高,差异均有统计学意义(t=8.652、10.410、19.660,均为P<0.05);与高糖组相比,黄芩苷组HLE-B3细胞中SOD活力、GSH-Px含量均升高,MDA含量降低,差异均有统计学意义(t=3.300、7.448、14.620,均为P<0.05)(见表2)。
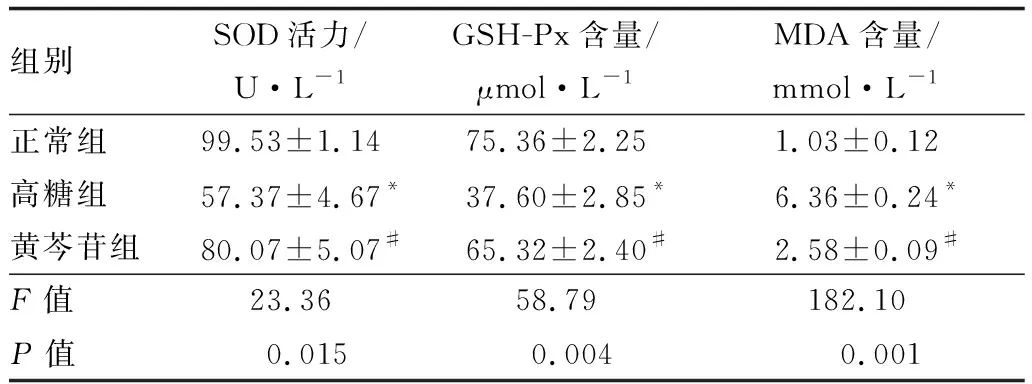
表2 各组HLE-B3细胞中SOD活力和GSH-Px、MDA含量
3 讨论
晶状体是人眼最重要的屈光介质之一,生理状态下为透明、无血管的组织,晶状体大部分的代谢活动能够保护晶状体蛋白和其他细胞成分免受氧化应激的损伤[7]。随着糖尿病的发生发展、年龄的增长、物理化学损伤、炎症等的刺激,晶状体的正常代谢活动及正常组织结构遭到破坏,逐渐由透明变为混浊,进而影响视力。糖尿病性白内障的发病机制尚未完全明确,目前认为主要有以下三种机制:非酶糖基化、氧化应激和多元醇通路[8]。现有的研究表明,白内障的发生与氧化应激、自由基损伤、晶状体上皮细胞的凋亡等有关[9-10]。氧化应激被定义为自由基和活性代谢物的产生及其消除之间的不平衡[11],这种不平衡会导致细胞损伤,从而对整个机体产生潜在的不利影响。有研究表明,人体中的氧化应激状况与血糖调节的损害相关,其也是糖尿病性白内障的主要危险因素[12]。高血糖可使氧自由基增加,破坏晶状体本身所具有的抗氧化应激机制和导致晶状体上皮细胞凋亡,从而导致白内障的发生。高糖可诱发晶状体上皮细胞凋亡与氧化应激。本研究结果显示,高糖干预后,HLE-B3细胞凋亡率明显升高,凋亡相关蛋白Bax mRNA及蛋白相对表达量升高,Bcl-2 mRNA及蛋白相对表达量降低;氧化应激相关指标SOD活力及GSH-Px含量均明显下降,MDA含量上升。
黄芩苷能抑制肝细胞的凋亡[13],减慢糖尿病肾病等并发症的发展[14],保护颅内神经细胞免受氧化应激损伤[15],是治疗炎症、白内障、糖尿病视网膜病变等的理想药物[16]。近年来,黄芩苷在各种疾病中的应用取得了很大的进展,黄芩苷已被应用于阿尔茨海默病、幽门螺杆菌感染、糖尿病的血管并发症以及某些癌症的治疗中[17],但在白内障中的相关研究尚未见开展。本研究结果表明,5 μmol·L-1的黄芩苷可以减轻高糖诱导的人晶状体上皮细胞系HLE-B3的凋亡和氧化应激,流式细胞术及Western blot检测结果显示,相较于高糖组,低浓度黄芩苷干预后HLE-B3细胞活力明显升高,细胞凋亡率明显降低,Bax mRNA及蛋白相对表达量降低,Bcl-2 mRNA及蛋白相对表达量升高;酶标法检测结果显示,低浓度黄芩苷干预后HLE-B3细胞SOD活力及GSH-Px含量均较高糖组升高,MDA含量较高糖组降低。由此提示,低浓度黄芩苷可以通过抑制凋亡和氧化应激来延缓糖尿病性白内障的发生。本研究还发现,低浓度黄芩苷对人晶状体上皮细胞系HLE-B3有保护作用,但随着浓度增高,此种作用却不再明显。黄芩苷可以在不同的细胞中表现出不同的作用,也有研究显示,黄芩苷在同一种细胞中具有双重作用。Zhu等[17]研究发现,低浓度的黄芩苷可以促进血管中的上皮细胞增殖,而高浓度黄芩苷则通过诱导其凋亡来抑制血管生成;Lu等[18]研究显示,低浓度黄芩苷可以促进破骨细胞分化和骨吸收,而高浓度时则对破骨细胞的分化有抑制作用。由此我们推测,黄芩苷在人晶状体上皮细胞中也可能具有双重作用,但仍需要进一步验证。
Keap1-Nrf2-ARE通路是对抗氧化应激最有效的防御系统之一,它能调节许多抗氧化基因的转录,维持细胞内稳态[4]。Nrf2是一种重要的核转录诱导因子,Keap1是Nrf2的负调节器,正常情况下,Keap1与Nrf2在细胞质内以复合物的形式相结合,Nrf2通过泛素化蛋白酶体途径被泛素化而被降解[7]。超过细胞自由基清除系统能力的活性氧的超生理水平可以引起氧化应激并激活促炎途径[19],为响应氧化应激,Nrf2从Keap1释放到细胞核,并与一种小Maf蛋白(肌腱膜纤维肉瘤癌基因同源物)异源二聚化。该复合物激活了一系列抗氧化和细胞保护蛋白的ARE依赖基因表达[20]。Keap1-Nrf2-ARE信号通路是一个综合的氧化还原体系,可以通过多个途径来调节细胞的氧化还原平衡。Nrf2信号通路调控的抗氧化蛋白酶主要包括HO-1、过氧化物酶-1、SOD、GSH-Px和γ-谷氨酰半胱氨酸合成酶等。Keap1-Nrf2-ARE信号通路对多种氧化应激相关的疾病,如癌症、糖尿病、神经退行性疾病等都具有相关性[5-6]。在糖尿病视网膜病变中,Müller细胞呈Nrf2阳性,且Keap1-Nrf2-ARE参与氧化应激反应,保护细胞免受凋亡[21];Li等[22]研究发现,黄芩苷显著上调 Nrf2信号通路及其下游基因表达,以对抗鸡支原体诱导的鸡胸腺细胞氧化应激和凋亡;另有研究显示,黄芩苷可通过激活Nrf2/ho-1介导的HIF-1alpha-BNIP3通路,减轻缺氧引起的心肌细胞H9c2凋亡[23];Meng等[24]发现,黄芩苷通过Nrf2-HO-1信号通路对抗氧化应激和炎症反应,从而保护机体免受脂多糖诱导的严重肺损伤;相关的其他研究有:黄芩苷通过激活Nrf2/HO-1通路来降低肾组织的氧化应激,从而对抗心脏手术相关急性肾损伤[25];黄芩苷在高血糖状态下的内皮保护作用可能部分归因于其通过Akt-GSK3B-fyn介导的Nrf2激活下调活性氧和炎症的作用[26];黄芩苷通过激活TBI小鼠Akt-Nrf2通路,起到神经保护作用[27];黄芩苷通过阻断Nrf2与Keap1的结合,诱导Nrf2磷酸化,激活Nrf2,从而减轻乙酰氨基酚诱导的肝毒性[28]。本研究结果发现,低浓度黄芩苷可以使Keap1 mRNA及蛋白相对表达量降低,Nrf2下游相关的NQO1、HO-1 mRNA及蛋白相对表达量升高。提示低浓度黄芩苷对高糖诱导的人晶状体上皮细胞凋亡和氧化应激的抑制作用可能是通过调节Keap1-Nrf2-ARE信号通路实现的。
综上,黄芩苷可通过Keap1-Nrf2-ARE信号通路抑制高糖诱导的人晶状体上皮细胞凋亡和氧化应激,但详细作用机制仍有待进一步研究。本研究为延缓糖尿病性白内障的发生发展提供了新的思路。
