微污染水源水处理的工艺优化试验分析
2021-06-01赵亚峰
赵亚峰
( 辽宁省朝阳水文局,辽宁 朝阳 122000)
水生物和源水深度处理是微污染水源当前主要的两种水处理方式,此外一些新的氧化以及超滤膜工艺和新技术也逐步被用于微污染水源处理中。目前,受技术和经济条件的限制,一些新技术和新工艺还未得到全面应用,许多新技术依旧在摸索阶段[1-5]。从国内微污染水源处理研究现状可看出[6-10],除了采用传统强化水处理技术,采用物理、化学以及生物相结合的技术对原水进行处理的工艺已逐步得到研究学者的关注和研究。近些年来,采用深度吸附处理的方式对微污染水源水中的有机污染物处理,活性炭、沸石以及硅藻土作为常用的吸附剂。目前,微污染水源公认的较为成熟的措施是采用活性炭进行吸附处理[11-14]。在这项技术中吸附污染物的回收利用处理不当将会增加工艺运行成本,同时处理系统的排泥量也会增加。因此,需要采用性价比较高的吸附方式对微污染水源水进行吸附以及再利用。为此,文章通过静态实验和动态实验,模拟实际生产运行条件,探讨微污染水源水处理的的工艺改造效果,以期研究成果在实际污水处理中具有更广泛的推广应用价值。
1 高锰酸钾单独氧化处理微污染水源水实验
采用高猛酸钾对微污染水源进行单独氧化处理,通过测定氧化前后的污染物指标,确定最优的药剂投放量以及氧化时间。
1.1 高锰酸钾投加量对污染物去除效果影响
在6个250ml锥形瓶中加入200ml水样,分别加入不同剂量的高锰酸钾,使得高锰酸钾浓度分别为0.5 、1.0 、1.5、2.0、2.5和3.0 mg/L,放入恒温摇床,摇床温度为5℃,转速为150r/min,振荡时间均为10min,测定高锰酸盐指数和氨氮浓度值,结果见表1。
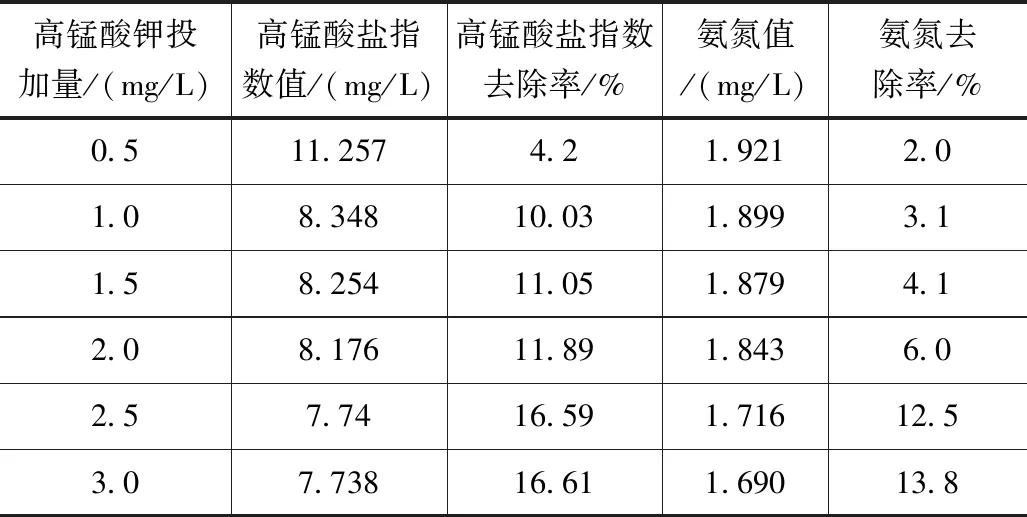
表1 高锰酸钾投加量对高锰酸盐指数和氨氮去除效果的影响
由表1可知,高锰酸钾投加量对高锰酸盐指数和氨氮去除率的影响较为明显,但随着投药量超过2.5 mg/L后,影响程度逐步降低,两项微水源污染处理指标的去除率分别稳定在16.61%与13.8%之间。
1.2 pH值对污染物去除效果影响
在5个250ml锥形瓶中加入200ml水样,加入高锰酸钾(浓度为2.5mg/L),调节水样pH值分别为5.0、6.2、7.1、8.2和9.6,放入恒温摇床,摇床温度为5℃,转速为150r/min,振荡时间均为10min,测定高锰酸盐指数和氨氮浓度值,结果见表2。
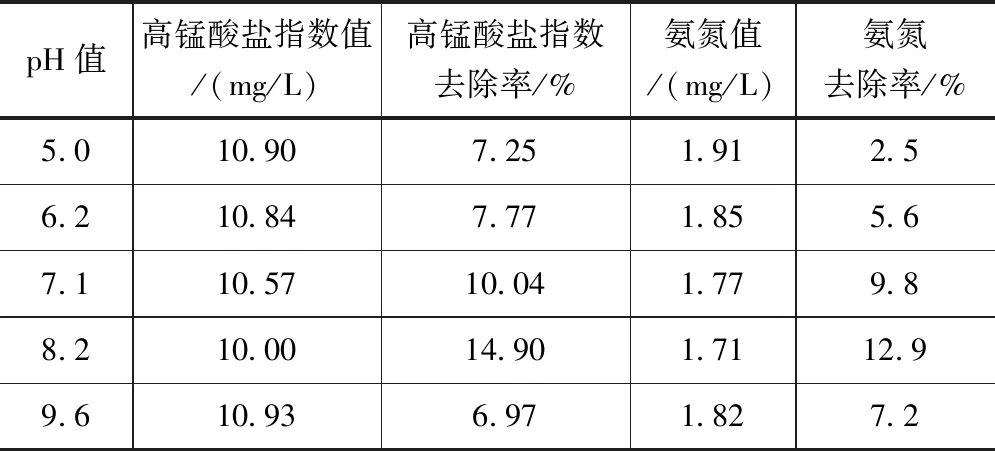
表2 pH值对高锰酸盐指数和氨氮去除效果的影响
据表2 中的pH对高锰酸盐指数和氨氮去除率的影响可知,不同的pH值对有机物的去除率影响程度较大。两项污染指标在碱性较弱的环境下影响程度明显高于酸性环境条件下,试验表明,pH稳定在7.1与8.2之间对高锰酸盐指数和氨氮两个指标的去除率可达到最优。
1.3 氧化时间对污染物去除效果影响
在6个250ml锥形瓶中加入200ml水样,均加入高锰酸钾(浓度为2mg/L),放入恒温摇床,摇床温度为5℃,转速为150r/min,振荡时间分别为5、10、15、20、30和60min,测定高锰酸盐指数和氨氮浓度值,见表3。
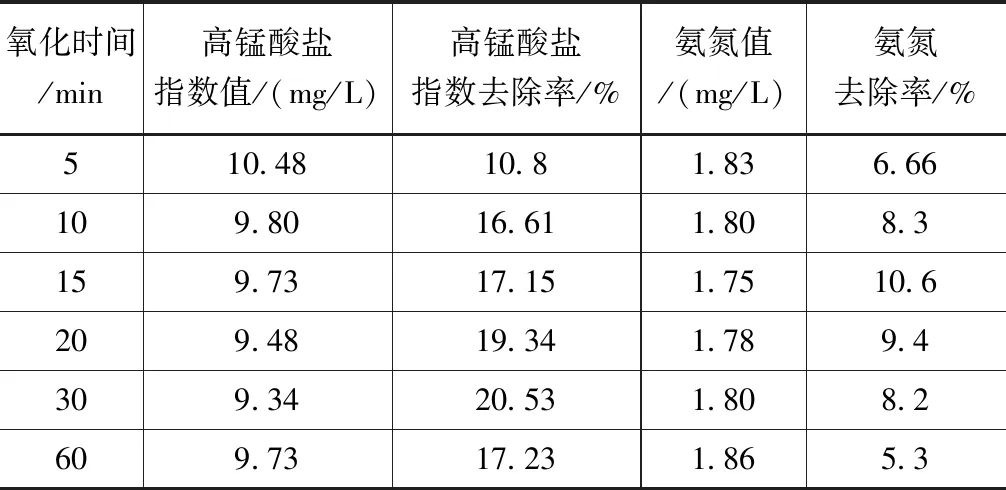
表3 氧化时间对高锰酸盐指数和氨氮去除效果的影响
由于高锰酸盐指数和氨氮氧化处理下的吸附率不同,30min氧化时间后高锰酸盐的吸附率最佳,氨氮在氧化15min后吸附率达到最优,且吸附率随着氧化时间的递增有所差异,且变动幅度较高。在相对较短的氧化时间内吸附率很难达到最优,也表明了高锰酸钾的氧化性较强。高锰酸钾总体来看对微污染水源单独氧化吸附效果较低,高锰酸盐指数和氨氮的吸附率分别在20%以及15%以内。试验也发现,高锰酸钾单独氧化,对浊度几乎没有去除效果,而且出现投加高锰酸钾量越大,对应浊度也越大的现象。因此,为了更好地处理微污染水源水,可以考虑投加絮凝剂以及后续用沸石吸附。
2 高锰酸钾与混凝剂联用处理微污染水源水
采用烧杯试验的方式将混凝剂与高锰酸钾进行混合使用,通过优化混凝剂以及氧化剂的使用量进行微污染水源处理的最优工艺。
2.1 投药顺序的确定
分别采用30mg/L的PAC以及3mg/L的PAM投入2.5mg/L的高锰酸钾中进行混合使用,对微污染水源水处理效果如图1所示。

图1 投药顺序对各污染因子去除率影响
从图1中可看出,高锰酸盐指数和氨氮的吸附率在优化混合后效果十分明显,从投放顺序可看出,浊度的吸附率在先氧化后混凝和后氧化先混凝的方式下效果明显,先氧化后混凝对高锰酸盐指数吸附率最高,三种方式对氨氮的吸附率总体可为30%~35%。通过各方式综合对比,先氧化后混凝对微污染水源的水处理效果最优。
2.2 最佳投药量确定
在6个250ml锥形瓶中加入200ml水样,先氧化后混凝方式下的PAC以及PAM作为固定絮凝剂,其用量分别为30、3mg/L,分别加入不同剂量的高锰酸钾,使得高锰酸钾浓度分别为0.5、1.0、1.5、2.0、2.5、3.0 mg/L,放入恒温摇床,摇床温度为5℃,转速为150r/min,氧化时间为25min,测定浊度、高锰酸盐指数和氨氮浓度值,并对做污染物去除率随高锰酸钾投加量变化曲线进行分析,分析结果见图2所示。

图2 不同药剂投放量影响下污染物去除效果分析曲线
从图2中可看出,高锰酸盐指数和氨氮的吸附率随着锰酸钾投加量的增加而逐步提高,但对浊度的效果影响相对较小,高锰酸盐指数和氨氮的吸附率在投入3.0 mg/L的高锰酸钾后达到最优。高锰酸盐指数和氨氮的含量分别为3.58和1.23 mg/L时,高锰酸盐指数和氨氮的含量已达到Ⅱ类水源水质标准。但为防止高锰酸钾投加过量(水略显粉红色,且高锰酸钾投加量过高会造成水中的Mn2+超标),高锰酸钾投加量控制为2.5mg/L,处理后的水用沸石吸附。
3 天然沸石吸附等温线实验
将4g天然沸石(粒径为30~100目) 以及氨氮浓度为25ml的溶液加入250ml锥形瓶,设置不同的初始浓度以及温度变化,并以150 r/min的转速对锥形瓶溶液进行恒温振荡,保持吸附平衡,上部的清液静置后采用微孔滤膜处理,对氨氮在滤液中的浓度进行测定。
3.1 Langmuir等温吸附模型
模型等温吸附试验的方程可简化为
(1)
式中,Ce—吸附浓度,mg/L;qe—平衡时的吸附量,mg/kg;qm—最大吸附量,mg/kg;K—等温吸附常数。
对不同温度下的吸附浓度进行拟合计算,拟合参数以及拟合结果分别见表4和图3。

表4 Langmuir等温方程参数

图3 吸附等温线的拟合
由表4可以看出,各温度下的拟合方程相关系数都较高,沸石对氨氮的吸附量最大值随着温度的增加从33.52 mg/g变化到35.78 mg/kg,吸附剂与溶剂按照液相吸附理论随着温度的升高,其亲和力逐步递增。溶液中氨氮在吸附过程中其周围吸附剂颗粒液膜阻力增加,从吸附剂的外层向内部细孔深处逐步扩散。溶液中氨氮随着温度的增加不但需要对液膜表面阻力进行抑制,而且可以有助于沸石从表面逐步向内部进行吸附氨氮,从而提高氨氮的吸附量。此外,低温下难以产生的化学反应可以在高温环境下发生。因此沸石对氨氮的吸附效果随着温度的升高而加大。
3.2 Freundlich等温吸附模型
Freundlich等温吸附模型化简后得到的直线方程为
(2)
式中,Ce—吸附平衡时溶液浓度,mg/L;qe—平衡时的吸附量,mg/kg;Kf、n—为模型吸附系数,该系数和吸附容量具有较高的相关度。通常认为,当1/n为0.01~0.5时,较容易吸附;当1/n大于2时,较难吸附。利用该模型对实验数据进行拟合分析,拟合方程参数见表5。

表5 Freundlich等温方程参数
4 天然沸石吸附动力学实验
吸附动力学试验主要表征浓度、时间以及温度之间的关联程度。不同温度以及不同时间下天然沸石对污染指标的吸附程度不同,通过吸附动力学试验对其速率以及浓度时间变化特征进行分析,结果见表6。
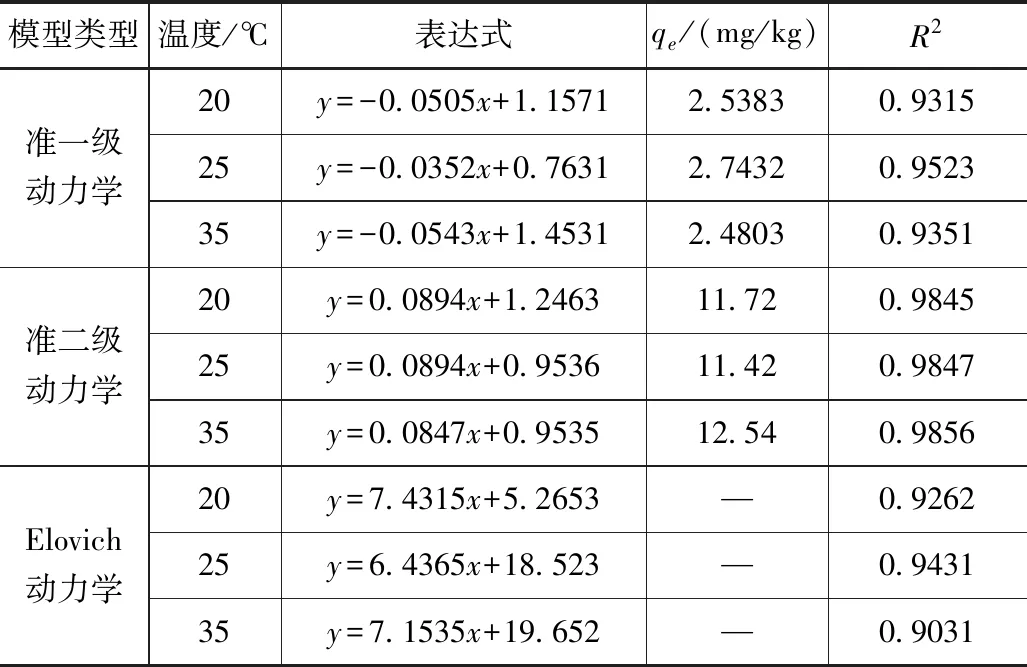
表6 不同温度下沸石吸附氨氮动力学表达式及参数
吸附速度受吸附剂影响主要表现为两个过程,第一个过程是吸附离子逐步向外进行分散,吸附速率受液膜扩散速影响逐步增加;第二个过程为颗粒从吸附剂表面经液膜逐步向细孔内气相进行扩散,在不离开孔壁状态下分孔壁上吸附的分子向相邻吸附位置进行转移。从天然沸石动力吸附试验分析结果可知,拟合效果可符合二级动力学方程的拟合要求,表明水溶液中氨氮的平衡吸附量采用等温条件下沸石的准二级动力学模型进行估算是合理的。
5 试验结论
(1)高锰酸盐指数和氨氮在中性和弱碱性条件下具有较好的吸附效果,而在酸性或碱性条件下吸附效果均有所降低,pH值适宜范围为7.2~8.3,当pH=8.3时吸附效果最优。
(2)高锰酸盐指数和氨氮的吸附率随着高锰酸钾投加量的增加而提升,但对水体浊度吸附影响较低,建议控制高锰酸钾投加量为2.5mg/L,以免投加的高锰酸钾过量,可采用沸石来吸附处理后的水源。
(3)微污染水源中浊度和氨氮吸附均建议采用先氧化后混凝的工艺,先氧化后混凝和后氧化先混凝对高锰酸盐指数吸附效果相似,都可采用。
